[摘要]元素雜質(zhì)在藥品中存在多種引入來(lái)源�,應(yīng)被控制在可接受的限度范圍內(nèi)。ICH于2022年正式發(fā)布了《Q3D(R2):元素雜質(zhì)指導(dǎo)原則》�,建立了藥品中元素雜質(zhì)研究的全球協(xié)調(diào)統(tǒng)一的指南。本文基于ICH Q3D(R2)梳理總結(jié)了元素雜質(zhì)的分類(lèi)及安全性評(píng)估原則�,從審評(píng)角度分析了風(fēng)險(xiǎn)評(píng)估及控制策略建立過(guò)程中的基本考慮�,就元素雜質(zhì)研究中的重點(diǎn)環(huán)節(jié)和主要問(wèn)題進(jìn)行了探討�,以期基于風(fēng)險(xiǎn)、基于科學(xué)為藥品中元素雜質(zhì)的研究和控制提供參考�。
藥品中有多種來(lái)源引入元素雜質(zhì),包括合成反應(yīng)中催化劑殘留�、輔料中存在而引入以及生產(chǎn)設(shè)備、包裝系統(tǒng)因相容性而引入的元素雜質(zhì)等[1]�。由于某些元素雜質(zhì)具有毒性,有的元素可能影響藥品的穩(wěn)定性�,因此元素雜質(zhì)在藥品中的含量需要被控制在可接受的限度范圍內(nèi)。為了便于建立藥品中元素雜質(zhì)研究的全球協(xié)調(diào)統(tǒng)一的指南�,ICH 于 2014年 11 月正式發(fā)布實(shí)施了《 Q3D:元素雜質(zhì)指導(dǎo)原則》。該指導(dǎo)原則提供了 24 種元素在口服�、注射、吸入3 種給藥途徑下的每日允許暴露量(PDE)�,介紹了元素雜質(zhì)分析評(píng)估方法和研究思路�。2019年3月,ICH 批準(zhǔn) Q3D(R1)正式發(fā)布�,該版本修訂了鎘(Cd)吸入途徑的 PDE 值。2022 年 Q3D(R2) 正式發(fā)布�,該版本修訂了附錄 2 中金(Au)、銀(Ag)和鎳(Ni)的 PDE 值�,修訂了附錄 3 中 Au 和 Ag 的各論,同時(shí)新增了附錄 5:皮膚和透皮給藥途徑的元素雜質(zhì)的限度[2]�。
原國(guó)家食品藥品監(jiān)督管理總局于 2017 年 6 月加入 ICH�,我國(guó)有序推進(jìn) ICH Q3D 實(shí)施�。2020 年 1月,國(guó)家藥品監(jiān)督管理局發(fā)布“關(guān)于適用《Q2(R1):分析方法論證:正文和方法學(xué)》等 11 個(gè)國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)指導(dǎo)原則的公告(2020 年第 7號(hào))”[3]�,明確適用 Q3D(R1)在內(nèi)的 11 個(gè) ICH 指導(dǎo)原則�,并明確“公告發(fā)布之日起 6 個(gè)月后開(kāi)始的藥學(xué)研究(以試驗(yàn)記錄時(shí)間點(diǎn)為準(zhǔn)) 適用該指導(dǎo)原則”�,即從 2020 年 7 月之后的上市申請(qǐng)要求按照Q3D(R1)開(kāi)展研究�。 針對(duì) Q3D(R2)版本指南�,ICH工作組在指南第 3 階段召開(kāi)了國(guó)內(nèi)專(zhuān)家工作組會(huì)�,討論了該指導(dǎo)原則的可行性及國(guó)內(nèi)實(shí)施建議�,并擬定 R2 實(shí)施建議要求與 R1 基本保持一致�,即正式發(fā)布公告后給予業(yè)界過(guò)渡期 6 個(gè)月。 中國(guó) ICH 辦公室于 2022 年 9 月將該版本中英文稿及實(shí)施建議進(jìn)行公開(kāi)征求意見(jiàn)[4]�,在公開(kāi)征求意見(jiàn)過(guò)程中�,未收到針對(duì)中文稿及實(shí)施建議的修訂意見(jiàn)�。 2023 年 1月�,國(guó)家藥品監(jiān)督管理局正式發(fā)布“關(guān)于適用《Q3D(R2):元素雜質(zhì)》�、《M10:生物分析方法驗(yàn)證及樣品分析》國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)指導(dǎo)原則的公告(2023 年第 16 號(hào))”[5]�,明確規(guī)定申請(qǐng)人需在現(xiàn)行藥學(xué)研究技術(shù)要求基礎(chǔ)上�,按照 Q3D(R2) 指導(dǎo)原則的要求開(kāi)展研究�;自 2023 年 7 月 29 日起開(kāi)始的相關(guān)研究( 以試驗(yàn)記錄時(shí)間點(diǎn)為準(zhǔn)) �,均適用Q3D(R2)指導(dǎo)原則�,Q3D(R1)指導(dǎo)原則同時(shí)停止實(shí)施�。
本文基于 ICH Q3D(R2)梳理總結(jié)了元素雜質(zhì)的分類(lèi)及安全性評(píng)估原則�,從審評(píng)角度分析了風(fēng)險(xiǎn)評(píng)估及控制策略建立過(guò)程中的基本考慮�,就元素雜質(zhì)研究中的重點(diǎn)環(huán)節(jié)和主要問(wèn)題進(jìn)行探討�,以期為基于風(fēng)險(xiǎn)�、基于科學(xué)進(jìn)行藥品元素研究提供參考�。
1�、元素雜質(zhì)研究的適用范圍
通常納入適用范圍的藥品應(yīng)參照 Q3D 開(kāi)展元素雜質(zhì)研究�。Q3D 適用于新制劑( 定義參見(jiàn) ICHQ6A[6]和 Q6B[7]) 以及含已有原料藥的新制劑,包括新藥�、仿制藥�,適用范圍包括純化蛋白質(zhì)和多肽(含重組或非重組來(lái)源)及其衍生物�,以及以它們作為組分的藥品(如偶聯(lián)物),還包括含化學(xué)合成多肽�、多聚核苷酸�、寡糖的藥品�。Q3D 不適用于植物藥�、放射性藥物�、疫苗�、細(xì)胞代謝產(chǎn)物�、DNA 產(chǎn)品�、過(guò)敏原提取物、細(xì)胞�、全血、血細(xì)胞成分或血液衍生物�,不適用于非體循環(huán)透析液以及為了治療作用而特意添加到藥品中的元素�,不適用于基于基因治療�、細(xì)胞治療等先進(jìn)治療藥品。Q3D 不適用于臨床研究階段藥品�,隨著商業(yè)開(kāi)發(fā)的進(jìn)程�,可參考 Q3D 評(píng)估藥品中可能存在的元素雜質(zhì)�。
同時(shí)�,需關(guān)注 Q3D(R2)附錄 5 的適用范圍�。該附錄適用于起局部作用或全身作用的皮膚和透皮給藥途徑(以下簡(jiǎn)稱(chēng)皮膚給藥途徑)藥品�,不適用于黏膜給藥(口腔�、鼻腔�、陰道)、局部眼科用藥�、直腸給藥、表皮下和真皮下給藥的藥品�。
2、元素雜質(zhì)的分類(lèi)及安全性評(píng)估
根據(jù)元素的毒性及其在藥品中出現(xiàn)的可能性�,按風(fēng)險(xiǎn)從高到低,將元素依次分為 3 類(lèi)�。1 類(lèi)元素具有明顯的毒性�,在藥品生產(chǎn)中應(yīng)限制使用或禁止使用,包括砷(As)�、Cd、汞(Hg) 和鉛( Pb)�。2 類(lèi)元素具有一定毒性,根據(jù)其出現(xiàn)的概率�,分為 2A 類(lèi)和2B類(lèi),其中2A類(lèi)在藥品中出現(xiàn)的相對(duì)可能性高�,包括鈷(Co)、Ni和釩(V)�。因此,基于風(fēng)險(xiǎn)考慮�,對(duì)于1 類(lèi)�、2A 類(lèi)元素,需要對(duì)所有給藥途徑和來(lái)源進(jìn)行風(fēng)險(xiǎn)評(píng)估�。2B 類(lèi)元素包括 Ag 和 Au、鈀( Pd)�、鉑(Pt)等,由于其元素豐度較低、與其他物料共生的可能性較低�,出現(xiàn)的概率較小,因此僅在有意添加的情形下需進(jìn)行風(fēng)險(xiǎn)評(píng)估�。3類(lèi)元素的特點(diǎn)是針對(duì)不同給藥途徑呈現(xiàn)不同的毒性,包括鋇(Ba)�、鉻(Cr)、(Cu)�、鋰(Li)等。Q3D 以 PDE 500 μg·d-1作為一個(gè)界限�,針對(duì)毒性較低、PDE > 500 μg·d-1的3 類(lèi)元素�,僅需在有意添加的情形下需要進(jìn)行風(fēng)險(xiǎn)評(píng)估。針對(duì)毒性較高�、PDE < 500 μg·d- 1的3類(lèi)元素�,則即使無(wú)意添加也需要進(jìn)行風(fēng)險(xiǎn)評(píng)估�。
對(duì)于 Q3D 指南表中未列出的其他元素�,如鋁(Al)、硼(B)、鈣(Ca)�、鐵(Fe)等�,由于固有毒性低或區(qū)域監(jiān)管的差異�,未被 Q3D 統(tǒng)一確定 PDE 值�,應(yīng)遵從適用于特定元素的其他指導(dǎo)原則和/ 或地方法規(guī)和規(guī)范。例如�,針對(duì)注射劑中的鋁元素,由于對(duì)于腎功能降低或受損的患者�,以及腎功能不成熟的早產(chǎn)兒和新生兒而言�,容易發(fā)生鋁元素中毒風(fēng)險(xiǎn),因此建議研究者針對(duì)此類(lèi)產(chǎn)品需關(guān)注進(jìn)行風(fēng)險(xiǎn)評(píng)估�,其中對(duì)于全腸外營(yíng)養(yǎng)類(lèi)產(chǎn)品(TPN)的大容量注射液中鋁元素含量通常不得超過(guò) 25 μg·L-1�。
Q3D 針對(duì)不同給藥途徑提供了元素雜質(zhì)的安全性評(píng)估原則,同一元素在不同給藥途徑下的 PDE值可能不同。對(duì)于口服�、注射�、吸入途徑�,可參考Q3D 附錄 2 提供的相應(yīng)給藥途徑下的 PDE 值�。對(duì)于皮膚給藥途徑�,可參考 Q3D 附錄 5 提供的皮膚給藥途徑下的 PDE 值和濃度限度(CTCL)值。對(duì)于其他給藥途徑�,Q3D 提供了評(píng)價(jià)原則的基本考慮�,當(dāng)有必要確定其他給藥途徑的 PDE 時(shí)�,可參考 Q3D指南中所述的概念進(jìn)行推算,推算的基本原則包括啟動(dòng)點(diǎn)的選擇�、生物利用度�、校正因子等考慮。
3�、元素雜質(zhì)研究的基本考慮
根據(jù)元素雜質(zhì)分析評(píng)估的研究思路�,風(fēng)險(xiǎn)評(píng)估可以分為 3 個(gè)環(huán)節(jié):首先,識(shí)別已知和潛在的元素雜質(zhì)來(lái)源�;然后確定實(shí)測(cè)或預(yù)測(cè)的雜質(zhì)水平�,通過(guò)與既定 PDE 值比較進(jìn)行風(fēng)險(xiǎn)評(píng)估�;最后�,總結(jié)和記錄風(fēng)險(xiǎn)評(píng)估�,確定合理的控制策略。 在風(fēng)險(xiǎn)評(píng)估的具體環(huán)節(jié)中�,應(yīng)結(jié)合品種特性進(jìn)行元素雜質(zhì)分析評(píng)估�,包括劑型�、給藥途徑�、藥品最大日劑量�、藥品及各組分的理化特性�、生產(chǎn)工藝等,從而科學(xué)地指導(dǎo)后續(xù)控制策略的合理建立�。
3.1 識(shí)別元素雜質(zhì)的潛在來(lái)源
在藥品生產(chǎn)中,元素雜質(zhì)的潛在來(lái)源主要包括:在原料藥�、輔料等藥品組分生產(chǎn)中有意添加元素;非有意添加但在藥品生產(chǎn)所用原料藥�、輔料及水中可能存在的元素,包括生產(chǎn)設(shè)備可能引入到原料藥和/ 或藥品中的元素以及包裝系統(tǒng)可能遷移至藥品中的元素[8]�。
在了解潛在來(lái)源的基礎(chǔ)上,需結(jié)合給藥途徑�、生產(chǎn)工藝等信息,確認(rèn)各潛在來(lái)源中需要研究的元素雜質(zhì)種類(lèi)�。 針對(duì)所有給藥途徑,只要是有意添加的1�,2A,2B 和/ 或 3 類(lèi)元素都需要進(jìn)行風(fēng)險(xiǎn)評(píng)估。 針對(duì)非有意添加的元素�,則需按不同給藥途徑的要求進(jìn)行分析評(píng)估�。 其中�,對(duì)于口服、注射�、吸入、皮膚給藥途徑�,1 類(lèi)和 2A 類(lèi)均需要進(jìn)行分析評(píng)估�;對(duì)于注射途徑�,除 1 類(lèi)和 2A 類(lèi)外�,還需對(duì) 3 類(lèi)元素中的Li�,Sb�,Cu 進(jìn)行分析評(píng)估;對(duì)于吸入途徑�,則需對(duì)全部 3 類(lèi)元素進(jìn)行分析評(píng)估�。 由此可見(jiàn),同一種原料藥或輔料等藥品組分�,當(dāng)不同供應(yīng)商采用不同生產(chǎn)工藝或與不同給藥途徑制劑關(guān)聯(lián)使用時(shí),在研究與評(píng)價(jià)中所關(guān)注的元素評(píng)估種類(lèi)可能不同�,需要結(jié)合品種具體情況具體分析�。 研究者可基于先驗(yàn)知識(shí)�、公開(kāi)發(fā)表的文獻(xiàn)�、相似工藝的數(shù)據(jù)�、供應(yīng)商信息或數(shù)據(jù)�、制劑組分和/ 或制劑的檢驗(yàn)等信息和數(shù)據(jù)用于支持風(fēng)險(xiǎn)評(píng)估�。 其中�,原料藥、輔料�、包裝系統(tǒng)和生產(chǎn)設(shè)備供應(yīng)商提供的關(guān)于潛在元素雜質(zhì)的信息有助于研究者的風(fēng)險(xiǎn)評(píng)估�。
3.2確定實(shí)測(cè)或預(yù)測(cè)的雜質(zhì)水平
通常可采用藥品方法和藥品組分方法[9] 對(duì)雜質(zhì)水平進(jìn)行實(shí)測(cè)或預(yù)測(cè),并將結(jié)果與 PDE 值進(jìn)行比較�。 其中藥品方法是直接對(duì)代表批藥品中元素雜質(zhì)進(jìn)行檢查�,采用該方法同樣需要對(duì)可能引入的元素雜質(zhì)來(lái)源進(jìn)行分析和風(fēng)險(xiǎn)評(píng)估。藥品組分方法是一種相對(duì)先進(jìn)的方法�,是對(duì)各組分可能引入的元素雜質(zhì)進(jìn)行識(shí)別�、評(píng)估和總結(jié)�,并將各組分引入的元素之和與 PDE 值進(jìn)行比較。 藥品組分方法的優(yōu)勢(shì)為便于開(kāi)展上游控制�、變更管理和 OOS 調(diào)查�。 如果某些藥品組分?jǐn)?shù)據(jù)缺失�,研究者也可以采用二者結(jié)合的評(píng)估方法。
在采用藥品方法和藥品組分方法進(jìn)行研究分析時(shí)�,可采用表1所列出的4種計(jì)算方法,將 PDE 值轉(zhuǎn)換為便于進(jìn)行藥品評(píng)價(jià)的濃度限度�。
其中,方法1和方法2a均為藥品組分方法�,且計(jì)算的是通用濃度限度,是以 PDE 值除以藥品最大日劑量計(jì)算濃度限度�,并將該限度用于規(guī)定每一種藥品組分。此類(lèi)研究方法的優(yōu)勢(shì)是在藥品開(kāi)發(fā)過(guò)程中�,藥品組分比例的任何調(diào)整均不會(huì)使藥品元素水平超出PDE�。方法 1 和方法 2a 之間的區(qū)別在于�,方法 1 以 10 g 作為每日最大劑量進(jìn)行計(jì)算,使用該方法的前提是假設(shè)藥品實(shí)際最大日劑量≤10 g�;而方法 2a 則以藥品實(shí)際最大日劑量進(jìn)行計(jì)算。
方法 2b 同樣為藥品組分方法�,但計(jì)算的是各組分特定的濃度限度。該方法以研究者設(shè)定的各組分中元素雜質(zhì)的允許濃度與藥品中各組分最大日劑量乘積之和進(jìn)行計(jì)算�,并要求低于 PDE 值。該方法尤其適用于某個(gè)元素在某些藥品組分中的最大允許濃度高于方法 1 或方法 2a 計(jì)算的通用濃度限度�,并需要由其他組分以更低的允許濃度進(jìn)行補(bǔ)償?shù)那樾巍?/span>
方法 3 是藥品分析方法,即測(cè)定最終藥品中每個(gè)元素的濃度�,要求藥品中元素雜質(zhì)的允許限度與藥品最大日劑量乘積低于 PDE 值。藥品分析方法比較直觀�,但需要注意的是,使用該方法存在一定的潛在風(fēng)險(xiǎn)�,若最終藥品實(shí)測(cè)結(jié)果超出了控制閾值或PDE 值而研究者對(duì)各組分缺乏深入分析評(píng)估,則很難發(fā)現(xiàn)風(fēng)險(xiǎn)的根源�,也就很難有針對(duì)性地建立額外的控制策略。
在進(jìn)行元素雜質(zhì)研究時(shí)�,應(yīng)考慮元素雜質(zhì)水平的變異性。通常在缺乏其他證明的情況下�,研究者可通過(guò)提供 3 批代表性生產(chǎn)規(guī)模或 6 批代表性中試規(guī)模的組分或藥品的數(shù)據(jù)來(lái)建立元素雜質(zhì)水平和變異性�。對(duì)于一些具有固有變異性的組分(如礦物來(lái)源輔料),可能還需要額外的數(shù)據(jù)。
3.3 風(fēng)險(xiǎn)評(píng)估和控制策略
研究者可以采用ICHQ9 中所述的質(zhì)量風(fēng)險(xiǎn)管理原則[10] 開(kāi)發(fā)藥品中元素雜質(zhì)的控制策略�。根據(jù)科學(xué)的認(rèn)知和原則進(jìn)行風(fēng)險(xiǎn)評(píng)估,風(fēng)險(xiǎn)評(píng)估的程度和形式應(yīng)與風(fēng)險(xiǎn)等級(jí)成正比�。研究者在得到各潛在元素分析評(píng)估的結(jié)果之后,可將各元素雜質(zhì)的分析結(jié)果分別與控制閾值和 PDE值進(jìn)行比較�,這是風(fēng)險(xiǎn)評(píng)估的重點(diǎn)環(huán)節(jié)之一�。控制閾值為 PDE 值的 30% 是判斷實(shí)測(cè)元素雜質(zhì)水平顯著性的衡量指標(biāo)�,也是決定后續(xù)是否啟動(dòng)額外控制的啟動(dòng)點(diǎn)。需要關(guān)注的是�,如藥品為皮膚給藥途徑,控制閾值還需考慮皮膚給藥途徑濃度限度(CTCL)值的 30% �。如兩者計(jì)算結(jié)果出現(xiàn)差異時(shí),應(yīng)按最低限度進(jìn)行要求�。
通過(guò)比較評(píng)估將產(chǎn)生 3 種情形,即元素雜質(zhì)分析結(jié)果分別低于控制閾值�、高于控制閾值但低于PDE 值以及高于 PDE 值。研究者應(yīng)根據(jù)具體情形依次確定合理的控制策略�。
首先,如果藥品中所有來(lái)源的總元素雜質(zhì)水平始終低于控制閾值�,那么當(dāng)研究者對(duì)數(shù)據(jù)進(jìn)行了適當(dāng)?shù)脑u(píng)估并證明了對(duì)元素雜質(zhì)的充分控制時(shí),則不再需要額外的控制�。
其次,如果某元素雜質(zhì)水平超出控制閾值但未超出 PDE 值�,那么就需要建立額外的控制方法以保證藥品中元素雜質(zhì)水平不超過(guò) PDE 值。額外的控制方法可以基于風(fēng)險(xiǎn)來(lái)源,選擇以下一種或幾種方式:調(diào)整生產(chǎn)工藝�,通過(guò)純化操作將元素雜質(zhì)降低至控制閾值之下;通過(guò)工藝過(guò)程中或上游控制�,將藥品中元素雜質(zhì)的濃度限制在控制閾值以下;建立輔料或物料(如合成中間體)的標(biāo)準(zhǔn)限度�;建立原料藥的標(biāo)準(zhǔn)限度;建立制劑的標(biāo)準(zhǔn)限度�;選擇合適的包裝系統(tǒng)等。具體選擇何種額外控制措施取決于研究者對(duì)風(fēng)險(xiǎn)的識(shí)別及把控程度�。
如果某元素雜質(zhì)水平超出 PDE 值,則首先應(yīng)考慮建立控制使之低于 PDE 值�。如果額外的控制經(jīng)過(guò)努力確實(shí)無(wú)法實(shí)現(xiàn)或無(wú)法成功,且在某些特定情形下(如間隔給藥�、短期給藥等)時(shí),可參考 Q3D 指南 3. 3 章節(jié)對(duì)高于既定 PDE 值的擬定水平進(jìn)行安全性論證�,例如使用調(diào)整因子的次因子法,該部分則更多涉及藥理毒理專(zhuān)業(yè)的研究與評(píng)價(jià)�。
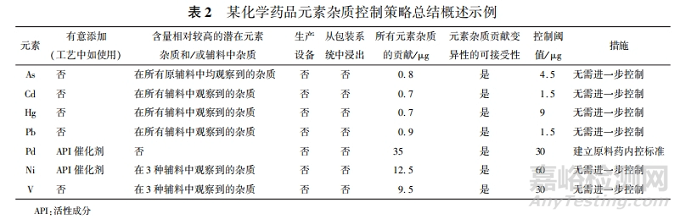
最后,需將風(fēng)險(xiǎn)評(píng)估的結(jié)果�、評(píng)估考慮、相應(yīng)的控制策略及結(jié)論以表格�、文字等形式進(jìn)行總結(jié)。表2 提供了某化學(xué)藥品元素雜質(zhì)控制策略總結(jié)概述的分析示例�。該示例通過(guò)回顧藥品中各組分有意添加的任何元素,確定與藥品生產(chǎn)所用輔料相關(guān)的任何潛在元素或雜質(zhì)�,確定從生產(chǎn)設(shè)備、包裝系統(tǒng)中浸出的任何已知或預(yù)期的元素雜質(zhì),記錄特定的元素雜質(zhì)并通過(guò)總結(jié)藥品各組分的貢獻(xiàn)�,計(jì)算潛在元素雜質(zhì)的總貢獻(xiàn)。在評(píng)估各組分中元素雜質(zhì)水平的變異性基礎(chǔ)上�,采用所有元素雜質(zhì)的總貢獻(xiàn)與控制閾值進(jìn)行對(duì)比。示例中的對(duì)比結(jié)果顯示�,除 Pd 元素外,其他元素雜質(zhì)均小于控制閾值�,無(wú)需進(jìn)一步控制;而藥品中 Pd 元素超出控制閾值�,需要建立額外的控制�。根據(jù)元素來(lái)源分析,該元素僅由原料藥合成工藝中的催化劑引入�,最終研究者選擇建立原料藥內(nèi)控標(biāo)準(zhǔn),以保證藥品中 Pd 水平不超過(guò) PDE 值�。
3.4 生命周期管理
ICH Q10指出藥品和工藝知識(shí)的管理應(yīng)從研發(fā)開(kāi)始并貫穿于藥品商業(yè)生命直至藥品撤市[11]。隨著商業(yè)化生產(chǎn)的經(jīng)驗(yàn)和數(shù)據(jù)的逐步積累�,這些知識(shí)可用來(lái)進(jìn)一步提升對(duì)工藝的理解和工藝性能,同時(shí)伴隨藥品某些組分的元素雜質(zhì)數(shù)據(jù)信息的積累豐富�,將有利于建立更加科學(xué)合理的元素雜質(zhì)控制策略。由此可見(jiàn)�,控制策略并非一成不變。如果藥品或組分的變更對(duì)藥品中元素雜質(zhì)的量有潛在影響�,研究者應(yīng)重新進(jìn)行風(fēng)險(xiǎn)評(píng)估,并對(duì)原來(lái)的控制策略進(jìn)行重新評(píng)估�。
3.5 Q3D(R2) 新修訂內(nèi)容及關(guān)注點(diǎn)
Q3D(R2)與 Q3D ( R1 ) 相比,主要有 3 方面的更新, 包括:① 修訂了附錄 2 中 Au�,Ag 和 Ni 的 PDE?;谡{(diào)整了計(jì)算中引用的校正因子、引用新的文獻(xiàn)數(shù)據(jù)等原因�,R2 版調(diào)整了 3 種元素 PDE。其中 Au 的口服�、注射、吸入途徑的 PDE 依次由“100�,100,1μg·d- 1”修訂為“300�,300,3μg·d-1”�;Ag的注射途徑PDE 由“10 μg·d- 1”修訂為“15μg·d-1”;Ni的吸入途徑PDE 由“5 μg·d- 1”修訂為“6μg·d-1”�。②相應(yīng)修訂了附錄 3 中 Au 和 Ag 的各論。③ 新增了附錄 5:皮膚和透皮給藥途徑的元素雜質(zhì)的限度�。由于除了口服、注射�、吸入途徑外,皮膚給藥途徑是尚未正式建立元素雜質(zhì) PDE 的藥品中占比較大的一類(lèi)�,在遵循 Q3D 基本原則的基礎(chǔ)上,R2 版經(jīng)協(xié)調(diào)統(tǒng)一研究提供了皮膚給藥途徑元素雜質(zhì)研究的具體要求�。
與其他給藥途徑相比�,皮膚給藥途徑藥品的元雜質(zhì)研究存在其獨(dú)特性。由于皮膚的功能特點(diǎn)�,皮膚是一種非常有效的環(huán)境屏障�,尤其是對(duì)帶電荷物質(zhì)(如金屬離子)。而元素雜質(zhì)通常與活性成分的理化性質(zhì)有很大差異�,現(xiàn)有數(shù)據(jù)表明,即使存在促滲劑�,元素雜質(zhì)通常也很難通過(guò)完整皮膚吸收。文獻(xiàn)報(bào)道大多數(shù)元素雜質(zhì)的全身暴露吸收均 < 1%[12]�。經(jīng) Q3D 工作組各個(gè)成員國(guó)家開(kāi)展的全面文獻(xiàn)調(diào)研,發(fā)現(xiàn)大多數(shù)元素雜質(zhì)及其配對(duì)離子的定量數(shù)據(jù)缺失�,因此 Q3D 決定建立一種適用于大多元素的通用安全限度計(jì)算方法。同時(shí)�,考慮到存在較多可能影響透皮吸收和全身生物利用度的影響因素,比如元素的物理狀態(tài)�、離子化�、溶解度、藥物給藥的持續(xù)時(shí)間�、給藥面積、身體部位等�,因此從風(fēng)險(xiǎn)最大角度衡量,指南最終確定�,對(duì)于除了 As 和鉈(Ti)之外的大多數(shù)元素雜質(zhì),在注射給藥途徑 PDE 的基礎(chǔ)上使用的是10倍系數(shù)�,即皮膚給藥途徑PDE是注射PDE的10倍。而對(duì)于As和Ti而言�,基于透皮吸收相關(guān)文獻(xiàn)報(bào)道�,分別確定其皮膚 PDE 為注射 PDE 的2 和 1 倍�。
在皮膚給藥途徑藥品的元素雜質(zhì)研究評(píng)價(jià)中,還引入的一個(gè)新概念�,即CTCL,提出這個(gè)概念的原因是對(duì)于Ni和Co�,元素雜質(zhì)的濃度可能引起過(guò)敏個(gè)體的皮膚反應(yīng)。因此�,除了PDE外,應(yīng)該限制濃度�。而對(duì)于其他元素雜質(zhì),由于引起過(guò)敏反應(yīng)的閾值約等于或遠(yuǎn)大于皮膚給藥途徑PDE�,因此不需要額外控制[13]。
皮膚用藥的風(fēng)險(xiǎn)評(píng)估基本考慮與前面所述一致�。需要額外注意的是,對(duì)于 Ni 和 Co�,除了考慮相對(duì)于PDE 的藥品中元素雜質(zhì)的水平外,還需要評(píng)估相對(duì)于CTCL 的藥品中該元素雜質(zhì)的濃度(μg·g- 1)�。當(dāng)兩者計(jì)算結(jié)果出現(xiàn)差異時(shí),應(yīng)符合最低限度要求�。如以 Co 為例,其 PDE 為 50 μg·d- 1�,如藥物最大日劑量1 g,計(jì)算出濃度為 50 μg·g- 1�,超出 CTCL35μg·g-1,評(píng)價(jià)時(shí)則應(yīng)使用 CTCL 限度 35 μg·g-1�;如藥物最大日劑量 10 g�,計(jì)算出濃度為 5 μg·g-1�,低于 CTCL,則應(yīng)使用 PDE 轉(zhuǎn)換的濃度限度 5 μg·g- 1�。
同時(shí),建議在研究中關(guān)注以下幾點(diǎn):①皮膚給藥途徑PDE適用于長(zhǎng)期每天皮膚給藥�。②考慮到受損的基底細(xì)胞層能夠促進(jìn)元素雜質(zhì)直接進(jìn)入真皮及其周?chē)埽赡軙?huì)增加全身吸收�。 因此,皮膚給藥途徑的 PDE 值不適用于治療表皮的基底細(xì)胞層受到實(shí)質(zhì)性破壞的皮膚給藥藥品�,如皮膚潰瘍、二度和三度燒傷�、大皰瘡等這種藥物會(huì)與真皮接觸的適應(yīng)證,但可適用于治療皮膚擦傷或者其他快速愈合急性損傷的藥品�,如小傷口、針刺等這些與表皮基底細(xì)胞層實(shí)質(zhì)性破壞無(wú)關(guān)的日常皮膚損傷�。 ③ 如皮膚給藥藥品的每日最大給藥劑量無(wú)法確定,建議對(duì)最差情況暴露進(jìn)行合理評(píng)估并以此作為后續(xù)風(fēng)險(xiǎn)評(píng)估的基礎(chǔ)�。 ④ CTCL 是按照每日用藥一次計(jì)算得出�,可接受的濃度可以根據(jù)每日最大使用次數(shù)以及對(duì)各種因素(如藥物在皮膚上的停留時(shí)間) 的評(píng)估進(jìn)行校正。
4�、結(jié)語(yǔ)
ICH Q3D(R2)是經(jīng) ICH 協(xié)調(diào)統(tǒng)一的元素雜質(zhì)研究指導(dǎo)原則,作為 ICH Q3 雜質(zhì)系列指南之一�,在已有的有機(jī)雜質(zhì)、無(wú)機(jī)雜質(zhì)�、殘留溶劑研究基礎(chǔ)上�,Q3D(R2)建立了元素雜質(zhì)的分析評(píng)估方法�,強(qiáng)調(diào)了風(fēng)險(xiǎn)評(píng)估理念,提供了口服�、注射、吸入�、皮膚給藥途徑中需分析評(píng)估的元素種類(lèi)及 PDE 值�,對(duì)于提升藥品質(zhì)量具有重要意義。 隨著科學(xué)發(fā)展技術(shù)進(jìn)步�,研究技術(shù)要求與國(guó)際接軌的目的是為了更好地服務(wù)于我國(guó)公眾健康需求和醫(yī)藥產(chǎn)業(yè)的發(fā)展�。 研究者應(yīng)根據(jù)產(chǎn)品特點(diǎn)參照 Q3D(R2)指南相關(guān)要求進(jìn)行風(fēng)險(xiǎn)評(píng)估,并基于風(fēng)險(xiǎn)�、基于科學(xué)合理制定元素雜質(zhì)控制策略,同時(shí)加強(qiáng)全生命周期管理�,以促使藥品整個(gè)生命周期的持續(xù)改進(jìn),為患者提供高質(zhì)量藥品�。