今日頭條
百奧泰IL-6R單抗類似藥獲FDA批準(zhǔn)上市���。百奧泰開發(fā)的生物類似藥IL-6R抗體托珠單抗注射液(BAT1806)獲FDA批準(zhǔn)上市���,商品名為Tofidence,用于治療類風(fēng)濕性關(guān)節(jié)炎���、多關(guān)節(jié)幼年特發(fā)性關(guān)節(jié)炎 (PJIA)和全身型幼年特發(fā)性關(guān)節(jié)炎(SJIA)����。Tofidence也是美國獲批的首個(gè)國產(chǎn)抗體類似藥,Biogen擁有BAT1806在除中國(包括香港���、澳門和臺(tái)灣)以外全球所有國家的注冊(cè)���、生產(chǎn)和商業(yè)化相關(guān)的獨(dú)占權(quán)利�。
國內(nèi)藥訊
1.北海康成IBAT抑制劑獲批香港上市�。北海康成從Mirum公司引進(jìn)的回腸膽汁酸轉(zhuǎn)運(yùn)體(IBAT)抑制劑氯馬昔巴特口服溶液(邁芮倍���,LIVMARLI®)獲香港監(jiān)管部門批準(zhǔn)上市����,用于治療3個(gè)月及以上阿拉杰里綜合征(ALGS)患者膽汁淤積性瘙癢�。在IIb期ICONIC研究中,maralixibat治療使這類患者瘙癢顯著下降并且維持4年�。今年6月,該新藥已在國內(nèi)獲批上市���,用于治療1歲及以上ALGS患者���。
2.和黃VEGFR抑制劑日本報(bào)NDA���。和黃醫(yī)藥與武田聯(lián)合開發(fā)的VEGFR抑制劑呋喹替尼已向日本厚生勞動(dòng)省提交新藥上市申請(qǐng),用于經(jīng)治轉(zhuǎn)移性結(jié)直腸癌成人患者����。在國際III期FRESCO2研究中,與安慰劑相比���,呋喹替尼治療組的mOS延長2.6個(gè)月�,mPFS延長1.9個(gè)月�。在中國,該新藥已獲批用于既往接受過氟嘧啶����、奧沙利鉑和伊立替康治療的轉(zhuǎn)移性結(jié)直腸癌患者。
3.恒瑞SGLT-2抑制劑新適應(yīng)癥報(bào)產(chǎn)�。恒瑞醫(yī)藥SGLT-2抑制劑1類新藥脯氨酸恒格列凈的新適應(yīng)癥上市申請(qǐng)獲CDE受理,與鹽酸二甲雙胍和磷酸瑞格列汀聯(lián)合使用���,配合飲食和運(yùn)動(dòng)改善成人2型糖尿病(T2DM)患者的血糖控制����。在關(guān)鍵Ⅲ期臨床(SHR3824-SP2086-MET-301)中,與鹽酸二甲雙胍和磷酸瑞格列汀相比���,三藥聯(lián)合組糖化血紅蛋白(HbA1c)相對(duì)基線下降幅度顯著更優(yōu)����。
4.創(chuàng)勝CLDN18.2單抗獲批胃癌國際Ⅲ期臨床����。創(chuàng)勝集團(tuán)CLDN18.2單抗osemitamab(TST001)獲FDA批準(zhǔn)開展國際Ⅲ期關(guān)鍵試驗(yàn)TranStar 301,聯(lián)合PD-1抗體納武利尤單抗及化療一線治療HER2陰性���、CLDN18.2表達(dá)局部晚期或轉(zhuǎn)移性胃癌或胃食管結(jié)合部腺癌患者。在I/II期臨床(NCT04495296)擴(kuò)展研究中���,中位隨訪為195天時(shí)����,Osemitamab(6mg/kg)達(dá)到66.7%的部分緩解����;預(yù)計(jì)中位PFS為9.5個(gè)月。此前���,osemitamab已獲得FDA授予治療胃癌和胰腺癌的孤兒藥資格�。
5.歌禮PD-L1單抗慢性乙肝IIb期臨床積極。歌禮皮下注射PD-L1抗體ASC22(恩沃利單抗)用于慢性乙肝(CHB)功能性治愈的IIb期擴(kuò)展隊(duì)列期中結(jié)果積極����。ASC22是一款旨在通過阻斷PD-1/PD-L1通路以達(dá)到慢性乙型肝炎功能性治愈的“First-in-class”免疫療法。24周數(shù)據(jù)顯示�,ASC22治療組和安慰劑組達(dá)到HBsAg清除的患者比例分別為21.1%和0%;ASC22總體耐受性良好�,藥物相關(guān)不良反應(yīng)大多為1級(jí)或2級(jí)。
6.拓新天成B7-H3靶向CAR-T獲批美國臨床�。拓新天成開發(fā)的靶向B7-H3的CAR-T產(chǎn)品TX103獲FDA批準(zhǔn)開展惡性腦膠質(zhì)瘤治療的臨床試驗(yàn)。今年6月�,F(xiàn)DA已授予該產(chǎn)品用于治療惡性腦膠質(zhì)瘤的孤兒藥資格。在臨床前研究中�,TX103能有效殺傷腫瘤細(xì)胞,并能清除小鼠模型中的實(shí)體腫瘤���,且未觀察到明顯的副反應(yīng)�。去年8月�,國家藥監(jiān)局已批準(zhǔn)該產(chǎn)品開展用于治療晚期實(shí)體瘤經(jīng)治患者的IND申請(qǐng)。
國際藥訊
1.龐貝病雙成分療法獲FDA批準(zhǔn)上市����。Amicus公司人源重組酸性α-葡萄糖苷酶Pombiliti(cipaglucosidase alfa)與口服酶穩(wěn)定劑 Opfolda(miglustat)65mg膠囊組合方案獲FDA批準(zhǔn)上市���,用于治療晚發(fā)型龐貝病患者。在關(guān)鍵Ⅲ期臨床PROPEL中����,與標(biāo)準(zhǔn)治療alglucosidase alfa相比,聯(lián)合治療顯著改善患者的療效指標(biāo)���。此前�,該組合方案已獲得FDA突破性療法認(rèn)定���。
2.抑郁癥新藥「吉哌隆」獲FDA批準(zhǔn)上市���。Fabre-Kramer公司新型口服選擇性5-羥色胺(5-HT)1A受體激動(dòng)劑EXXUA(吉哌?。┇@FDA批準(zhǔn)上市,用于治療成人重度抑郁癥(MDD)����。在臨床試驗(yàn)中,EXXUA獨(dú)特的機(jī)制可有效緩解抑郁癥狀����,而且藥物產(chǎn)生的性副作用與安慰劑相當(dāng)���,不被納入EXXUA標(biāo)簽不良反應(yīng)部分的發(fā)生率標(biāo)準(zhǔn)。目前�,該產(chǎn)品還被開發(fā)用于焦慮癥、低反應(yīng)性性欲障礙等適應(yīng)癥�。
3.精神分裂癥新藥KarXT報(bào)NDA。Karuna公司口服M1/M4型毒蕈堿型乙酰膽堿受體激動(dòng)劑KarXT(xanomeline-trospium)已向FDA提交新藥上市申請(qǐng)(NDA)���,用于治療精神分裂癥成人患者����。在EMERGENT系列研究中�,KarXT均達(dá)到主要終點(diǎn),KarXT治療患者的陽性和陰性綜合征量表 (PANSS) 總分的降低較安慰劑均具有統(tǒng)計(jì)學(xué)顯著性�。再鼎醫(yī)藥擁有該新藥在大中華區(qū)的獨(dú)家權(quán)益。
4.埃萬妥單抗肺癌頭對(duì)頭III期研究積極���。強(qiáng)生旗下楊森EGFR/c-MET雙抗Rybrevant(amivantamab�,埃萬妥單抗)聯(lián)合第三代EGFR抑制劑Lazertinib治療EGFR突變局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)的III期MARIPOSA研究達(dá)到主要終點(diǎn)���。與奧希替尼相比�,Rybrevant+Lazertinib方案顯著改善患者的無進(jìn)展生存期(PFS);患者中期總生存期(OS)數(shù)據(jù)也具有獲益趨勢(shì)����;而且聯(lián)合用藥安全性特征與既往研究一致。
5.抗精神障礙創(chuàng)新療法Ⅱb期臨床成功����。Bionomics公司開發(fā)的α7煙堿型乙酰膽堿受體的負(fù)向別構(gòu)調(diào)節(jié)劑BNC210,在治療創(chuàng)傷后應(yīng)激障礙的Ⅱb期ATTUNE試驗(yàn)達(dá)到主要與次要終點(diǎn)���。第12周時(shí)�,患者的DSM-5創(chuàng)傷后應(yīng)激障礙量表(CAPS-5)的評(píng)分�,以及Montgomery-Åsberg抑郁評(píng)分量表(MADRS)和失眠嚴(yán)重性指數(shù)(ISI)的評(píng)分均具有統(tǒng)計(jì)學(xué)意義的改善。此前���,該新藥已獲得FDA授予治療急性社交焦慮障礙(SAD)和其他焦慮相關(guān)疾病的快速通道資格����。
6.碩迪小分子GLP-1R激動(dòng)劑早期臨床積極���。Structure公司口服小分子GLP-1R激動(dòng)劑GSBR-1290治療超重或肥胖健康成人的Ⅰb期臨床結(jié)果積極。最高劑量GSBR-1290(90mg)治療組28天后平均體重較基線減輕高達(dá)4.9kg�,安慰劑調(diào)整后體重降低高達(dá)4.9%���。藥物每日一次給藥后耐受性良好。該新藥目前正在Ⅱa期臨床中評(píng)估治療肥胖/超重健康成人患者或肥胖/超重并患有2型糖尿病 (T2DM) 患者的潛力���。
7.Madrigal公司募資5億美元推進(jìn)NASH療法上市�。Madrigal公司宣布將通過IPO募集約5億美元資金����,以用于加速其口服選擇性甲狀腺激素受體(THR)-β激動(dòng)劑resmetirom的臨床開發(fā)及上市后商業(yè)化活動(dòng)。今年9月中旬�,F(xiàn)DA已授予該新藥優(yōu)先審評(píng)資格,PDUFA日期為明年3月14日���。在Ⅲ期臨床MAESTRO-NASH中�,resmetirom(100mg)治療52周后�,患者肝臟脂肪水平平均降低51%;肝纖維化����、肝臟體積和脾臟體積也顯著降低。
醫(yī)藥熱點(diǎn)
1.2023年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)揭曉���。近日�,諾獎(jiǎng)委員會(huì)宣布將2023年諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)授予Katalin Kariko博士和Drew Weissman博士,以獎(jiǎng)勵(lì)他們?cè)?span style="color:#ff0000;">mRNA疫苗上做出突破性貢獻(xiàn)�。他們通過核苷堿基修飾,使開發(fā)出有效的抗COVID-19 mRNA疫苗成為可能�。在新冠疫情中,基于mRNA技術(shù)的新冠疫苗為無數(shù)人帶來了保護(hù)�,并改變了全球?qū)剐鹿谝咔榈母窬帧?/span>
2.西部門診管理聯(lián)盟成立。9月28日���,西部門診管理聯(lián)盟���、西部多學(xué)科(罕見病)管理聯(lián)盟在陸軍軍醫(yī)大學(xué)新橋醫(yī)院正式成立����,軍地54家醫(yī)院簽訂深化醫(yī)聯(lián)體合作專科聯(lián)盟協(xié)議并授牌���。聯(lián)盟重點(diǎn)聚焦門診規(guī)范管理����、人才培養(yǎng)���、疑難危急重癥多學(xué)科會(huì)診等領(lǐng)域���,旨在建立完善西部門診管理專業(yè)的服務(wù)網(wǎng)絡(luò)構(gòu)架,實(shí)現(xiàn)區(qū)域患者首診����、常見病、慢性病�、康復(fù)期在基層,疑難危急重癥在上級(jí)醫(yī)院的分級(jí)診療模式�,提升門診服務(wù)質(zhì)量。
3.溫州醫(yī)科大學(xué)老年醫(yī)院揭牌����。9月27日,溫州醫(yī)科大學(xué)老年醫(yī)院����、老年醫(yī)學(xué)學(xué)院、老年研究院在溫州醫(yī)科大學(xué)附屬第一醫(yī)院正式掛牌����,意味著醫(yī)療、教學(xué)�、科研三位一體的綜合性老年醫(yī)學(xué)中心正式建立。老年醫(yī)學(xué)中心將以建設(shè)國家級(jí)老年醫(yī)學(xué)中心為目標(biāo)���,依托溫州醫(yī)科大學(xué)����、甌江實(shí)驗(yàn)室高層次人才和溫醫(yī)大附一院學(xué)科優(yōu)勢(shì),圍繞健康老齡化問題推進(jìn)產(chǎn)學(xué)研醫(yī)協(xié)同創(chuàng)新�,落實(shí)“醫(yī)養(yǎng)一體”理念,持續(xù)提升老年健康服務(wù)水平����。
4.黑龍江中醫(yī)藥大學(xué)附一院啟動(dòng)“中醫(yī)日間病房”。黑龍江中醫(yī)藥大學(xué)附屬第一醫(yī)院于10月份正式啟動(dòng)“中醫(yī)日間病房”服務(wù)�。這是一種創(chuàng)新的中醫(yī)醫(yī)療服務(wù)模式,可為患者提供了一種方便����、快捷的治療方式,讓患者在享受中醫(yī)優(yōu)質(zhì)服務(wù)的同時(shí)�,也能節(jié)省時(shí)間和費(fèi)用。參保人員在定點(diǎn)醫(yī)療機(jī)構(gòu)發(fā)生的日間病房費(fèi)用實(shí)行“一站式”直接結(jié)算�,參保人員只需承擔(dān)個(gè)人負(fù)擔(dān)的部分醫(yī)療費(fèi)用。
評(píng)審動(dòng)態(tài)
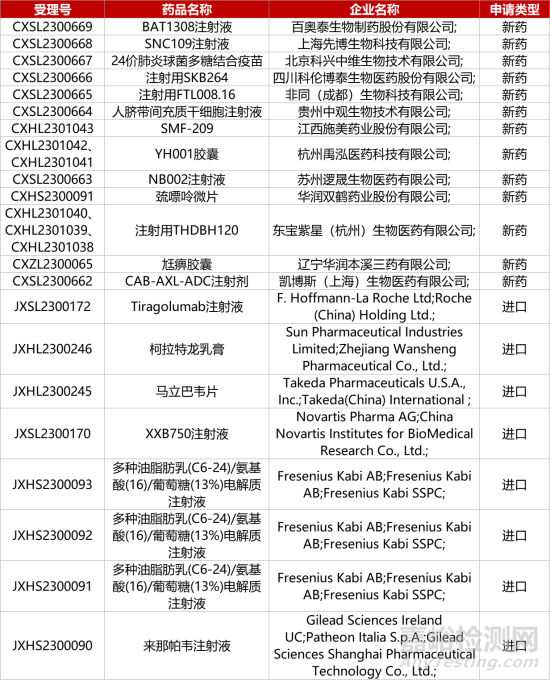
1. CDE新藥受理情況(10月08日)
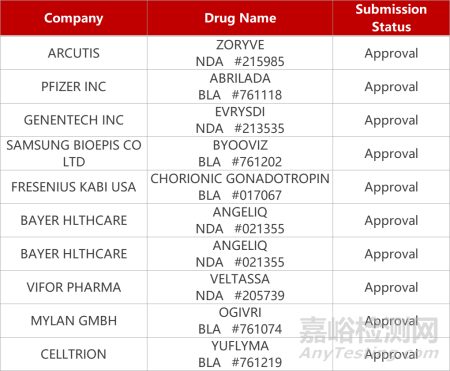
2. FDA新藥獲批情況(北美10月05日)