今日頭條
必貝特雙靶點(diǎn)PI3K/HDAC抑制劑報(bào)產(chǎn)����。必貝特醫(yī)藥PI3K/HDAC雙靶點(diǎn)1類新藥注射用雙利司他(BEBT-908)的上市申請(qǐng)獲CDE受理,用于治療既往至少兩種系統(tǒng)療法經(jīng)治的復(fù)發(fā)或難治性彌漫性大B細(xì)胞淋巴瘤(r/r DLBCL)成人患者�。在Ⅱa期臨床中,由獨(dú)立影像評(píng)估委員會(huì)(IRC)評(píng)估和研究者評(píng)估的客觀緩解率(ORR)均高于與CDE達(dá)成的附條件上市要求��,且雙利司他可顯著延長患者的總生存期����。
國內(nèi)藥訊
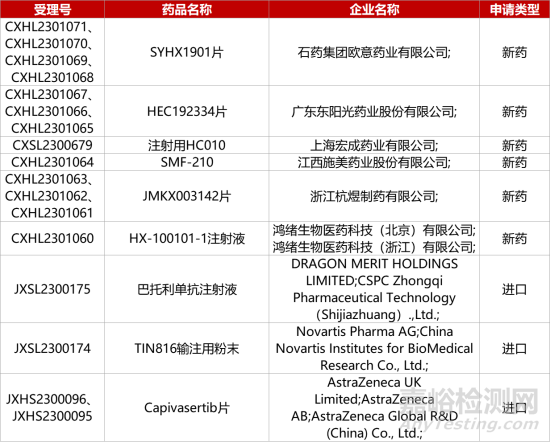
1.阿斯利康A(chǔ)KT抑制劑中國報(bào)產(chǎn)。阿斯利康A(chǔ)KT抑制劑Capivasertib上市申請(qǐng)獲CDE受理����,推測適應(yīng)癥為“聯(lián)合Faslodex(氟維司群)治療內(nèi)分泌療法經(jīng)治��、HR+/HER2-局部晚期或轉(zhuǎn)移性乳腺癌患者”����。在國際III期CAPItello-291研究中����,這一組合使患者疾病進(jìn)展或死亡風(fēng)險(xiǎn)降低40%�。今年6月,F(xiàn)DA已受理該組合療法新藥申請(qǐng)(NDA)并授予優(yōu)先審評(píng)資格��,PDUFA日期為2023年第四季度�。
2.甘李2款速效胰島素歐洲報(bào)產(chǎn)。甘李藥業(yè)門冬胰島素注射液(商品名為銳秀霖)和賴脯胰島素注射液(商品名為速秀霖)的上市許可申請(qǐng)(MAA)獲得歐洲藥品管理局(EMA)受理����,兩款胰島素類似物均適用于與長效胰島素聯(lián)合使用,以實(shí)現(xiàn)糖尿病患者的基礎(chǔ)與餐后血糖控制��。銳秀霖皮下注射后10~20分鐘內(nèi)起效��,作用持續(xù)時(shí)間為3~5小時(shí)��;速秀霖皮下注射后10-15分鐘起效����,作用持續(xù)2-5小時(shí)����。
3.羅氏GPRC5D/CD3雙抗獲批中國臨床��。羅氏靶向GPRC5D和CD3的雙特異性抗體forimtamig(RG6234)獲國家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可�,擬開發(fā)用于治療多發(fā)性骨髓瘤。RG6234能夠?qū)細(xì)胞募集到腫瘤周圍����,進(jìn)而引發(fā)抗腫瘤免疫反應(yīng)。公布于EHA2022年會(huì)上的Ⅰ期臨床結(jié)果顯示�,forimtamig單藥治療在復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者中的總緩解率(ORR)達(dá)到71.4%,其中52.4%的患者達(dá)到非常好的部分緩解�。
4.麥濟(jì)IL-4Rα單抗美國獲批皮炎臨床。麥濟(jì)生物IL-4Rα單抗MG-K10(Comekibart)獲FDA批準(zhǔn)開展Ib期臨床研究��,評(píng)估用于美國成人中重度特應(yīng)性皮炎患者中的安全性��、藥代動(dòng)力學(xué)及初步有效性��。MG-K10通過抑制Th2信號(hào)通路����,有望靶向精準(zhǔn)治療中重度特應(yīng)性皮炎�、中重度哮喘等疾病�。在國內(nèi),MG-K10已在治療特應(yīng)性皮炎的II期臨床達(dá)到主要終點(diǎn)����;該新藥也正在II期臨床中評(píng)估用于哮喘的治療潛力����。
5.恒瑞SHR-2022注射液獲批腫瘤臨床。恒瑞醫(yī)藥1類生物制品SHR-2022注射液獲國家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可�,將針對(duì)晚期或轉(zhuǎn)移性惡性腫瘤適應(yīng)癥開展臨床試驗(yàn)。據(jù)悉����,SHR-2022注射液可通過阻斷免疫抑制性信號(hào)通路,增強(qiáng)適應(yīng)性免疫應(yīng)答�。目前國內(nèi)外尚無同類產(chǎn)品獲批上市。據(jù)2023年披露的公告信息統(tǒng)計(jì)��,該公司今年至少有46款藥物獲批臨床試驗(yàn)�。
6.科霸LILRB2/PD-L1雙抗報(bào)實(shí)體瘤IND。科霸生物自主開發(fā)的靶向LILRB2和PD-L1的雙特異抗體藥物SPX-303向FDA遞交臨床申請(qǐng)����,擬開展用于晚期或難治性實(shí)體瘤治療的Ⅰ期臨床試驗(yàn)��。SPX-303同時(shí)阻斷人體免疫系統(tǒng)的兩個(gè)關(guān)鍵免疫檢查點(diǎn)LILRB2和PD-L1����,從而使免疫系統(tǒng)能夠更高效地鑒別并有效地清除惡性腫瘤細(xì)胞�。
國際藥訊
1.太陽制藥氘代蘆可替尼報(bào)斑禿NDA。印度太陽制藥口服JAK1/JAK2抑制劑氘代蘆可替尼(Deuruxolitinib��,CTP-543)用于治療中重度斑禿(alopecia areata�,AA)的新藥申請(qǐng)獲FDA受理。在兩項(xiàng)III期研究(THRIVE-AA1和THRIVE-AA2)中��,與安慰劑組相比��,deuruxolitinib(8mg和12mg)組患者第24周實(shí)現(xiàn)脫發(fā)嚴(yán)重程度SALT評(píng)分≤20分的比例顯著更高(29.6%和41.5%�,vs0.8%;33.0%和38.3%��,vs0.8%)��。
2.IL36R抗體泛發(fā)性膿皰性銀屑?���、笃谂R床積極。AnaptysBio公司IL36R單抗imsidolimab治療泛發(fā)性膿皰性銀屑病(GPP)復(fù)發(fā)患者的國際Ⅲ期GEMINI-1試驗(yàn)達(dá)到主要終點(diǎn)��。與安慰劑相比,單次靜脈注射Imsidolimab(750mg)第4周時(shí)顯著提高達(dá)到皮膚癥狀GPPPGA 0/1(清除或幾乎清除)的患者比例(53.3%vs13.3%�,p=0.0131);藥物耐受性良好��,無嚴(yán)重不良反應(yīng)�。該公司計(jì)劃在2024年第三季度向FDA遞交上市申請(qǐng)。
3.Veru公司AR調(diào)節(jié)劑啟動(dòng)增?、騜期臨床。Veru公司選擇性雄激素受體調(diào)節(jié)劑(SARM)enobosarm將開展一項(xiàng)Ⅱb期臨床����,評(píng)估用于接受GLP-1R激動(dòng)劑司美格魯肽或tirzepatide治療的肥胖癥患者中��,進(jìn)一步減少患者脂肪量�、并防止肌肉萎縮和骨密度下降的有效性和安全性。此前�,在老年男性和絕經(jīng)后女性中,enobosarm治療已顯示出減少脂肪量�、顯著增加肌肉質(zhì)量,并改善肌肉強(qiáng)度和身體功能的潛力�。
4.H3R拮抗劑治療過度嗜睡Ⅱ期臨床積極。Harmony Biosciences選擇性H3R拮抗劑/反向激動(dòng)劑pitolisant(Wakix)治療Prader-Willi綜合征(PWS)患者的白日過度嗜睡(EDS)癥狀的Ⅱ期臨床最新數(shù)據(jù)積極�。在6歲-12歲隊(duì)列中,pitolisant均能改善ABC-2(異常行為量表-2)所涵蓋的行為障礙指標(biāo);pitolisant組患者在針對(duì)EDS的照料者整體嚴(yán)重性印象評(píng)分(CaGI-S)的降低也更大�。該公司計(jì)劃在2023年第四季度啟動(dòng)Ⅲ期注冊(cè)TEMPO研究����。
5.FIC新藥奧爾波特綜合癥Ⅱ期臨床積極�。Eloxx公司潛在“first-in-class”小分子氨基糖苷類藥物ELX-02治療攜帶無義突變的奧爾波特綜合征(Alport syndrome)患者的Ⅱ期臨床結(jié)果積極。ELX-02旨在通過與核糖體RNA復(fù)合體結(jié)合��,讓核糖體可以通讀(read through)無義突變導(dǎo)致過早出現(xiàn)的終止密碼子�,以促進(jìn)完整蛋白的生成。腎臟組織最新分析顯示�,在所有3例接受治療的患者中,ELX-02平均改善腎臟足細(xì)胞形態(tài)指標(biāo)60%�。尿蛋白肌酐比值(UPCR)評(píng)估顯示蛋白尿水平穩(wěn)定或得到改善。
6.RNAi療法治療ATTR-CM上市遭拒��。Alnylam公司RNAi療法patisiran(Onpattro)治療轉(zhuǎn)甲狀腺素蛋白淀粉樣變性心肌病(ATTR-CM)的補(bǔ)充上市申請(qǐng)(sNDA)收到FDA完整回復(fù)函����。FDA認(rèn)為現(xiàn)有數(shù)據(jù)不足以支持sNDA申請(qǐng)。Patisiran是FDA批準(zhǔn)的首款RNAi療法�,此前已獲批用于治療遺傳性轉(zhuǎn)甲狀腺素蛋白淀粉樣變性多發(fā)性神經(jīng)病(ATTR-PN)��。Alnylam表示將專注另一款RNAi療法vutrisiran治療ATTR-CM的III期HELIOS-B研究��,不再尋求擴(kuò)大Patisiran的美國適應(yīng)癥����。
醫(yī)藥熱點(diǎn)
1.美國Kinnate公司關(guān)閉中國子公司�。近日��,美國腫瘤生物制藥公司Kinnate更新研發(fā)管線和調(diào)整戰(zhàn)略以削減運(yùn)營開支��,宣布暫停部分管線并裁撤70%的員工����。此次裁員,包括遣散Kinnate在中國的全資子公司�,即經(jīng)久生物的所有員工。經(jīng)久生物于2021年5月由Kinnate與多家投資機(jī)構(gòu)共同成立����,公司總部設(shè)立在上海��。根據(jù)此前規(guī)劃�,經(jīng)久生物負(fù)責(zé)Kinnate靶向腫瘤藥物在大中華區(qū)(包括中國大陸、香港�、臺(tái)灣和澳門)的研發(fā)和商業(yè)化。
2.腔面型乳腺癌“復(fù)旦分型”發(fā)布�。復(fù)旦大學(xué)附屬腫瘤醫(yī)院邵志敏、江一舟教授團(tuán)隊(duì)�,聯(lián)合復(fù)旦大學(xué)生命科學(xué)院和人類表型組研究院��,以及上海市生物醫(yī)藥技術(shù)研究院的研究人員歷時(shí)5年攻關(guān)��,繪制了全球最大的腔面型乳腺癌多組學(xué)全景圖譜�,并提出“復(fù)旦腔面四分型”基礎(chǔ)上的精準(zhǔn)治療策略����。該項(xiàng)重要成果已于近日發(fā)表在國際頂級(jí)期刊《自然?遺傳學(xué)》。
3.廣東:進(jìn)一步限制采購進(jìn)口醫(yī)療設(shè)備�。近日,廣東省財(cái)政廳印發(fā)《政府采購常見問題清單》����,列舉出政府采購活動(dòng)中的64類禁止性情形,多項(xiàng)限制國產(chǎn)��、違規(guī)采購進(jìn)口設(shè)備的行為也被納入其中����。其中,《清單》第19類第61項(xiàng)要求:“禁止將除進(jìn)口貨物以外的生產(chǎn)廠家授權(quán)�、承諾、證明�、背書等作為資格要求和符合性要求”。也就是說,在醫(yī)療器械招標(biāo)采購活動(dòng)時(shí)�,對(duì)于國產(chǎn)產(chǎn)品設(shè)立一些廠家授權(quán)、承諾��、證明����、背書等作為資格要求和符合性要求的不合理招標(biāo)標(biāo)準(zhǔn)是嚴(yán)格禁止的�。
評(píng)審動(dòng)態(tài)
1. CDE新藥受理情況(10月10日)
2. FDA新藥獲批情況(北美10月06日)