內容提要:創(chuàng)新、優(yōu)化審評模式有助于提升醫(yī)療器械審評質效�。該文對廣東省等全國20 個省、直轄市的醫(yī)療器械審評模式進行調查研究���,對省級醫(yī)療器械審評模式現(xiàn)狀及存在的問題進行探討和總結,為省級審評機構醫(yī)療器械審評模式的建立和完善提供意見和建議�,同時為深化審評審批制度改革提供參考依據(jù)。
醫(yī)療器械技術審評是醫(yī)療器械上市前審批的關鍵環(huán)節(jié)���,是確保擬上市產品安全有效的重要手段[1]���。我國第三類醫(yī)療器械技術審評由國家藥品監(jiān)督管理局醫(yī)療器械技術審評中心負責執(zhí)行�,第二類醫(yī)療器械技術審評由省級藥品監(jiān)督管理部門負責執(zhí)行[2]����。各省醫(yī)療器械審評隊伍建設及能力建設情況存在很大區(qū)別,對產品審評審批的風險把控能力參差不齊�。近年來,多個省在審評審批制度優(yōu)化上采取了一列的改革措施[3,4]���?!?ldquo;十四五”國家藥品安全及促進高質量發(fā)展規(guī)劃》將持續(xù)深化審評審批制度改革作為重要任務之一[5]�。為推進省級醫(yī)療器械審評機構技術審評能力提升,加強創(chuàng)新支撐���,推進科學審評���,本文從創(chuàng)新、優(yōu)化審評模式角度出發(fā)進行研究探討����,以期通過審評模式的優(yōu)化促進省級醫(yī)療器械技術審評質量及效率提高,同時為持續(xù)深化審評審批制度改革提供參考依據(jù)���。
1.資料與方法
1.1 一般資料
試驗起止時間:2021年10月~2021年12月����。
研究對象:承擔第二類醫(yī)療器械技術審評的省級醫(yī)療器械審評機構。本次調研對象包括廣東省等全國20 個省或直轄市(以下簡稱“省”)���,涵蓋產業(yè)發(fā)達省份���、較發(fā)達省份和欠發(fā)達省份。
1.2 方法
通過文獻及各省公開發(fā)布的文件分析����,設計調研問卷,調研內容包括審評隊伍建設情況�、審評模式建立情況、溝通交流方式及渠道���、創(chuàng)新審評模式等問題����。同時對需要具體了解的情況進行實地或線上調研���。
1.3 數(shù)據(jù)分析
對調研中涉及到的數(shù)據(jù)使用Excel軟件進行數(shù)據(jù)分析�。
2.結果
2.1 審評人員結構現(xiàn)狀
本次調研20 個省關于人員結構部分獲取部分信息:共獲取13 個省份的人員數(shù)量信息����,11 個省份人員學歷信息,7 個省份人員職稱信息����。
據(jù)統(tǒng)計,13 省級技術審評部門中從事醫(yī)療器械技術審評的人員為219 人����,其中7 個省份審評人員超過20 人,平均人數(shù)為17 人�。可獲取數(shù)據(jù)的省份人員學歷方面�,碩士以上學歷占比66%,本科以上占比99%�;職稱方面,高級職稱占比18%����,中級以上占比85%。
從專業(yè)背景角度看���,219 名審評員專業(yè)背景主要為醫(yī)學�、藥學、理工����、生物、化學���、臨床�、材料���、醫(yī)學檢驗�、食品等專業(yè)�。從工作經驗角度看,調研省份的審評員多數(shù)具有多年醫(yī)療器械審評相關工作經驗���,有些甚至有10~20年工作經驗���。
2.2 審評人均辦件數(shù)量分析
據(jù)統(tǒng)計,2020 年大多數(shù)省份的人均辦件量在100 件以內�,但有些省份人均辦件量高達數(shù)百件,人均辦件量最高的省份高達460 件/ 人�,可獲取數(shù)據(jù)的11 省份人均辦件量81 件/ 人。國家藥品監(jiān)督管理局對審評員辦件的要求為“原則上,年均申報注冊數(shù)每30~50件���,應當配備1~2名專職審評員”[6]。目前大多數(shù)省的人均辦件數(shù)超過國家藥監(jiān)局的要求���,部分省份審評人員處于極端高負荷運轉狀態(tài)���。
2.3 各省醫(yī)療器械審評的具體審評模式
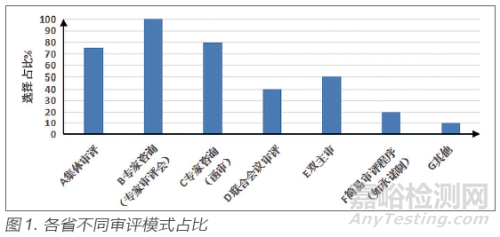
本次調研根據(jù)常見審評模式情況,設計了七個選項�,調研結果見圖1。
從調研結果可知�,除一省由于人員不足審評模式單一,絕大部分地區(qū)均針對不同類型產品或事項建立不同的審評模式����。多數(shù)地區(qū)選擇采用集體審評、專家咨詢�、雙主審等模式來實現(xiàn)分級、分路審評����,不同的審評模式對應著不同的產品、事項類型���,既具有差異性也具有統(tǒng)一性���。以下對各省常見審評模式適用的產品���、事項類型進行梳理匯總。
集體審評(包括小組審評):主要應用于高風險產品(2個省份)���、復雜產品(3 個省份)�、創(chuàng)新產品(4 個省份)���、存在爭議問題的產品(1 個省份)�、審評內容涉及多個部門或學科的產品(1 個省份)���、中風險產品(1 個省份)����。
專家咨詢:主要是應用于高風險產品(2 個省份)����、復雜產品(4 個省份)、創(chuàng)新產品(3 個省份)�、省內首個產品(1個省份)、存在爭議問題的產品(3 個省份)、中風險產品(1個省份)�。
聯(lián)合會議審評:存在爭議問題的產品(1 個省份)。
雙主審:復雜產品/ 首次注冊(2 個省份)����、變更注冊(2個省份)����、存在爭議問題的產品(1 個省份)、省內首個(1 個省份)���。
單一主審:低風險產品/ 簡單產品(11 個省份)����。
簡易審評程序(承諾制等):延續(xù)注冊(2 個省份)�,應急產品注冊(2 個省份)。
通過數(shù)據(jù)可知���,各省對創(chuàng)新����、復雜產品或事項多采用集體審評����、專家咨詢����、雙主審的形式來規(guī)避風險����,對于存在爭議的產品通過專家咨詢或聯(lián)合會議審評進行審評,對于簡單產品或者事項通過單一主審的方式進行審評�。通過對事項和品種進行風險分級,把控審評質量�。另外,調研數(shù)據(jù)顯示����,大多地區(qū)進行專家審評的比例為10%~20%,專家組成員主要有臨床專家�、工程專家、檢驗專家����,主要來源為系統(tǒng)內的專家、檢驗機構�、醫(yī)療機構、高等院校���、臨床研究機構���、行業(yè)協(xié)會等���。
2.4 溝通交流的模式分析
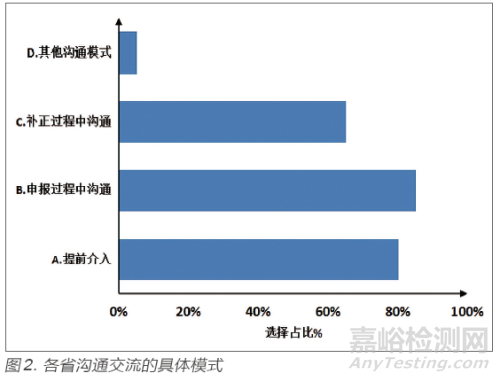
在技術審評過程中,與企業(yè)進行充分的溝通交流至關重要����。依據(jù)審評環(huán)節(jié)���,溝通交流一般覆蓋申報前���、申報過程中、補正過程中三個階段���。本次調研對具體審評溝通情況進行了統(tǒng)計匯總����。
研究顯示����,從溝通節(jié)點上來看���,各省提前介入溝通模式比例為80%,申報過程中溝通占比為85%����,補正過程咨詢占比為65%(圖2)。也有一些省份建立了其他的溝通渠道�,如對于已取得注冊證的企業(yè)進行了滿意度調查及跟蹤服務。分析調研結果可見���,大部分省份在審評過程中與企業(yè)進行了深入的溝通交流����,且溝通交流能覆蓋整個審評過程����。提前介入溝通服務比例高達80%,但大多針對創(chuàng)新����、應急類產品及政府重點扶持項目。
對于補正資料過程溝通進行進一步研究發(fā)現(xiàn)���,40%的省份已開展補正資料預審查服務����,35%的省份未開展預審查服務,25%的省份選擇了其他選項�。在其他項中,除兩個省是分別僅對重點園區(qū)項目����、創(chuàng)新產品提供預審查外,其他省都是分別采用預約咨詢�、視頻審評服務等方式來實現(xiàn)預審查服務。調研數(shù)據(jù)顯示�,預審查服務在各省的覆蓋較為廣泛。
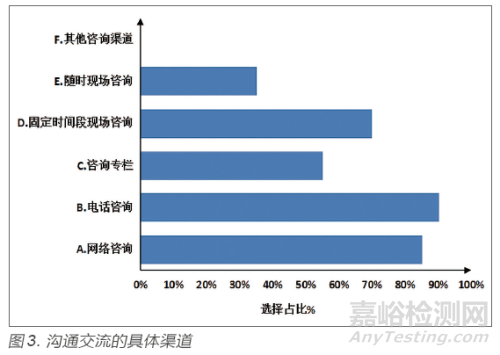
本次調研同時對20 個省份的具體溝通交流渠道和機制進行了調研�。對關于溝通交流的具體渠道和方式進行了統(tǒng)計匯總���,見圖3����。
研究結果可見���,為確保溝通交流的暢通���、及時和有效����,大部分省份溝通渠道和方式比較多樣性���,如網(wǎng)絡咨詢���、電話咨詢、網(wǎng)站咨詢專欄���、固定時間段現(xiàn)場咨詢����、隨時現(xiàn)場咨詢等�。同時,有極個別省份溝通渠道和方式比較單一�,僅有固定時間段現(xiàn)場咨詢。
對各省的溝通機制研究發(fā)現(xiàn)�,20 個省份中,有68%建立了審評提示溝通模式�,63%建立了審評共識溝通機制,74%建立了研討會溝通機制���,68%建立了培訓機制����,其他溝通機制占16%。其他溝通機制包含通過網(wǎng)站公開回復�、定期發(fā)布審評簡報、定期公開共性問題答疑����、制定省內審評要點、上門服務等方式�,其中不乏創(chuàng)新舉措,如浙江省“三服務”主動對企業(yè)����、園區(qū)上門服務;湖北省局成立全國藥監(jiān)系統(tǒng)首個“店小二”服務團�,對申請項目進行全周期服務指導。
2.5 醫(yī)療器械技術審評的創(chuàng)新舉措
多個省份建立產業(yè)轉移制度���,已注冊產品通過產業(yè)轉移政策轉移到其他省份,直接采信原審評審批意見�。部分省份簡化了部分審評工作程序,延續(xù)注冊承諾制辦理���。同時�,多省自行制定了縮減審評時限的相關要求。部分省份有意通過引入第三方審評的模式�,提高審評效率。
3.小結與建議
3.1 建立科學的審評模式���,保障產品審評質量
從以上研究可見�,各省均在不同程度上對醫(yī)療器械審評模式建立進行了探索���,通過近幾年的醫(yī)療器械審評審批制度改革���,目前大多數(shù)省醫(yī)療器械審評已經根據(jù)產品風險等級建立了不同的審評模式,科學審評的意識逐漸增強���。目前各省主要的審評模式為:對于高風險�、復雜產品���、創(chuàng)新產品����、多學科交叉產品進行集體審評(包括小組審評�、項目主審人制度)或專家審評;對存在爭議產品進行聯(lián)合會議審評;對復雜產品�、省內首家產品進行雙主審審評;對低風險產品進行單一主審及對延續(xù)注冊和應急產品進行的簡易審評程序(承諾制)等���。集體審評(包括小組審評)或專家審評等審評模式從資源配置的角度上著重將審評力量合理分配����,大大降低了創(chuàng)新產品�、復雜產品的審評風險,確保了審評質量���;與此同時���,項目主審人制度、集體審評�、雙主審等審評模式也合理解決了單一主審人自由裁量權過大的問題,有效規(guī)避了行政風險�。
各審評模式對不同省級機構執(zhí)行難度不一。一是部分省份審評員經驗不夠充分����,人員較少����,如采用項目主審人模式�,很難分派合適的項目主審人���。項目管理人在審評工作中需要身兼數(shù)職:既是一般項目的審評員���,也是疑難項目的小組長;既要確保審評合規(guī)性����,也要保障審評技術性,這就對項目管理人的能力提出了較高的要求[1]����。這種情況,對于疑難辦件�,建議借助專家審評、雙主審等模式���,提高風險控制能力����。二是對于人均辦件量過大的省�,不適宜廣泛使用人員需求量較大的審評模式,如在部分省執(zhí)行的首次注冊辦件中使用雙主審的模式。對于所有辦件均使用單一主審模式的省級機構�,應根據(jù)產品風險,設置不同的審評模式�,確保審評質量。
因各省產業(yè)情況不同�,且不同技術審評部門人員、專業(yè)及申報產品數(shù)量�、類別差異較大,審評模式也需要因地制宜����,結合當?shù)貙嶋H情況制定科學的審評制度,根據(jù)審評風險選擇合適的審評模式�。
3.2 加大人才培養(yǎng)力度,奠夯實科學審評基礎
近年來�,隨著我國醫(yī)療器械產業(yè)的快速發(fā)展,各省審評員的審評壓力逐漸凸顯�。從專業(yè)背景來看,各省審評人員的專業(yè)背景差異很大���,但基本為醫(yī)療器械相關專業(yè)���,學歷本科以上占比99%,職稱中級上占比85%����,基本均具有醫(yī)療器械相關工作經驗�,相關的專業(yè)背景����、較高的職稱水平及工作經驗����,說明各省份在審評人員隊伍建設的人員素質上基本是過硬的。從人均辦件來看�,大多數(shù)省份的人均辦件量在100件以內,但有些省份人均辦件量高達460 件�,可見部分省份審評人員處于高負荷運轉狀態(tài)。為了適應醫(yī)療器械行業(yè)發(fā)展����,省級審評機構仍需進一步加強醫(yī)療器械審評專業(yè)型隊伍建設,緩解審評壓力���,促進分積分段分路審評模式落地���,確保評審技術水平和評審質量。
3.3 探索科學的溝通交流制度���,促進技術審評提質增效
有效的溝通對技術審評提質增效至關重要����。從溝通節(jié)點上來看,有的省份在申報前����、申報中、申報后均可隨時溝通���。大多數(shù)省份僅對補正資料進行預審查服務或補正溝通���,或對創(chuàng)新、優(yōu)先產品設置了提前介入的溝通服務���。從溝通渠道上來看����,為確保溝通交流的暢通����、及時和有效,大部分省份溝通渠道和方式比較多樣性���,能很好滿足審評溝通交流的渠道需求����。從溝通方式上來看,各省的溝通方式多樣化����,20 個省份中����,超過一半的省份建立了審評提示溝通模式、審評共識溝通機制���、研討會溝通機制�、培訓機制�、補正資料預審查服務等;還有的省份建立了審評簡報���、網(wǎng)站專欄等溝通方式�。
各省溝通服務過程中���,也呈現(xiàn)出一些新的問題����,如因咨詢和企業(yè)幫扶指導工作量大,導致審評員工作效率降低����;部分企業(yè)過分依賴審評員,進而導致審評人員服務壓力過重�。“保姆式”服務容易滋生企業(yè)依耐型的怠惰思想,從而喪失積極主動完善的內在動力�,從而陷入低質量服務的惡性循環(huán)。因此�,在現(xiàn)有的政策下,建議各省結合本省實際�,充分考慮審評與溝通交流工作的平衡,完善注冊溝通交流機制���,讓審評和溝通充分發(fā)揮效能���。
另外,通過調研發(fā)現(xiàn)���,大多數(shù)省份技術審評前的提前介入溝通形式目前主要針對創(chuàng)新產品�,對于一般類復雜產品���,注冊前溝通渠道不多�。建議各省在現(xiàn)有的創(chuàng)新產品提前介入溝通交流機制上,探索和完善符合省情的常規(guī)產品提前介入溝通機制�,特別是需要進行臨床試驗的產品及無參考標準及指導原則的產品,將企業(yè)最關鍵的問題解決在申報前�,減少注冊環(huán)節(jié)的發(fā)補,縮短平均上市時間���。
3.4 鼓勵審評創(chuàng)新模式����,促進審評制度持續(xù)深入改革
本課題研究過程中�,對各省是否有意向引入第三方進行調研�。據(jù)問卷調研反饋數(shù)據(jù)顯示,有2 個省份有意向引入第三方審評���,說明各省對第三方的態(tài)度逐漸開放���。第三方審評有諸多的優(yōu)勢,美國食品藥品監(jiān)督管理局將部分中等風險的醫(yī)療器械產品的技術審評任務授權給第三方機構審評���,使得美國食品藥品監(jiān)督管理局可以集中力量來審評高風險產品[7]���。但是如何監(jiān)管第三方的合法合規(guī)審評���,如何對資料進行保密管理,如何科學把控第三方的審評尺度�,并進一步提高審評質效,還有待進一步研究���。建議合理限定第三方審評的范圍���,同時建立健全的監(jiān)管和考核制度及溝通制度,從防止與申報主體產生利益關系等方面對第三方機構進行科學管理����。
目前多個省份建立產業(yè)轉移制度,如已注冊產品因產業(yè)轉移至該省����,一定程度上采信原審評審批意見。建立各省之間技術審評�、現(xiàn)場檢查互通互認的機制,大大減少了企業(yè)跨省轉移的注冊申報壓力�,但同時也對各省的審評能力,審評尺度統(tǒng)一提出了更高的要求。
部分省份簡化了部分審評工作程序���,延續(xù)注冊承諾制辦理����。承諾辦理有利于企業(yè)迅速續(xù)證����,但也有很多風險有待商榷,如何避免一些不符合現(xiàn)行標準的產品通過“承諾”續(xù)證�,也有待建立更科學的監(jiān)管方式。