微生物檢測人員在日常檢驗中�,會面臨無菌檢查試驗時樣品量的問題�����,目前中國藥典對這方面的解釋不夠明確�,而且資料比較分散�。先看中國藥典1101無菌檢查法中的表1和表3�。
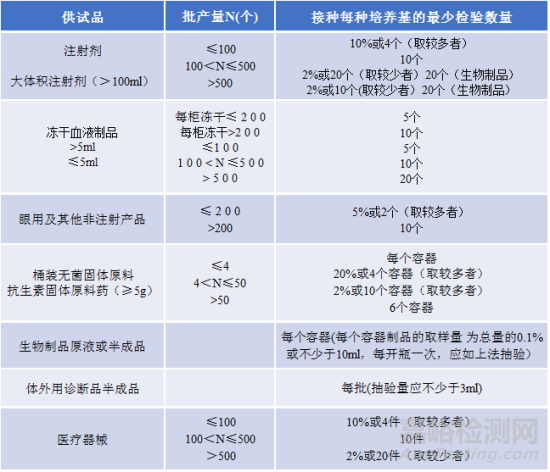
表1批出廠產(chǎn)品及生物制品的原液和半成品最少檢驗數(shù)量
注:若供試品每個容器內(nèi)的裝量不夠接種兩種培養(yǎng)基���,那么表中的最少檢驗數(shù)量應增加相應倍數(shù)�。
表3 供試品的最少檢驗量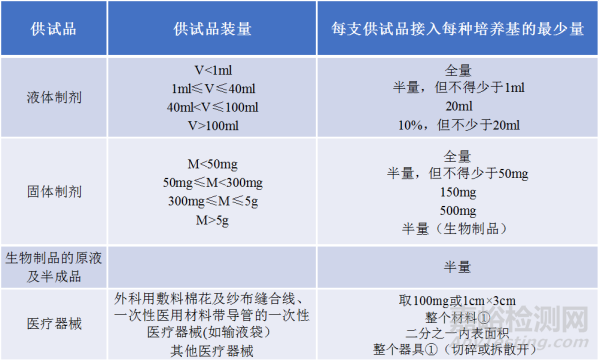
● 每種培養(yǎng)基的解釋:目前中國藥典無菌檢查用到FTM和TSB兩種培養(yǎng)基,所以最小檢驗數(shù)量就為表1中數(shù)量的2倍���。
● 陽性對照的解釋:根據(jù)最新的中國藥品檢驗標準操作規(guī)范2019版:陽性對照試驗供試品用量同供試品無菌檢查時每份培養(yǎng)基接種的樣品量。所以最少檢驗數(shù)量再增加1份表1中的數(shù)量�。
● 生物制品的特殊規(guī)定:中國藥典規(guī)定生物制品需要額外增加1份FTM的培養(yǎng)溫度20-25℃�����,所以最少檢驗數(shù)量需要再增加1份表1中的數(shù)量�����。
● 再結(jié)合表3的裝量,從而最終決定樣品的數(shù)量�����。
● 舉例說明:一種生物制品的注射劑���,裝量是2ml,批產(chǎn)量為3000支�����。根據(jù)表1和表3的規(guī)定,最少總的檢驗量為20x4/2=40支�。
● 生物制品原液和半成品:每個容器的一般最少總的檢驗量為10mlx4=40ml�。
● 方法適用性試驗的供試品用量可以是指接種到培養(yǎng)基中所需的檢驗量的總量(g/ml) �,而不一定非取滿足供試品的檢驗數(shù)量(支/瓶)�。