今日頭條
君實BTLA單抗啟動國際Ⅲ期臨床��。君實生物BTLA單抗tifcemalimab(JS004/TAB004)在國內(nèi)登記啟動一項Ⅲ期臨床�����,擬評估PD-1特瑞普利單抗聯(lián)合或不聯(lián)合Tifcemalimab作為局限期小細(xì)胞肺癌放化療后未進(jìn)展患者的鞏固治療的有效性與安全性��。這是一項國際Ⅲ期臨床��,計劃在中國����、美國、歐洲等地入組756例患者��。該試驗的中國部分將由山東第一醫(yī)科大學(xué)附屬腫瘤醫(yī)院醫(yī)學(xué)博士于金明擔(dān)任主要研究者��。
國內(nèi)藥訊
1.貝達(dá)EGFR-TKI獲批一線治療肺癌��。貝達(dá)藥業(yè)靶向T790M的第三代EGFR-TKI甲磺酸貝福替尼膠囊獲國家藥監(jiān)局批準(zhǔn)第二項適應(yīng)癥��,用于一線治療EGFR外顯子19缺失或外顯子21(L858R)置換突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者��。在Ⅱ/Ⅲ期研究(IBIO-103)中��,與對照治療相比����,貝福替尼可降低51%的疾病進(jìn)展或死亡風(fēng)險����。今年6月,該新藥已獲CDE批準(zhǔn)既往使用EGFR-TKI耐藥后產(chǎn)生T790M突變的局部晚期或轉(zhuǎn)移性NSCLC患者。
2.衛(wèi)材/渤健Aβ單抗博鰲樂城獲批����。衛(wèi)材與渤健聯(lián)合開發(fā)的Aβ單抗Lecanemab(商品名:Leqembi)獲得海南省藥監(jiān)局批準(zhǔn),落地海南博鰲樂城國際醫(yī)療旅游先行區(qū)����,臨床應(yīng)用于早期阿爾茨海默病(AD)的治療。在Ⅲ期臨床中����,與安慰劑相比,侖卡奈單抗治療在18個月時減少患者CDR-SB評分的臨床下降27%�����,淀粉樣蛋白沉積水平降低約70%����。今年2月,該新藥已被CDE納入優(yōu)先審評��。
3.信達(dá)VEGF/C3補(bǔ)體雙抗上眼科III期臨床����。信達(dá)生物重組人血管內(nèi)皮生長因子受體(VEGFR)-抗體-人補(bǔ)體受體1 (CR1) 融合蛋白efdamrofusp alfa注射液(IBI302)在治療新生血管性年齡相關(guān)性黃斑變性(nAMD)的III期臨床STAR完成首例患者給藥��。該項試驗旨在評估玻璃體腔注射8mg IBI302與2mg阿柏西普(VEGF抑制劑)相比的療效和安全性��,主要研究者由上海市第一人民醫(yī)院主任醫(yī)師孫曉東教授擔(dān)任����。
4.輝大RNA編輯療法獲兒科罕見病資格����。FDA授予輝大基因開發(fā)的全新RNA編輯療法HG204兒科罕見病資格認(rèn)定(RPDD),用于治療兒童神經(jīng)發(fā)育障礙疾病——甲基化CpG結(jié)合蛋白-2(MeCP2)重復(fù)綜合征(MDS)�����。HG204 (AAV-hfCas13Y-gMECP2) 由單個腺相關(guān)病毒(AAV)載體遞送新型高保真RNA編輯器hfCas13Y及靶向MECP2基因的gRNA�����,已在臨床前MDS小鼠模型中顯示出顯著降低MeCP2 mRNA和蛋白表達(dá)水平��,并逆轉(zhuǎn)其疾病特征��。
5.信達(dá)GPRC5D/BCMA/CD3三抗啟動Ⅰ/Ⅱ期臨床����。信達(dá)生物GPRC5D/BCMA/CD3三抗IBI3003在Clinicaltrials.gov網(wǎng)站上注冊啟動一項Ⅰ/Ⅱ期臨床試驗,擬評估用于治療晚期多發(fā)性骨髓瘤患者的安全性與有效性��。該項研究預(yù)計2026年初步完成����。研究發(fā)現(xiàn)65%的多發(fā)性骨髓瘤患者GPRC5D有超過50%的表達(dá)閾值。IBI3003采用了羅氏引進(jìn)的CrossFab雙抗技術(shù)��,重鏈之間則引入Knob-into-hole技術(shù)����,是全球首款進(jìn)入臨床的 GPRC5D/BCMA/CD3三抗。
國際藥訊
1.輝瑞組合療法獲批BRAF V600E突變NSCLC�����。FDA批準(zhǔn)輝瑞口服小分子BRAF激酶抑制劑聯(lián)合MEK激酶抑制劑binimetinib(Mektovi)用于治療BRAF V600E突變的轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者����。在II期PHAROS研究中,聯(lián)合治療用于初治患者達(dá)到客觀緩解率(ORR)為75%��;用于經(jīng)治患者的ORR為46%��。此前�����,該組合方案已獲FDA批準(zhǔn)用于治療BRAF V600E或V600K突變的不可切除或轉(zhuǎn)移性黑色素瘤。
2.禮來GLP-1R/GIPR激動劑減重Ⅲ期臨床積極�����。禮來GLP-1R/GIPR雙靶點激動劑Tirzepatide治療超重或肥胖患者的Ⅲ期臨床SURMOUNT-3完整結(jié)果將發(fā)表于《Nature Medicine》和《ObesityWeek》上�����。與安慰劑相比�����,Tirzepatide展現(xiàn)優(yōu)異的減重效果��,接受Tirzepatide治療的患者體重平均減輕21.1%�����;在84周(72+12周干預(yù)后)��,接受Tirzepatide治療的患者體重平均減輕26.6%����,而安慰劑組84周總平均減重3.8%。Tirzepatide總體安全性與SURMOUNT和SURPASS試驗相似����。
3.精神分裂癥創(chuàng)新療法Ⅱ期臨床積極。Newron公司口服新化學(xué)實體--谷氨酸調(diào)節(jié)和電壓門控鈉離子通道阻斷劑evenamide����,在用于輔助治療難治性精神分裂癥(TRS)患者的Ⅱ期臨床study 014/015最新數(shù)據(jù)積極。治療6個月后��,患者陽性和陰性綜合征量表(PANSS)����、疾病嚴(yán)重程度-臨床療效總評量表(CGI-S)以及Strauss Carpenter功能水平(LOF)較基線顯著改善(p<0.001);藥物耐受性良好����,沒有出現(xiàn)中樞神經(jīng)系統(tǒng)異常的情況。
4.HSP90抑制劑化膿性汗腺炎Ⅱ期臨床積極��。MC2 Therapeutics新型HSP90抑制劑MC2-32(RGRN-305)治療化膿性汗腺炎(HS)的Ⅱa期臨床達(dá)到主要終點����。與安慰劑相比,MC2-32治療組第16周時膿腫和炎性結(jié)節(jié)減少至少50%的患者比例更高(60%vs20%);達(dá)到包括IHS4����、HS-PGA�����、DLQI和NRS疼痛評分改善的患者比例也更高��。MC2-32的耐受性良好�����,患者血液生化指標(biāo)未出現(xiàn)明顯的臨床變化�����。
5.Alvotech公司烏司奴單抗生物類似藥上市遭拒����。Alvotech公司烏司奴單抗生物類似藥AVT04的生物制品許可申請(BLA)收到FDA完整回復(fù)函(CRL)��。FDA要求該公司解決其位于冰島的雷克雅未克(Reykjavik )工廠的缺陷后��,方可作出批準(zhǔn)決定�����。烏司奴單抗是強(qiáng)生原研的一款I(lǐng)L-12/IL-23抑制劑�����,商品名為Stelara����,已獲批的適應(yīng)癥包括潰瘍性結(jié)腸炎、克羅恩病����、斑塊狀銀屑病和銀屑病關(guān)節(jié)炎。
6.Astria聯(lián)合Ichnos開發(fā)長效OX40抑制劑����。Astria公司與Ichnos Sciences就后者一款臨床前期OX40拮抗劑STAR-0310達(dá)成全球獨家許可協(xié)議,聯(lián)合開發(fā)STAR-0310用于治療特應(yīng)性皮炎(AD)����,以及其他過敏反應(yīng)和免疫疾病。STAR-0310結(jié)合了半衰期延長技術(shù)����,旨在通過靶向OX40參與AD病理的多種T細(xì)胞,有望為患者提供長效治療潛力。根據(jù)協(xié)議�����,Ichnos Sciences將獲得1500萬美元前期付款�����,高達(dá)3.05億美元的里程碑后期付款����。
醫(yī)藥熱點
1.國家衛(wèi)健委職責(zé)調(diào)整。10月13日�����,中國政府網(wǎng)發(fā)布《中共中央辦公廳 國務(wù)院辦公廳關(guān)于調(diào)整國家衛(wèi)生健康委員會職責(zé)機(jī)構(gòu)編制的通知》����。根據(jù)《通知》,此次國家衛(wèi)健委職責(zé)��、機(jī)構(gòu)��、編制調(diào)整如下:將科技部的組織擬訂科技促進(jìn)衛(wèi)生健康發(fā)展規(guī)劃和政策職責(zé)劃入國家衛(wèi)健委��;將國家衛(wèi)健委的組織擬訂并協(xié)調(diào)落實應(yīng)對人口老齡化政策措施、承擔(dān)全國老齡工作委員會的具體工作等職責(zé)劃入民政部�����;國家衛(wèi)健委代管的中國老齡協(xié)會改由民政部代管�����;將科技部4名行政編制����、1名司局級領(lǐng)導(dǎo)職數(shù)劃入國家衛(wèi)健委�����;將國家衛(wèi)健3名行政編制劃入民政部��。調(diào)整后����,國家衛(wèi)健委內(nèi)設(shè)機(jī)構(gòu)19個,機(jī)關(guān)行政編制444名����,司局級領(lǐng)導(dǎo)職數(shù)81名。
2.北京市推出45個醫(yī)務(wù)社工多元培育服務(wù)項目。為探索醫(yī)務(wù)社工發(fā)展模式��,擴(kuò)大醫(yī)務(wù)社工覆蓋面�����,加快推動北京醫(yī)務(wù)社會工作發(fā)展��,北京市衛(wèi)健委啟動2023年北京市醫(yī)務(wù)社工多元培育服務(wù)項目工作����,按照安排,各醫(yī)療衛(wèi)生機(jī)構(gòu)結(jié)合單位特色����,認(rèn)真組織、精心策劃�����、積極申報�����。經(jīng)初篩�����、現(xiàn)場評審等環(huán)節(jié),最終確定45個醫(yī)務(wù)社工多元培育服務(wù)項目����。截至目前,全市開展醫(yī)務(wù)社會工作的醫(yī)療衛(wèi)生機(jī)構(gòu)101家�����,其中����,三級醫(yī)療機(jī)構(gòu)54家����,較2019年增長184%;全市共有醫(yī)務(wù)社會工作者306人��,其中三級醫(yī)療機(jī)構(gòu)194人�����,較2019年增長131%����。
3.9月新增報告305例猴痘確診病例����。據(jù)中國疾控中心官網(wǎng)消息��,2023年9月1日-30日����,中國內(nèi)地新增報告305例猴痘確診病例,無重癥�����、死亡病例�����。流行病學(xué)調(diào)查分析顯示�����,99%病例為男性�����,92.9%病例明確為男男性行為人群,病例中有2例女性��;性接觸以外的其他接觸方式傳播風(fēng)險低��;94.3%為主動就診發(fā)現(xiàn)��,3.9%為密切接觸者追蹤篩查發(fā)現(xiàn)��,其他為主動報告和入境篩查等發(fā)現(xiàn)����;絕大多數(shù)病例主要為發(fā)熱、皰疹�����、淋巴結(jié)腫大等癥狀��。
評審動態(tài)
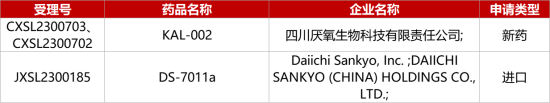
1. CDE新藥受理情況(10月16日)
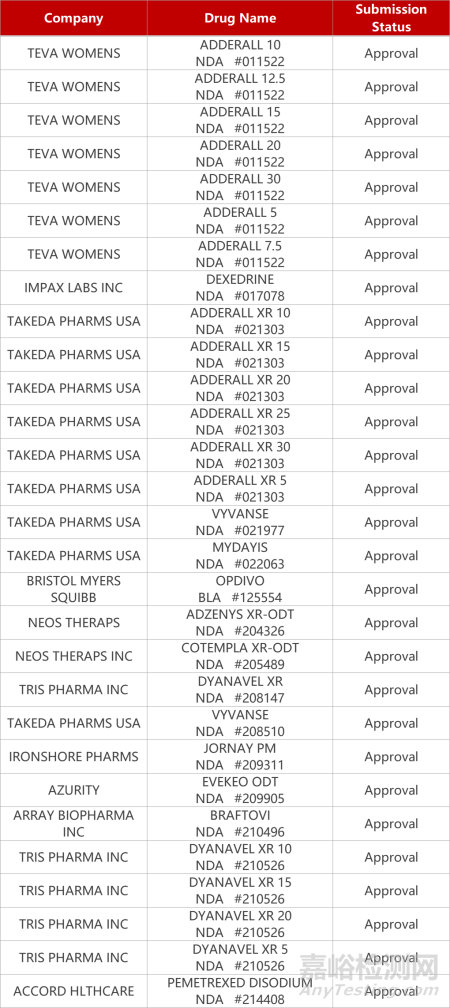
2. FDA新藥獲批情況(北美10月13日)