今日頭條
勁方CDK9抑制劑Ⅱ期臨床積極��。勁方醫(yī)藥與SELLAS生命科學(xué)集團(tuán)開發(fā)的CDK9抑制劑SLS009(GFH009)聯(lián)合維奈托克和阿扎胞苷治療復(fù)發(fā)/難治性急性髓系白血病的Ⅱa期臨床結(jié)果積極��。共有5例患者接受SLS009(45mg)聯(lián)合維奈托克和阿扎胞苷治療���,其中首例患者正在接受第5個(gè)月的治療,并獲得完全緩解(CR)��;藥物耐受性良好�����。Ⅱ期推薦劑量SLS009(60mg)組的頂線數(shù)據(jù)將于年底公布��。
國內(nèi)藥訊
1.AZ補(bǔ)體C5抑制劑中國獲批治療NMOSD���。阿斯利康補(bǔ)體C5抑制劑依庫珠單抗的新適應(yīng)癥獲國家藥監(jiān)局批準(zhǔn),用于治療視神經(jīng)脊髓炎譜系障礙(NMOSD)�����。依庫珠單抗(Soliris)是全球首款獲批的補(bǔ)體抑制劑���,通過抑制終端補(bǔ)體來抑制免疫系統(tǒng)的失控性激活。此前��,該新藥已在國內(nèi)獲批用于治療陣發(fā)性血紅蛋白尿(PNH)和非典型溶血性尿毒癥綜合征(aHUS)��,以及全身型重癥肌無力(gMG) ���。
2.軒竹CDK4/6抑制劑新適應(yīng)癥報(bào)產(chǎn)。軒竹生物CDK4/6抑制劑1類化藥吡羅西尼(birociclib)的上市申請獲NMPA受理��,單藥用于治療HR+/HER2-的局部晚期或轉(zhuǎn)移性成年乳腺癌經(jīng)治患者。在臨床研究中��,吡羅西尼治療后獨(dú)立評(píng)審委員會(huì)(IRC)評(píng)估的客觀緩解率(ORR)達(dá)到30.0%��。此前��,吡羅西尼單藥和聯(lián)合氟維司群治療晚期乳腺癌的上市申請均已被受理��。
3.海思科外周阿片受體激動(dòng)劑報(bào)產(chǎn)。海思科強(qiáng)效外周Kappa阿片受體激動(dòng)劑HSK21542注射液的新藥申請(NDA)獲CDE受理���,適應(yīng)癥為“術(shù)后鎮(zhèn)痛”�����。HSK21542能夠協(xié)同調(diào)控鉀離子流和鈣離子流���,通過阻斷疼痛和瘙癢信號(hào)傳導(dǎo)并抑制背根神經(jīng)節(jié)和末梢感覺神經(jīng)的興奮性,減少炎性因子以及神經(jīng)遞質(zhì)的釋放等�����,起到抗傷害感受和抑制瘙癢的作用��。目前���,該產(chǎn)品還被開發(fā)用于治療慢性腎臟疾病相關(guān)性瘙癢�����。
4.君實(shí)PD-1單抗兩項(xiàng)臨床數(shù)據(jù)積極��。君實(shí)生物PD-1抑制劑特瑞普利單抗將在ESMO2023大會(huì)上公布用于治療晚期腎癌(RCC)患者的關(guān)鍵Ⅲ期臨床(RENOTORCH),以及治療結(jié)外NK/T細(xì)胞淋巴瘤(ENKTL)的Ⅱ期臨床積極結(jié)果�����。在RENOTORCH試驗(yàn)中�����,與舒尼替尼相比��,特瑞普利單抗聯(lián)合阿昔替尼顯著延長患者無進(jìn)展生存期(中位PFS:18.0vs9.8個(gè)月),疾病進(jìn)展或死亡風(fēng)險(xiǎn)降低35%(1年P(guān)FS率為62.7%vs45.4%)�����;特瑞普利單抗聯(lián)合治療耐受性良好。
5.翰森引進(jìn)激活素A抑制劑獲批臨床���。Keros公司與翰森制藥聯(lián)合開發(fā)的配體捕獲體新藥HS-20106注射液(KER-050)獲國家藥監(jiān)局臨床許可���,擬開發(fā)用于治療各種原因?qū)е碌?span style="color:#ff0000;">血細(xì)胞減少���。KER-050是由經(jīng)修飾的TGF-βR(即激活素受體IIA型)配體結(jié)合區(qū)域與人源抗體Fc區(qū)域融合而成��,通過結(jié)合并抑制激活素A��,來改善骨髓和恢復(fù)正常造血功能�����。翰森制藥擁有該產(chǎn)品在中國內(nèi)地、香港和澳門獨(dú)家權(quán)益��。
國際藥訊
1.優(yōu)時(shí)比重癥肌無力新藥獲批上市��。優(yōu)時(shí)比制藥新型大環(huán)肽類C5補(bǔ)體抑制劑Zilbrysq(zilucoplan)獲FDA批準(zhǔn)上市��,用于治療抗乙酰膽堿受體(AChR)抗體陽性的全身型重癥肌無力(gMG)成年患者��。Zilucoplan具有抑制末端補(bǔ)體途徑激活和MAC下游組裝的雙重作用機(jī)制���。在Ⅲ期RAISE研究�����,zilucoplan治療組患者的安慰劑矯正的重癥肌無力-日常生活活動(dòng)能力量表(MG-ADL)總分平均改善2.09分(p<0.001)。
2.口服NHE3抑制劑獲批治療高磷血癥��。Ardelyx公司口服鈉離子轉(zhuǎn)運(yùn)蛋白NHE3抑制劑Xphozah(tenapanor)獲FDA批準(zhǔn)新適應(yīng)癥�����,用于附加治療接受透析���、磷酸鹽結(jié)合劑治療效果不佳或不耐受的慢性腎病(CKD)患者的高磷血癥�����。Xphozah旨在通過減少鈉離子量的攝取�����,提高胃腸道細(xì)胞中質(zhì)子的濃度�����,以達(dá)到降低磷酸鹽的吸收�����,從而降低血液中磷酸鹽的濃度���。今年7月,該新藥上述適應(yīng)癥已在中國報(bào)產(chǎn)���,復(fù)星醫(yī)藥擁有該產(chǎn)品的中國權(quán)益���。
3.諾和諾德啟動(dòng)司美格魯肽降糖III期臨床。諾和諾德口服GLP-1激動(dòng)劑司美格魯肽在clinicaltrials.gov網(wǎng)站登記一項(xiàng)III期研究�����,擬評(píng)估與恩格列凈或二甲雙胍片相比��,一線治療2型糖尿病患者的療效和安全性���。該項(xiàng)研究將持續(xù)2年零7周(111周)�����,主要終點(diǎn)為第52周糖化血紅蛋白(HbA1c)水平的變化值��,次要終點(diǎn)還將評(píng)估患者的體重變化情況��。
4.羅氏超20億美元合作開發(fā)分子膠。羅氏與Monte Rosa公司將利用后者專有分子膠降解劑平臺(tái)QuEEN���,針對(duì)選定的癌癥和神經(jīng)疾病靶點(diǎn)�����,合作開發(fā)創(chuàng)新分子膠降解劑(MGD)�����。根據(jù)協(xié)議,Monte Rosa公司將獲得5000萬美元的前期付款���,可能超過20億美元的臨床前���、臨床期、商業(yè)和銷售里程碑后期付款��。羅氏享有進(jìn)一步推進(jìn)化合物的臨床前和臨床開發(fā)工作的選擇權(quán)�����。Monte Rosa保留其管線項(xiàng)目的全部權(quán)益��。
5.賽默飛31億美元收購蛋白組學(xué)公司���。Thermo Fisher宣布將啟動(dòng)要約收購程序,收購蛋白組學(xué)公司Olink所有普通股和美國存托股票���,交易估值約為31億美元���,其中包括約1.43億美元的凈現(xiàn)金。Olink的專利技術(shù)Proximity Extension Assay (PEA) 能使用極少量的血清���、血漿或幾乎任何其他類型的生物樣本�����,在不降低特異性和靈敏度的情況下對(duì)蛋白質(zhì)進(jìn)行高通量�����、多重免疫檢測��。該交易預(yù)計(jì)將于2024年年中完成�����。
6.吉利德引進(jìn)Assembly Bio三款抗病毒藥物���。吉利德與Assembly Biosciences達(dá)成合作協(xié)議��,引進(jìn)后者開發(fā)的3款抗病毒藥物���,分別是乙肝藥物ABI-4334�����,抗皰疹病毒藥物ABI-5336和丁肝藥物ABI-5366���。根據(jù)協(xié)議,Assembly公司將獲得8480萬美元預(yù)付款�����、1520萬美元股權(quán)投資���、每個(gè)項(xiàng)目4500萬美元的選擇權(quán)執(zhí)行費(fèi)和每個(gè)項(xiàng)目3.3億美元的監(jiān)管和商業(yè)里程碑款項(xiàng),以及每個(gè)項(xiàng)目7500萬美元額外付款��,交易總金額14.5億美元���。
7.MASP-2抗體IgA腎?����、笃谂R床失敗�����。Omeros Corporation公司MASP-2抗體Marsoplimab治療IgA腎病的Ⅲ期臨床ARTEMIS-IGAN未達(dá)到主要研究終點(diǎn)。與安慰劑相比�����,narsoplimab治療組患者24小時(shí)尿蛋白排泄(UPE)評(píng)估蛋白尿減少的統(tǒng)計(jì)不具顯著性;narsoplimab耐受性普遍良好�����,沒有出現(xiàn)任何令人擔(dān)憂的安全性信號(hào)��。Omeros表示將終止ARTEMIS-IGAN臨床研究���,并放棄在美國尋求該產(chǎn)品用于IgA腎病的上市申請。
醫(yī)藥熱點(diǎn)
1.廣州白云北部新增一家三級(jí)綜合醫(yī)院���。10月10日���,《白云區(qū)公共衛(wèi)生醫(yī)院地塊(AB0109規(guī)劃管理單元)控制性詳細(xì)規(guī)劃》經(jīng)第四屆廣州市規(guī)劃委員會(huì)地區(qū)規(guī)劃專業(yè)委員會(huì)第十三次會(huì)議審議通過��。根據(jù)規(guī)劃��,白云區(qū)將按“平急兩用”原則���,在北部江高鎮(zhèn)規(guī)劃建設(shè)一間三級(jí)綜合醫(yī)院�����,即白云區(qū)公共衛(wèi)生醫(yī)院��。醫(yī)院規(guī)劃床位1800床���,近期建設(shè)600床���, 平時(shí)用作綜合醫(yī)院�����,遇重大公共突發(fā)事件時(shí)可立即轉(zhuǎn)換為應(yīng)急場所���。
2.河南省兒童醫(yī)院增設(shè)兒科晚間門診。10月15日起���,河南省兒童醫(yī)院鄭東院區(qū)臨時(shí)增設(shè)11個(gè)兒科專家晚間門診���,主要服務(wù)于以呼吸道疾病為主的內(nèi)科患兒���。11個(gè)兒科專家晚間門診主要設(shè)置在普通內(nèi)科��,坐診時(shí)間為17:30-20:30��,在晚間門診開放的同時(shí)���,醫(yī)學(xué)影像科���、檢驗(yàn)科、超聲科���、心電圖���、藥劑科等醫(yī)技科室也同步運(yùn)行。
3.勃林格殷格翰大中華區(qū)換帥��。10月17日��,“勃林格殷格翰中國”官微宣布:Mohammed Tawil將于2024年1月1日接替董博文 (Dr.Pavol Dobrocky) ���,擔(dān)任勃林格殷格翰大中華區(qū)(中國大陸���、香港及臺(tái)灣地區(qū))總裁兼首席執(zhí)行官。Mohammed Tawil于1995年加入勃林格殷格翰��,成為約旦分公司的醫(yī)藥代表�����。2020年起至今��,擔(dān)任勃林格殷格翰IMETA大區(qū)(印度���、中東、土耳其及非洲)總裁���、首席執(zhí)行官及人用藥品事業(yè)部負(fù)責(zé)人���。
評(píng)審動(dòng)態(tài)
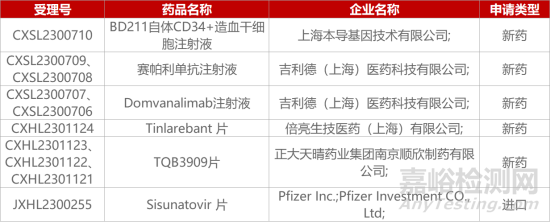
1. CDE新藥受理情況(10月187日)
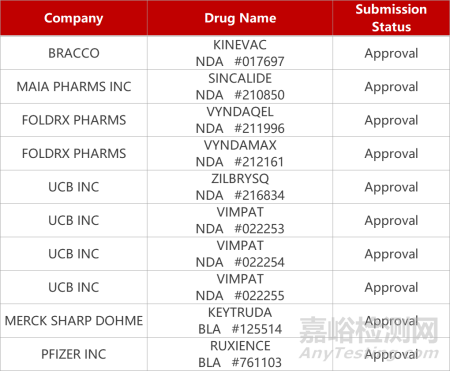
2. FDA新藥獲批情況(北美10月17日)