一��、項(xiàng)目背景
隨著互聯(lián)網(wǎng)與人工智能的快速發(fā)展��,醫(yī)療行業(yè)涌現(xiàn)了越來越多的醫(yī)用軟件(Software as Medical Device����,SaMD)。各國監(jiān)管機(jī)構(gòu)在積極地調(diào)整法規(guī)和監(jiān)管方向��,力求鼓勵(lì)創(chuàng)新的同時(shí)保證患者安全��。
2017年8月1日����,F(xiàn)DA發(fā)布了數(shù)字健康創(chuàng)新行動計(jì)劃(Digital Health Innovation Action Plan,DHIAP),并開始試行數(shù)字健康與認(rèn)證試點(diǎn)項(xiàng)目(Precertification, Pre-Cert)�。先后發(fā)布了《軟件預(yù)認(rèn)證計(jì)劃:2019年測試計(jì)劃》(Software Precertification Program: 2019 Test Plan)、《開展軟件預(yù)認(rèn)證試點(diǎn)計(jì)劃的監(jiān)管框架》(Software Precertification Program: Regulatory Framework for Conducting the Pilot Program within Current Authorities)��、《開發(fā)軟件預(yù)認(rèn)證計(jì)劃的工作模式》(Developing a Software Precertification Program: A Working Model)等文件�。
多達(dá)上百家公司申請參與試點(diǎn)項(xiàng)目��,經(jīng)篩選最終入圍的企業(yè)有9家�,分別是:蘋果、Fitbit�、三星電子��、谷歌旗下的生命科技公司Verily��、強(qiáng)生����、羅氏公司�,以及三家相對規(guī)模較小的數(shù)字醫(yī)療公司:Pear Therapeutics、Phosphorus和Tidepool�。
二、項(xiàng)目概述
軟件預(yù)認(rèn)證計(jì)劃旨在建立一種自愿的監(jiān)管途徑����,該途徑表現(xiàn)為用一種比當(dāng)前監(jiān)管模式更為定制化的監(jiān)管模型來評估軟件技術(shù)的安全性和有效性,為醫(yī)用軟件提供更多簡化和高效的監(jiān)管模式����。
該計(jì)劃的目標(biāo)是通過評估組織的卓越性,建立對其產(chǎn)品的信任��,進(jìn)而簡化上市前審查程序��,并利用上市后數(shù)據(jù)來驗(yàn)證SaMD在真實(shí)世界中的持續(xù)安全性�、有效性和性能,從而實(shí)現(xiàn)定制化的、務(wù)實(shí)的����、負(fù)擔(dān)最小的、精簡有效的監(jiān)管監(jiān)督�。
預(yù)認(rèn)證更多針對的是組織而不是單獨(dú)的產(chǎn)品。預(yù)認(rèn)證過程將考察組織是否能生產(chǎn)高質(zhì)量��、安全和有效的SaMD����,以此確定該組織是否能獲得預(yù)認(rèn)證。獲得預(yù)認(rèn)證的組織����,其軟件產(chǎn)品可以簡化或免于某些上市前提交要求,減少單個(gè)產(chǎn)品審查負(fù)擔(dān)����,更快推向市場。
三��、預(yù)認(rèn)證項(xiàng)目
預(yù)認(rèn)證項(xiàng)目主要包括四部分內(nèi)容��,即卓越性評價(jià)����,審評路徑判定,簡化審評和真實(shí)世界性能評估�。四部分相互依賴,體現(xiàn)了產(chǎn)品全生命周期的方法�,該方法能覆蓋軟件產(chǎn)品從上市前開發(fā)到上市后性能的全過程評估和監(jiān)控。
(一)卓越性評價(jià)
該工作旨在確定用于評價(jià)預(yù)認(rèn)證組織卓越性的客觀標(biāo)準(zhǔn)和方法����,并決定是否可以維持其預(yù)認(rèn)證狀態(tài)。
卓越性評價(jià)包括4個(gè)過程:1.建立預(yù)認(rèn)證計(jì)劃參考系��。確定可以用來考察組織卓越性的具體領(lǐng)域和影響SaMD全生命周期安全和有效的要素����。2.組織定義和提供其過程和活動,以及保證過程和活動質(zhì)量的關(guān)鍵衡量和指標(biāo)(KPI)��。3.評價(jià)組織提出的過程和活動能否通過1中的要素展現(xiàn)出其卓越性�、KPI是否合適和充分。4.針對每條卓越原則匯總評價(jià)結(jié)果����,決定組織最終的預(yù)認(rèn)證水平;評價(jià)要素體現(xiàn)卓越原則的方法是否有效等�。
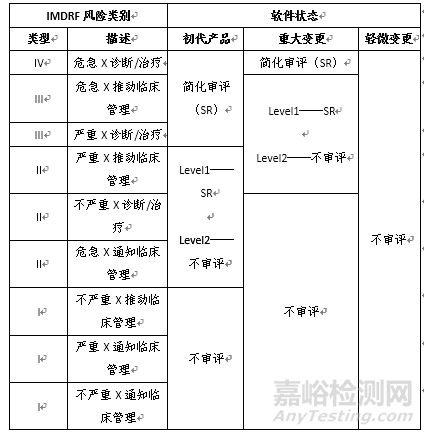
根據(jù)組織的能力�,認(rèn)定結(jié)果分為兩個(gè)級別:1.Level 1預(yù)認(rèn)證����,允許組織開發(fā)和銷售較低風(fēng)險(xiǎn)的軟件而無需審查,同時(shí)要求對其他類型的軟件進(jìn)行精簡審查�,適用于在軟件產(chǎn)品方面沒有經(jīng)驗(yàn)或經(jīng)驗(yàn)有限的組織。2.Level 2預(yù)認(rèn)證�,允許組織開發(fā)和銷售較低風(fēng)險(xiǎn)的軟件和中等風(fēng)險(xiǎn)的軟件而無需審查,同時(shí)要求對其他類型的軟件進(jìn)行精簡審查����,適用于在軟件方面有豐富經(jīng)驗(yàn)的組織。
(二)審評路徑判定
該工作旨在制定基于風(fēng)險(xiǎn)的審評路徑判定框架�,以便經(jīng)過預(yù)認(rèn)證的公司可以確定其產(chǎn)品的上市前審核途徑。
對預(yù)認(rèn)證組織的SaMD產(chǎn)品的上市前審查將依據(jù)該組織的預(yù)認(rèn)證狀態(tài)����、預(yù)認(rèn)證級別和SaMD的風(fēng)險(xiǎn)類別來確定。軟件生產(chǎn)商需要根據(jù)國際醫(yī)療器械監(jiān)管機(jī)構(gòu)論壇(IMDRF)發(fā)布的指南來判斷產(chǎn)品所屬類別并提交SaMD定義聲明�。內(nèi)容包括:1.SaMD提供的信息對醫(yī)療保健決策的重要性;2.醫(yī)療保健狀況或狀態(tài)����;3.軟件的核心功能描述等。
各級別預(yù)認(rèn)證組織生產(chǎn)SaMD的審評路徑如下表所示:
(三)簡化審評
該工作旨在確定上市前評審所必需的要素��,并制定上市前評審流程以為預(yù)認(rèn)證組織提供軟件產(chǎn)品安全性和有效性的合理保證。
為了確保安全和有效的三大類要素如下表:
簡化審評采取一般性的交互評審方式加快評審速度����。在上市前審查中����,將對軟件分析性能、臨床性能�、合適的安全方法進(jìn)行交互式審評。交互式審評能夠盡早介入�,利于暴露潛在問題并及時(shí)交流解決。同時(shí)��,審評流程盡可能自動化�,減少審查時(shí)間。
(四)真實(shí)世界性能評估
該工作旨在確定經(jīng)過預(yù)認(rèn)證的公司會收集和分析訪問上市后數(shù)據(jù)����,并使用這些現(xiàn)成的數(shù)據(jù)分析來驗(yàn)證預(yù)認(rèn)證后的持續(xù)卓越表現(xiàn),識別新出現(xiàn)的安全和網(wǎng)絡(luò)安全風(fēng)險(xiǎn)����,向項(xiàng)目的其他組件提供關(guān)鍵反饋,支持產(chǎn)品的監(jiān)管狀態(tài)以及新的和不斷發(fā)展的產(chǎn)品功能��,并支持適當(dāng)使用上市后數(shù)據(jù)生成臨床證據(jù)。
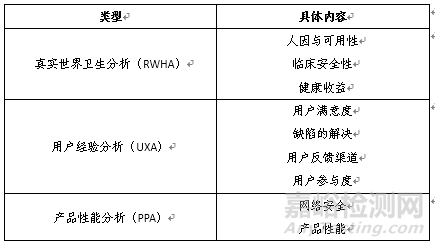
真實(shí)世界性能分析(RWPA)是指與預(yù)認(rèn)證組織銷售的SaMD產(chǎn)品在實(shí)際環(huán)境中的安全性����、有效性和性能相關(guān)的數(shù)據(jù)的系統(tǒng)計(jì)算分析。其可以有效地生成����、收集和分析來自適當(dāng)儀器化SaMD產(chǎn)品的數(shù)據(jù),以及來自設(shè)備注冊�、結(jié)構(gòu)良好的數(shù)據(jù)共享和其他電子健康信息來源,包括患者注冊和目前正在開發(fā)的國家衛(wèi)生技術(shù)評估系統(tǒng)(NEST)的真實(shí)數(shù)據(jù)����。
真實(shí)世界性能分析包括真實(shí)世界衛(wèi)生分析(RWHA)、用戶經(jīng)驗(yàn)分析(UXA)��、產(chǎn)品性能分析(PPA)��。
組織需要建立數(shù)據(jù)的收集計(jì)劃并保持持續(xù)的監(jiān)測����。真實(shí)世界性能收集計(jì)劃側(cè)重趨勢和總結(jié)分析而非原始數(shù)據(jù)。鼓勵(lì)組織制定真實(shí)世界性能分析計(jì)劃��,明確需要收集的真實(shí)世界性能數(shù)據(jù)元素����、數(shù)據(jù)收集頻率�,并為每個(gè)數(shù)據(jù)元素設(shè)定目標(biāo)�。交互式審查和同意后,組織執(zhí)行計(jì)劃并分享結(jié)果給FDA�,F(xiàn)DA會在合適的驗(yàn)證分析類型方面提供進(jìn)一步指導(dǎo)。
四����、總結(jié)與分析
FDA在預(yù)認(rèn)證項(xiàng)目中針對醫(yī)用軟件提出了新的監(jiān)管框架:從認(rèn)證組織到審評產(chǎn)品����,利用現(xiàn)有申報(bào)通道讓部分中低風(fēng)險(xiǎn)醫(yī)用軟件產(chǎn)品獲得更精簡的上市許可路徑,以支持和鼓勵(lì)醫(yī)用軟件產(chǎn)品創(chuàng)新�。
從投入和收益來看,預(yù)認(rèn)證對于生產(chǎn)多品類醫(yī)用軟件產(chǎn)品的組織來說能夠簡化對組織要素的重復(fù)考察��,加快迭代產(chǎn)品的上市��,收益更加明顯�。
此外,在省局開展的優(yōu)化第二類醫(yī)療器械注冊有關(guān)事項(xiàng)中��,信用A類且近一年內(nèi)未有嚴(yán)重違法違規(guī)行為的企業(yè)可免于注冊質(zhì)量管理體系核查�,或可在其申報(bào)的二類醫(yī)用軟件產(chǎn)品中探索簡化審評等模式����。