以下來自歐盟醫(yī)療器械協(xié)調(diào)小組(MDCG)2023年9月份發(fā)布的關(guān)于MDR附錄XVI所涵蓋的非預(yù)期醫(yī)療用途產(chǎn)品的過渡條款的問答�。
【MDR關(guān)于非預(yù)期醫(yī)療用途產(chǎn)品的監(jiān)管背景】
MDR法規(guī)自2021年5月26日起完全適用���,其中也涵蓋了沒有醫(yī)療用途的產(chǎn)品(見附錄XVI)。
MDR Annex XVI中非預(yù)期醫(yī)療用途產(chǎn)品目前包含以下六個產(chǎn)品組:
1) 隱形眼鏡或其他引入眼睛或進入眼睛的產(chǎn)品�,包括非處方彩色隱形眼鏡。
2) 通過外科侵入手段全部或部分引入人體的產(chǎn)品����,其目的是改變?nèi)梭w部位的解剖結(jié)構(gòu)或固定,紋身產(chǎn)品和穿孔產(chǎn)品除外����。
3) 用于面部或其他皮下、粘膜下或皮內(nèi)注射或其他方式引入的物質(zhì)���,不包括用于紋身的物質(zhì)����,如真皮填充物。
4) 用于減少�、移除或破壞脂肪組織的設(shè)備,如吸脂���、脂解設(shè)備���。
5) 用于人體的高強度電磁輻射(如紅外線、可見光�、紫外線)發(fā)射設(shè)備,例如�,用于紋身或脫毛的激光和強脈沖光(IPL)設(shè)備。
6) 用于大腦刺激的設(shè)備�,此類設(shè)備應(yīng)用電流或磁場或電磁場穿透顱骨以改變大腦中的神經(jīng)元活動。
歐盟委員會實施條例(EU)2022/2346(CS)規(guī)定了將風(fēng)險管理應(yīng)用于以上非醫(yī)療用途設(shè)備的通用規(guī)范���,該條例自2023.06.22生效���。
MDR中規(guī)定的過渡條款已由(EU)2022/2346相應(yīng)延長,這個條例還規(guī)定了從這些延長的過渡期中受益的前提條件MDR中經(jīng)修訂的相關(guān)過渡條款自2023.03.20日起適用����。大家注意使用最新版的MDR法規(guī)。
隨后歐盟發(fā)布實施條例(EU)2023/1194����,以使CS中列出的過渡條款與修訂后的MDR中列出的條款保持一致。
1����、 CS何時適用于非醫(yī)療用途產(chǎn)品?
從2023年6月22日起���,CS適用于附錄XVI 非醫(yī)療用途產(chǎn)品���。
其中公告機構(gòu)根據(jù)MDD發(fā)布的證書所涵蓋的產(chǎn)品,其中某些規(guī)定從2022年12月22日起適用���。
2���、MDR何時開始適用于非醫(yī)療用途產(chǎn)品?
從2023年6月22日起�,也就是CS的實施日期,MDR適用于附錄XVI非醫(yī)療用途產(chǎn)品����。
3、非醫(yī)療用途產(chǎn)品的過渡規(guī)定包括哪些����?
MDR規(guī)定了6個月期限(2022-12-22~2023-06-22)���,來實施CS中規(guī)定的新的相關(guān)要求。
CS也制定了特定過渡條款�,以緩解6個月過渡后仍不足以完全實施CS的新要求以及完成MDR下的適用程序的情況。這些情況包括:
1)公告機構(gòu)需要參與符合性評估程序時�,且制造商需要進行臨床調(diào)查時;
2)根據(jù)MDR第120(2)條不再有效的非醫(yī)療用途產(chǎn)品的MDD證書����。
對于根據(jù)MDR第120條第(2)款獲得有效MDD證書的非醫(yī)療用途產(chǎn)品,MDR第120條第3����、3a、3b���、3c�、3d和3e款中規(guī)定的過渡條款適用���。
4����、對于公告機構(gòu)參與符合性評估且制造商決定進行臨床調(diào)查的產(chǎn)品,CS中規(guī)定的過渡期是什么�?需要滿足哪些條件���?
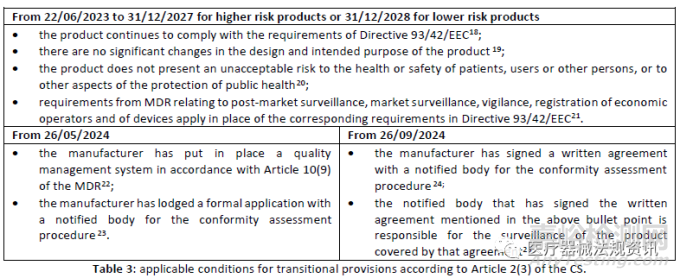
這個過渡期約為6.5年�,從2023年6月22日到2029年12月31日����。
過渡期內(nèi)需要滿足各種條件。有些是在整個期間����,而另一些則是在特定日期內(nèi)。下表顯示了在過渡期內(nèi)產(chǎn)品繼續(xù)投放市場或投入使用需滿足的條件����。
5、對于公告機構(gòu)參與符合性評估且制造商不打算進行臨床調(diào)查的產(chǎn)品�,CS中規(guī)定的過渡期是什么?需要滿足哪些條件���?
過渡期約為5.5年����。它從2023年6月22日開始,到2028年12月31日結(jié)束����。
在過渡時期,需要滿足各種條件���。有些是在整個期間���,而另一些則是在特定日期內(nèi)。下表顯示了在過渡期內(nèi)繼續(xù)將產(chǎn)品投放市場或投入使用所需滿足的條件���。
6���、MDD證書所涵蓋的非醫(yī)療用途產(chǎn)品的MDR中規(guī)定的過渡期是什么?需要滿足哪些條件���?
高風(fēng)險產(chǎn)品����,即所有非WET類型的III類器械和IIb類植入類器械的期限于2027年12月31日結(jié)束����,低風(fēng)險產(chǎn)品(排除在高風(fēng)險組之外的所有其他類別和器械)的期限至2028年12月30日結(jié)束�。
注:WET器械����,目前包括縫合線、吻合釘����、補牙���、牙套����、牙冠�、螺釘、楔塊�、板、線�、針、夾子和連接器�。
并非有MDD證書的所有產(chǎn)品都能受益于MDR過渡條款,需要符合以下條件才能受益于過渡條款:
a) 如果MDD證書從2017年5月25日起頒發(fā)����,在2021年5月26日仍然有效����,之后沒有被撤銷���,并且在2023年3月20日之前失效���,則只有滿足第120(2)條第2段落a)或b)點中規(guī)定的條件之一,這類MDD證書上的產(chǎn)品才能受益于MDR過渡條款����;
b) 如果MDD證書從2017年5月25日起頒發(fā),在2021年5月26日仍然有效����,之后沒有被撤銷,并且在2023年3月20日之前沒有失效���,則此類證書涵蓋的產(chǎn)品可以從MDR過渡條款中受益���。
MDR第120條第(3c)、(3d)和(3e)款規(guī)定了受益于并持續(xù)受益于過渡條款必須滿足的附加條件和要求���。關(guān)于這些具體條件的詳細信息���,請查閱關(guān)于實施條例(EU) 2023/607的問答文件����。
7���、MDD證書所涵蓋的非醫(yī)療用途產(chǎn)品的CS中規(guī)定的過渡期是什么���?需要滿足哪些條件?
高風(fēng)險非WET產(chǎn)品的過渡期約為4.5年����,低風(fēng)險產(chǎn)品的過渡期約為5.5年���。從2023年6月22日開始���,到2027年12月31日或2028年12月30日結(jié)束。
并非有MDD證書的所有產(chǎn)品都能從CS制定的過渡條款中受益���。事實上���,只有當(dāng)MDD證書從2017年5月25日起頒發(fā)����,在2021年5月26日仍然有效�,之后沒有撤銷,在2023年3月20日之前到期����,并且不滿足第120條第2款第a)或b)點中描述的條件時,這些規(guī)定才適用����。
在過渡期間,需要滿足額外的條件和要求���。下表列出了在過渡期內(nèi)繼續(xù)投放市場或投入使用產(chǎn)品所需滿足的條件����。
為了確定條件和要求���,CS參考了MDR第120條第(3c)����、(3d)和(3e)款。經(jīng)法規(guī)(EU)2023/607修訂的MDR過渡條款問答文件提供了其他有用信息�。
8、在2023年6月22日之前����,MDD證書所涵蓋的非醫(yī)療用途產(chǎn)品的CS中規(guī)定的過渡期適用?需要滿足哪些條件����?
MDD證書所涵蓋的非醫(yī)療用途產(chǎn)品的過渡期在CS中規(guī)定,之后由實施條例(EU)2023/1194對其進行了修訂�。這些過渡條款在2022年12月22日至2023年6月21日期間仍然適用。
在修訂前����,CS制定須符合的條件,以便受益及繼續(xù)受益于過渡條文�。這些條件包括產(chǎn)品需要繼續(xù)符合MDD的要求����,但在2021年5月26日后到期、仍有效MDD證書所涵蓋的要求除外���;需要避免產(chǎn)品的設(shè)計和預(yù)期用途發(fā)生重大變化�;制造商需要與公告機構(gòu)簽署書面協(xié)議,以便進行適當(dāng)?shù)谋O(jiān)督���。經(jīng)實施條例(EU)2023/1194修訂的CS中保留了這些條件���。
9、雙重用途(dual-purpose)器械的過渡性規(guī)定是什么���?
對于具有醫(yī)療和非醫(yī)療預(yù)期用途的雙重用途器械�,必須同時滿足MDR和CS的適用要求����。關(guān)于過渡條款,醫(yī)療用途需滿足MDR第120條����,非醫(yī)療用途需滿足CS。器械同時滿足MDR和CS的適用要求時���,如果有些要求不同���,應(yīng)考慮并滿足更嚴格的要求。
10����、制造商如何證明他們的產(chǎn)品從過渡期中受益����?
制造商應(yīng)能夠提供一份自我聲明�,確認符合從過渡條款中受益的條件,并說明過渡期的結(jié)束日期���。
一旦新條件適用并得到滿足�,應(yīng)立即更新自我聲明���。
自我聲明應(yīng)明確說明所涵蓋的產(chǎn)品���,并可基于統(tǒng)一的模板。
一旦與公告機構(gòu)簽署符合性評估書面協(xié)議的條件適用�,則可以通過公告機構(gòu)發(fā)布的“確認函”提供額外證據(jù),說明收到制造商的符合性評估申請并達成書面協(xié)議����。
11����、在過渡期內(nèi)�,是否有必要向市場提供產(chǎn)品的最后期限����?
不,沒有必要提供���。在過渡期內(nèi)投放市場的產(chǎn)品也可以在過渡期結(jié)束后進一步流通�。
12���、在過渡期內(nèi)����,公告機構(gòu)是否可以為MDR下的非醫(yī)療用途產(chǎn)品頒發(fā)證書���?
是的����,他們可以在過渡期內(nèi)頒發(fā)非醫(yī)療用途產(chǎn)品MDR證書����。公告機構(gòu)可在2023年6月22日起的過渡期內(nèi)為MDR下的附錄XVI非醫(yī)療用途產(chǎn)品頒發(fā)證書。在此之前,MDR不適用于非醫(yī)療用途產(chǎn)品���,因此公告機構(gòu)無法為其頒發(fā)任何證書����。