前言
為了保障醫(yī)療器械的安全��、有效��,鼓勵(lì)醫(yī)療器械的研究與創(chuàng)新,促進(jìn)醫(yī)療器械新技術(shù)的推廣和應(yīng)用�,推動(dòng)醫(yī)療器械產(chǎn)業(yè)發(fā),國(guó)家藥監(jiān)局2018年修訂發(fā)布《創(chuàng)新醫(yī)療器械特別審查程序》��;自2021年6月1日起施行的《醫(yī)療器械監(jiān)督管理?xiàng)l例》也提出將醫(yī)療器械創(chuàng)新納入發(fā)展重點(diǎn)����,對(duì)創(chuàng)新醫(yī)療器械予以?xún)?yōu)先審評(píng)審批�。
那么,醫(yī)療器械創(chuàng)新審批要如何申請(qǐng)呢����?下面����,小編將結(jié)合國(guó)家藥監(jiān)局發(fā)布的相關(guān)要求從申報(bào)條件����、申報(bào)流程、常見(jiàn)問(wèn)題及專(zhuān)家會(huì)要求四個(gè)方面進(jìn)行分享����。
1.申報(bào)條件
1)知識(shí)產(chǎn)權(quán)
①在中國(guó)依法擁有產(chǎn)品核心技術(shù)發(fā)明專(zhuān)利權(quán)��,或者依法通過(guò)受讓取得在中國(guó)發(fā)明專(zhuān)利權(quán)或其使用權(quán)(授權(quán)距申報(bào)不超過(guò)5年)�;
②或者核心技術(shù)發(fā)明專(zhuān)利的申請(qǐng)已由國(guó)務(wù)院專(zhuān)利行政部門(mén)公開(kāi)(出具檢索報(bào)告)����。
2)基本定型
具有基本定型產(chǎn)品����,研究過(guò)程真實(shí)和受控,研究數(shù)據(jù)完整和可溯源����。
3)首創(chuàng)及顯著價(jià)值
產(chǎn)品主要工作原理或者作用機(jī)理為國(guó)內(nèi)首創(chuàng)��,產(chǎn)品性能或者安全性與同類(lèi)產(chǎn)品比較有根本性改進(jìn)����,技術(shù)上處于國(guó)際領(lǐng)先水平,且具有顯著的臨床應(yīng)用價(jià)值����。
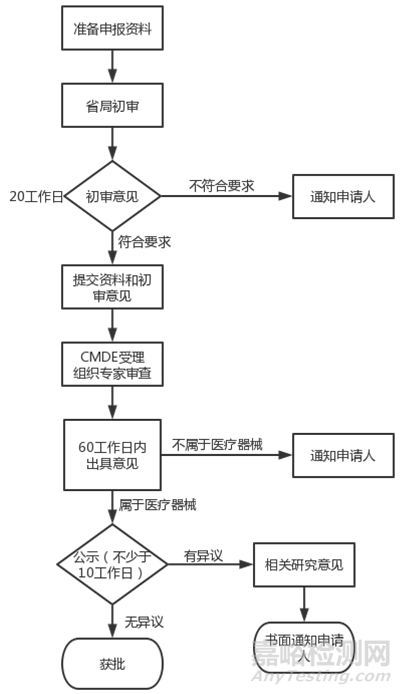
2.申報(bào)流程
3.注意事項(xiàng)
1)必須在醫(yī)療器械產(chǎn)品注冊(cè)申報(bào)前提交��;
2)第一類(lèi)醫(yī)療器械不能申報(bào)創(chuàng)新特別審批��;
3)僅適用于首次注冊(cè)的醫(yī)療器械�,不適用于延續(xù)注冊(cè)及變更注冊(cè);
4)創(chuàng)新醫(yī)療器械特別審批不收取申請(qǐng)費(fèi)用。若產(chǎn)品已經(jīng)取得創(chuàng)新批件進(jìn)入注冊(cè)階段�,費(fèi)用將按照公示期間公開(kāi)的費(fèi)用收取。
4.常見(jiàn)問(wèn)題
1)申請(qǐng)表中需由法人簽字��,其備注一欄應(yīng)填寫(xiě)回避信息;
2)應(yīng)提交公布版本的權(quán)利要求書(shū)和說(shuō)明書(shū)�;
3)產(chǎn)品技術(shù)文件中適用范圍����、預(yù)期用途應(yīng)與127號(hào)文里面的部分內(nèi)容要求相似����;
4)應(yīng)體現(xiàn)包括知識(shí)產(chǎn)權(quán)��、創(chuàng)新點(diǎn)及臨床應(yīng)用價(jià)值三位一體的創(chuàng)新性����。
5.專(zhuān)家會(huì)要求
1)創(chuàng)新審查申請(qǐng)受理后,即可準(zhǔn)備匯報(bào)資料;
2)申請(qǐng)人應(yīng)以PPT的形式進(jìn)行匯報(bào)�,全面介紹產(chǎn)品,并錄制匯報(bào)視頻�;
3)匯報(bào)內(nèi)容不可超出申報(bào)資料范圍;
4)申請(qǐng)人可準(zhǔn)備申報(bào)產(chǎn)品相關(guān)的手術(shù)視頻或演示動(dòng)畫(huà)�,采用多種方式展示產(chǎn)品優(yōu)勢(shì)�;
5)境外申請(qǐng)人匯報(bào)過(guò)程亦應(yīng)采用中文�。
6.相關(guān)法規(guī)
關(guān)于發(fā)布醫(yī)療器械技術(shù)審評(píng)中心創(chuàng)新醫(yī)療器械特別審查申請(qǐng)審查操作規(guī)范的通告(2018年第11號(hào))
關(guān)于發(fā)布創(chuàng)新醫(yī)療器械特別審查程序的公告(2018年第83號(hào))
關(guān)于發(fā)布創(chuàng)新醫(yī)療器械特別審查申報(bào)資料編寫(xiě)指南的通告(2018年第127號(hào))