摘 要 Abstract
連續(xù)制造在口服固體制劑領(lǐng)域的應(yīng)用是制藥先進(jìn)技術(shù)發(fā)展的熱點(diǎn)��,隨著國(guó)內(nèi)外相關(guān)指導(dǎo)原則的落地實(shí)施��,對(duì)其技術(shù)內(nèi)容的規(guī)范化也提出了更高要求��,因此我國(guó)相關(guān)國(guó)家標(biāo)準(zhǔn)也應(yīng)持續(xù)地進(jìn)行完善����,特別是物料表征方法、質(zhì)量研究方法�、過程傳感方法、工藝控制方法等通用技術(shù)要求方面�����。本文介紹了國(guó)內(nèi)外藥典標(biāo)準(zhǔn)對(duì)連續(xù)制造技術(shù)進(jìn)步和規(guī)范發(fā)展的推動(dòng)作用,分析了連續(xù)制造相關(guān)國(guó)家標(biāo)準(zhǔn)增修訂的必要性����,并結(jié)合國(guó)內(nèi)外標(biāo)準(zhǔn)的發(fā)展現(xiàn)狀提出了當(dāng)前口服固體制劑領(lǐng)域的增修訂建議。以期通過提升社會(huì)各界對(duì)藥品連續(xù)制造通用技術(shù)要求的關(guān)注度�,進(jìn)一步加快相關(guān)領(lǐng)域標(biāo)準(zhǔn)化研究工作,助力我國(guó)制藥行業(yè)先進(jìn)制造技術(shù)高質(zhì)量發(fā)展�����。
The application of continuous manufacturing in oral solid dosage is a hot topic in the advancement of pharmaceutical technology. With the implementation of international and domestic guiding principles, higher requirements are put forward for the standardization of the content of continuous pharmaceutical manufacturing technology, which necessitates relevant national standards to be continuously improved, especially with regards to general technical requirements, such as material characterization methods, quality research methods, process sensing methods, process control methods, etc.This paper introduces the role of pharmacopoeia in promoting technological progress and addressing the need for standard development of pharmaceutical continuous manufacturing. Furthermore, it analyzes the necessity of updating and revising relevant pharmacopoeia standards for continuous manufacturing of oral solid dosage, and puts forward suggestions for potential changes based on the status quo observed both domestically and internationally. It is aimed to raise awareness about general technical requirements of continuous pharmaceutical manufacturing, foster standardization research in related fields, so as to facilitate the high-quality development of advanced manufacturing technology in China’s pharmaceutical industry.
關(guān)鍵詞 Key words
藥品�;連續(xù)制造;國(guó)家標(biāo)準(zhǔn)��;通用技術(shù)要求�;增修訂
pharmaceuticals; continuous manufacturing; pharmacopeia standards; general technical requirements; addendum
連續(xù)制造(continuous manufacturing,CM) 有助于確保產(chǎn)品的質(zhì)量穩(wěn)定一致��, 利于生產(chǎn)企業(yè)快速擴(kuò)大生產(chǎn)規(guī)模�,其生產(chǎn)設(shè)施和設(shè)備小、生產(chǎn)占用空間小����、科技屬性高、生產(chǎn)步驟少、加工時(shí)間短���、能耗低�、環(huán)境污染小�����, 采用智能化集成工藝�����, 可以使藥品制造業(yè)實(shí)現(xiàn)降本增效[1-3]�����。2021 年7月27 日�,國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use�,ICH) 發(fā)布了《Q13 :原料藥和制劑的連續(xù)制造》草案,并向公眾征求意見����;2022 年11月16 日,《Q13 ∶原料藥和制劑的連續(xù)制造》最終版發(fā)布�,藥品連續(xù)制造發(fā)展進(jìn)入了新時(shí)代[4-7]。一直以來我國(guó)積極參與ICH Q13指導(dǎo)原則的制修訂,2021 年10月18 日《關(guān)于公開征求ICH 指導(dǎo)原則〈Q13 ∶原料藥和制劑的連續(xù)制造〉意見的通知》發(fā)布�����;隨后國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心(以下簡(jiǎn)稱藥審中心)組織起草了《化藥口服固體制劑連續(xù)制造技術(shù)指導(dǎo)原則(試行)》���,并于2023 年3 月21 日發(fā)布��;近期藥審中心又?jǐn)M定了《〈Q13 :原料藥和制劑的連續(xù)制造〉實(shí)施建議》�,同時(shí)組織翻譯了Q13 的中文版���,于2023 年5 月10 日對(duì)該實(shí)施建議和中文版公開征求意見[8-10]��。
全球主要的藥品監(jiān)管機(jī)構(gòu)都在鼓勵(lì)連續(xù)制造技術(shù)的應(yīng)用�。2015~2022 年�����,美國(guó)��、歐盟��、英國(guó)��、日本以及我國(guó)陸續(xù)批準(zhǔn)了覆蓋3類工藝生產(chǎn)線、7 家制藥企業(yè)的12 個(gè)口服固體制劑品種上市�����,共涉及23 項(xiàng)批準(zhǔn)文件���。連續(xù)制造技術(shù)的快速發(fā)展促進(jìn)了全球業(yè)界實(shí)踐以及監(jiān)管經(jīng)驗(yàn)的積累�,對(duì)我國(guó)連續(xù)制造相關(guān)法規(guī)����、指導(dǎo)原則及指南的制定具有重要借鑒意義[11-14]。值得注意的是��,口服固體制劑連續(xù)制造相比傳統(tǒng)的批制造在物料輸入輸出方式���、設(shè)備要求、過程控制�����、產(chǎn)品放行等方面具有特殊性����。例如�����,在物料投入工藝的方式上���,批制造物料不需過多考慮粉末的物理性質(zhì),可由天平直接精確測(cè)量�,而連續(xù)制造則需通過螺桿或皮帶給料機(jī)等方式進(jìn)行計(jì)量稱重,并要求藥物活性成分(active pharmaceutical ingredient��,API) 和輔料具備適當(dāng)?shù)牧鲃?dòng)性而非黏性�����,使粉末可以連續(xù)準(zhǔn)確地輸入到混合�、制粒、壓片等單元操作中��;連續(xù)制造需要表征更多的關(guān)鍵物料屬性(critical material attributes�,CMA),以避免工藝設(shè)備中的粉末偏析或死區(qū)形成���,這在批制造僅是清潔和轉(zhuǎn)換問題�,而在連續(xù)制造中則可能導(dǎo)致工藝中的物料無法追溯甚至批間污染���。在工藝設(shè)備方面�����,與批制造相比連續(xù)制造的設(shè)備需要額外考慮所處理物料的粒徑�����、形狀�、流動(dòng)、壁面摩擦和濕法制?���;蛑苯訅浩B續(xù)加工的靜電,且應(yīng)便于快速清潔和拆裝��。此外��,在單元操作設(shè)備中的物料停留時(shí)間也較批制造有更嚴(yán)格的要求��,例如包衣設(shè)備的處理時(shí)間需保證工藝連續(xù)且質(zhì)量均勻���。批制造較多采用經(jīng)驗(yàn)關(guān)鍵工藝參數(shù)(critical process parameter,CPP) 和離線檢驗(yàn)獲取關(guān)鍵質(zhì)量屬性(critical quality attribute�,CQA) 以保證生產(chǎn)質(zhì)量���, 而連續(xù)制造更多的利用過程分析技術(shù)(process analytical technologies,PAT)在生產(chǎn)過程中對(duì)原料����、中間品、成品CPP 和CQA 進(jìn)行連續(xù)�����、定期和實(shí)時(shí)的監(jiān)測(cè)��,理論上提高了質(zhì)量保證能力��,但也帶來了新挑戰(zhàn)��,需要深入研究抽樣策略���、產(chǎn)品分流或拒絕��、批放行和召回�、控制策略和物料的可追溯性���。相較批制造����, 連續(xù)制造雖然在反饋控制、實(shí)時(shí)保證和實(shí)時(shí)放行檢驗(yàn)(real time release testing�����,RTRT)方面有更多的應(yīng)用�,但實(shí)現(xiàn)其全部?jī)?yōu)勢(shì)還需要科學(xué)的方法支撐,以便更精準(zhǔn)而充分的表征CPP��、CQA 或CMA�,因此結(jié)合CM 技術(shù)的發(fā)展開展通用技術(shù)要求的增修訂是十分必要的[15-17]。在藥典通用技術(shù)要求方面�,國(guó)內(nèi)外也積累了一定的經(jīng)驗(yàn),并不斷推進(jìn)相關(guān)標(biāo)準(zhǔn)的發(fā)展����,但在輸入物料特性、連續(xù)制造工藝和產(chǎn)品放行以及上市產(chǎn)品標(biāo)準(zhǔn)等方面��,現(xiàn)行的通則和指導(dǎo)原則等還難以滿足藥品連續(xù)制造發(fā)展的需要���,特別是粉末流動(dòng)特性、近紅外或拉曼光譜成分分析��、PAT 和RTRT等方面尚待進(jìn)一步的突破與創(chuàng)新。為此�,本文介紹了我國(guó)和美國(guó)的藥典標(biāo)準(zhǔn)對(duì)連續(xù)制造發(fā)展的推動(dòng),探討了連續(xù)制造相關(guān)藥典標(biāo)準(zhǔn)增修訂的必要性���,并提出了通用技術(shù)要求方面的建議��,以期提升社會(huì)各界對(duì)連續(xù)制造通用技術(shù)要求的關(guān)注度����,進(jìn)一步加快相關(guān)領(lǐng)域標(biāo)準(zhǔn)化研究工作����,助力我國(guó)制藥行業(yè)先進(jìn)制造技術(shù)高質(zhì)量發(fā)展。
1�����、 相關(guān)部門對(duì)連續(xù)制造發(fā)展的推動(dòng)
1.1 美國(guó)藥典委員會(huì)
美國(guó)在連續(xù)制造監(jiān)管與產(chǎn)業(yè)發(fā)展領(lǐng)域處于全球領(lǐng)先地位�����。美國(guó)食品藥品監(jiān)督管理局(Food and Drug Administration ���,F(xiàn)DA)認(rèn)為��, 連續(xù)制造與傳統(tǒng)的批制造不同�, 后者API 或制劑成品經(jīng)常分步驟在許多不同地點(diǎn)生產(chǎn),而連續(xù)制造則允許各個(gè)生產(chǎn)要素在單個(gè)設(shè)施中以連續(xù)的過程進(jìn)行�。因此,連續(xù)制造技術(shù)可以幫助提高產(chǎn)量和效率��、降低成本�����、減少對(duì)環(huán)境的影響�、加速生產(chǎn)和擴(kuò)大規(guī)模以應(yīng)對(duì)緊急情況,還可以減少對(duì)外國(guó)供應(yīng)商的依賴���。FDA 認(rèn)為�����, 雖然傳統(tǒng)的批制造仍將是全球藥品生產(chǎn)能力的重要支柱�, 但連續(xù)制造可以避免相關(guān)供應(yīng)鏈可能面臨的中斷風(fēng)險(xiǎn)��。在美國(guó)藥典委員會(huì)(The United States Pharmacopieial Convention�,USP) 的一項(xiàng)調(diào)研中顯示,90% 的美國(guó)醫(yī)生受訪者同意在美國(guó)生產(chǎn)更多藥品,以防止藥物短缺[18]����?���?梢娺B續(xù)制造作為一種先進(jìn)制造技術(shù)對(duì)美國(guó)本土醫(yī)藥制造業(yè)的重要意義,同時(shí)���,先進(jìn)制造技術(shù)本土化生產(chǎn)也對(duì)藥品原輔料�����、中間品�����、制劑��、工藝設(shè)備�、過程控制�、檢驗(yàn)方法等提出了更高的要求。
USP 在推動(dòng)連續(xù)制造標(biāo)準(zhǔn)化工作方面����,一直與醫(yī)藥界在多個(gè)應(yīng)用場(chǎng)景開展合作�。2016 年���,成立了連續(xù)制造專家組�����,專門推動(dòng)相關(guān)技術(shù)進(jìn)步�,并加強(qiáng)與各方的溝通交流[19]����。2018 年,USP 發(fā)布了《美國(guó)藥典委員會(huì)對(duì)藥品連續(xù)制造的考量》(USP Perspective for Pharmaceutical Continuous Manufacturing)����,討論和回顧了行業(yè)關(guān)注的問題,并嘗試性地將連續(xù)制造領(lǐng)域的一些術(shù)語和定義進(jìn)行標(biāo)準(zhǔn)化[20]����。近年來,USP 組織了一系列的討論����,涵蓋標(biāo)準(zhǔn)化成分表征方法���、規(guī)范產(chǎn)品表征方法、規(guī)范設(shè)備性能要求�����、標(biāo)準(zhǔn)化傳感方法����、標(biāo)準(zhǔn)化控制能力���、規(guī)范產(chǎn)品或工藝開發(fā)方法等方面�,并開設(shè)了相關(guān)培訓(xùn)課程[21]����。2021年,USP 更提出了政策建議�����,即希望美國(guó)充分接納連續(xù)制造的制造理念�,促進(jìn)建立一條更具彈性的供應(yīng)鏈,以確保為患者持續(xù)提供安全��、高質(zhì)量的藥品,從而應(yīng)對(duì)公共衛(wèi)生危機(jī)等情況下的藥品短缺風(fēng)險(xiǎn)[22]�����。
USP 通過其標(biāo)準(zhǔn)工作助力推動(dòng)業(yè)界對(duì)連續(xù)制造加深理解��,促進(jìn)更多藥品連續(xù)制造應(yīng)用能夠落地實(shí)施[23-26]����。除了常見的理化性質(zhì)、安全性�、有效性指標(biāo)外,采用藥品連續(xù)制造工藝的產(chǎn)品所涉及的標(biāo)準(zhǔn)還可能包括粒度���、表面積��、密度���、溶出度、含量均勻度等方面的測(cè)定��。由于連續(xù)制造應(yīng)用屬于相對(duì)較前沿的領(lǐng)域��,且在不斷發(fā)展之中���,新的相關(guān)指南��、最佳實(shí)踐和質(zhì)量標(biāo)準(zhǔn)也需要不斷跟進(jìn)����,因此USP 積極與利益相關(guān)方合作,探索相關(guān)領(lǐng)域的研究���,以幫助進(jìn)一步加速生產(chǎn)創(chuàng)新����、支持監(jiān)管信心�����、加快審評(píng)審批�,并確保公眾信任���。USP 積極與業(yè)界合作��,開展對(duì)連續(xù)制造輸入和輸出物料PAT�、RTRT 等方面標(biāo)準(zhǔn)開發(fā)和制定��,例如2008 年建成第一條綜合生產(chǎn)線,2011 年建成第一條閉環(huán)控制線等��。除此之外��,USP 還創(chuàng)建了集成產(chǎn)品和工藝開發(fā)范例����,并開發(fā)了多種連續(xù)制造新方法,包括:在補(bǔ)料過程中盡量減少給料機(jī)變異性的方法����;用于連續(xù)攪拌機(jī)的設(shè)計(jì)和集成生產(chǎn)線物料溯源的停留時(shí)間分布(residence time distribution,RTD) 框架方法��;集成工藝建模方法��;給料機(jī)����、輥壓機(jī)、混合機(jī)�、壓片機(jī)的集成閉環(huán)控制演示方法;分析粉末連續(xù)流的集成PAT 方法���;直接壓片連續(xù)生產(chǎn)中的停留偏析演示方法等��。USP建立了連續(xù)制造知識(shí)中心(The Continuous Manufacturing Knowledge Center�,CMKC)網(wǎng)站,其工具和資源有助于連續(xù)制造技術(shù)的推廣�,該項(xiàng)目是USP與美國(guó)國(guó)家制藥技術(shù)與教育研究所(The National Institute for Pharmaceutical Technology &Education,NIPTE)合作設(shè)計(jì)���,是學(xué)習(xí)連續(xù)制造的首選場(chǎng)所之一��,其提供連續(xù)制造的基礎(chǔ)知識(shí)和最新技術(shù)學(xué)習(xí)����、培訓(xùn)��、交流�。USP認(rèn)為連續(xù)制造是有巨大前景的新興生產(chǎn)模式�,如果建立有規(guī)范且細(xì)致的相關(guān)方法,能夠給示范企業(yè)帶來直接效益�,但是采用該技術(shù)的壁壘是客觀存在的,特別是在化學(xué)原料藥����、生物大分子等領(lǐng)域,需要進(jìn)一步研究加以解決�。
1.2 國(guó)家藥典委員會(huì)
我國(guó)連續(xù)制造的監(jiān)管完善和產(chǎn)業(yè)發(fā)展也非常需要藥典標(biāo)準(zhǔn)的科學(xué)��、規(guī)范和高質(zhì)量推動(dòng)[27-29]����。國(guó)家藥典委員會(huì)在藥品標(biāo)準(zhǔn)制定方面發(fā)揮了核心作用��,很早就啟動(dòng)了連續(xù)制造質(zhì)量控制相關(guān)技術(shù)要求的跟進(jìn)與研究��。在線檢測(cè)技術(shù)是藥品連續(xù)制造能夠?qū)崿F(xiàn)精準(zhǔn)過程控制和產(chǎn)品實(shí)時(shí)檢驗(yàn)放行的重要基礎(chǔ)�,在《中國(guó)藥典》(2020年版)四部近紅外分光光度法指導(dǎo)原則中,引入了在線檢測(cè)的用途����,以支持指導(dǎo)在連續(xù)制造過程中持續(xù)直接測(cè)量工藝參數(shù)和物料屬性來評(píng)價(jià)和保證中間產(chǎn)品與成品質(zhì)量,避免等待離線檢測(cè)結(jié)果而影響制造過程的連續(xù)性��?���?紤]到粉體流動(dòng)性與口服固體制劑連續(xù)生產(chǎn)過程及制劑產(chǎn)品質(zhì)量密切相關(guān),國(guó)家藥典委員會(huì)組織起草了《粉體流動(dòng)性測(cè)定指導(dǎo)原則》并于2022 年7 月11 日公開征求意見�,可為藥品連續(xù)制造工藝開發(fā)和生產(chǎn)過程控制提供參考,該文件重點(diǎn)討論了最常用的測(cè)定方法�,闡明了重要的試驗(yàn)注意事項(xiàng),并提出了方法的標(biāo)準(zhǔn)化建議。此外�����,國(guó)家藥典委員會(huì)還設(shè)立了藥用輔料粉體流動(dòng)性測(cè)定法研究(第二階段)����、多變量統(tǒng)計(jì)過程控制技術(shù)指導(dǎo)原則的建立、過程分析技術(shù)指導(dǎo)原則的建立�、化學(xué)成像技術(shù)指導(dǎo)原則的建立、基于散射現(xiàn)象的分析方法及應(yīng)用指導(dǎo)原則的建立���、流變學(xué)檢測(cè)方法的建立��、粉體壓縮特性測(cè)定法研究���、粉體壓縮特性與制劑成型相關(guān)性研究等相關(guān)課題,加快推進(jìn)國(guó)內(nèi)藥品連續(xù)制造相關(guān)技術(shù)的標(biāo)準(zhǔn)化[30-31]����。
在藥品連續(xù)制造的培訓(xùn)和行業(yè)宣貫方面���,國(guó)家藥典委員會(huì)也在積極推進(jìn)�����。2022 年11 月�,為進(jìn)一步強(qiáng)化藥品生產(chǎn)全過程管理理念,幫助行業(yè)掌握《中國(guó)藥典》相關(guān)技術(shù)要求���,加強(qiáng)對(duì)藥品生產(chǎn)用原輔包以及生產(chǎn)過程的控制�,進(jìn)一步保障藥品質(zhì)量�����,國(guó)家藥典委員會(huì)舉辦了《中國(guó)藥典》藥物制劑質(zhì)量控制技術(shù)研討培訓(xùn)班�,邀請(qǐng)國(guó)家藥典委員會(huì)相關(guān)專業(yè)委員會(huì)委員、資深專家圍繞《中國(guó)藥典》注射劑�、吸入制劑等高風(fēng)險(xiǎn)制劑生產(chǎn)用原輔包的控制、生產(chǎn)過程關(guān)鍵工藝控制���、無菌控制���、新型藥物研制質(zhì)量控制考慮要點(diǎn)等相關(guān)技術(shù)要求進(jìn)行全面深入解讀,探討先進(jìn)檢測(cè)技術(shù)在藥品質(zhì)控的應(yīng)用���,分享新型藥品生產(chǎn)工藝風(fēng)險(xiǎn)管控策略的經(jīng)驗(yàn)�����,值得關(guān)注的是���,研討會(huì)上《國(guó)內(nèi)外關(guān)于藥品連續(xù)制造的概況及發(fā)展趨勢(shì)》的報(bào)告引起了廣泛關(guān)注�����。
此外����,國(guó)家藥典委員會(huì)還參與了中國(guó)藥品監(jiān)督管理研究會(huì)2022 年藥品連續(xù)制造監(jiān)管研究課題和2023 年藥品連續(xù)制造實(shí)施中的監(jiān)管研究課題�。該系列課題以國(guó)內(nèi)案例、相關(guān)法規(guī)和研究文獻(xiàn)為基礎(chǔ)����,通過對(duì)相關(guān)醫(yī)藥企業(yè)開展現(xiàn)場(chǎng)調(diào)研和座談交流,了解和掌握連續(xù)制造實(shí)施過程中的先進(jìn)技術(shù)和企業(yè)需求����,并形成研究報(bào)告,為監(jiān)管機(jī)構(gòu)提供參考��。通過組織學(xué)術(shù)論壇�����、搭建學(xué)術(shù)交流平臺(tái)�,推廣“連續(xù)制造”理念和技術(shù),為企業(yè)解決連續(xù)制造實(shí)施過程的難點(diǎn)和困惑��。
筆者認(rèn)為參考國(guó)內(nèi)外的相關(guān)經(jīng)驗(yàn)���,《中國(guó)藥典》借助其國(guó)內(nèi)和國(guó)際影響力��,通過積極配合ICHQ13 落地實(shí)施�,能夠推動(dòng)建立和完善連續(xù)制造領(lǐng)域的監(jiān)管和技術(shù)要求框架���,加強(qiáng)藥品供應(yīng)能力�,促進(jìn)利用高端制造技術(shù)生產(chǎn)更多優(yōu)質(zhì)藥品���,以保障藥品安全可及���。
2、 連續(xù)制造相關(guān)藥典標(biāo)準(zhǔn)增修訂的必要性
2.1 口服固體制劑連續(xù)制造對(duì)產(chǎn)品質(zhì)量影響的特殊性
在傳統(tǒng)批制造工藝中�����,需要先將物料裝載于各個(gè)操作單元,隨后按照經(jīng)過驗(yàn)證的工藝參數(shù)設(shè)置運(yùn)行直到預(yù)定的終點(diǎn)�;每個(gè)單元操作結(jié)束后,將物料從設(shè)備中輸出�,一般通過離線分析方法對(duì)中間品進(jìn)行檢驗(yàn);期間�����,中間品暫存在車間或倉庫���,直到符合放行要求�����,才可以輸入到下一個(gè)單元操作���。相比之下,連續(xù)制造的物料持續(xù)輸入�����,中間品或成品以相同的流量連續(xù)從工藝中取出��,以在穩(wěn)態(tài)加工期間保持系統(tǒng)中的恒定質(zhì)量流量�。傳統(tǒng)的批制造包括一系列獨(dú)立的單元操作( 稱量���、混合、制粒���、干燥、壓片等)�,而集成連續(xù)制造工藝將多個(gè)單元操作集成到單個(gè)生產(chǎn)工藝中,單元操作之間沒有啟停��, 因此����, 需要通過使用PAT 在工藝流中對(duì)CPP 以及原輔料、中間品和成品的CQA 進(jìn)行持續(xù)監(jiān)測(cè)����,以實(shí)時(shí)發(fā)現(xiàn)擾動(dòng)并通過反饋和前饋循環(huán)調(diào)節(jié)CPP 從而保持成品的CQA在合格范圍,縮短了放行周期�。本質(zhì)上,藥品連續(xù)制造的多操作單元�、物料、工藝���、裝備結(jié)構(gòu)等多維變量對(duì)產(chǎn)品質(zhì)量影響與批制造具有顯著區(qū)別����,其特殊性包括如下幾個(gè)方面[12]。
(1)多單元集成操作����,設(shè)備停機(jī)時(shí)間短,對(duì)設(shè)備內(nèi)襯材質(zhì)�、清潔方式、拆裝速度等方面提出了更高要求�。在批制造模式中,單元操作啟停����、裝卸會(huì)降低設(shè)備利用率,而連續(xù)制造工藝集成度高�,快速將物料轉(zhuǎn)化為片劑,并能夠?qū)崿F(xiàn)長(zhǎng)時(shí)間輸入輸出���,因此�,設(shè)備內(nèi)表面需要光潔耐磨以支持粉末或顆粒的持續(xù)流動(dòng)�����,并且在出現(xiàn)瞬時(shí)擾動(dòng)需要停機(jī)時(shí)能夠快速徹底清潔或更換部件����。
(2)產(chǎn)品質(zhì)量持續(xù)受控���,對(duì)關(guān)鍵物料屬性CMA 的適用性、過程分析的完備性和自動(dòng)控制的實(shí)時(shí)性要求更高�����。在批制造模式中�����,質(zhì)量控制和批放行主要依據(jù)生產(chǎn)結(jié)束后的取樣檢驗(yàn)結(jié)果��,如果物料或工藝參數(shù)波動(dòng)��,可能觸發(fā)整個(gè)批次的拒絕放行或返工��。在連續(xù)制造模式下,工藝不一定處于穩(wěn)態(tài)但需要保證持續(xù)受控狀態(tài)�,需要精確的過程監(jiān)測(cè)和控制( 前饋或反饋) 以減少對(duì)成品質(zhì)量的影響����,并及時(shí)分流不合格物料,因此����,連續(xù)制造物料質(zhì)量要求更高���、CMA 項(xiàng)目更多,一般需要通過靈敏的在線分析技術(shù)結(jié)合追溯模型動(dòng)態(tài)掌握停留時(shí)間分布�。
(3)自動(dòng)化程度高,人工干預(yù)的窗口有限����,需要對(duì)工藝和裝備結(jié)構(gòu)有更深入的理解。批制造模式在各單元操作和間歇期間均需要較多人工干預(yù)��,而連續(xù)制造工藝步驟之間通過集成的自動(dòng)化系統(tǒng)進(jìn)行通信���,需要工藝當(dāng)中的CPP�����、CMA��、CQA 采樣更精準(zhǔn)充分����,也需要裝備結(jié)構(gòu)更靈活穩(wěn)健。此外���,在傳輸線����、篩網(wǎng)���、制粒機(jī)桶壁�、沖床表面等部位物料積聚導(dǎo)致結(jié)垢等方面�����,應(yīng)當(dāng)避免出現(xiàn)頻繁人工干預(yù)的情況�����。
(4)供應(yīng)鏈更靈活�,對(duì)批次定義�����、穩(wěn)定性數(shù)據(jù)和生命周期持續(xù)工藝驗(yàn)證要求高�����。批制造模式的規(guī)模由設(shè)備的尺寸決定,而連續(xù)過程的規(guī)?����?梢酝ㄟ^改變生產(chǎn)時(shí)間來調(diào)整�����,并降低了中間品存儲(chǔ)空間需求同時(shí)支持更長(zhǎng)的貨架期�����。這就要求批量定義需更科學(xué)�����,并需要研究證明生產(chǎn)時(shí)間范圍內(nèi)產(chǎn)品質(zhì)量的均一性����、穩(wěn)定性,樣品的代表性和設(shè)備耐久性����,以保證藥品質(zhì)量���。
2.2 物料、工藝��、過程控制和產(chǎn)品放行需要明確的技術(shù)要求
以口服固體制劑物料性能表征為例���,相關(guān)標(biāo)準(zhǔn)的增修訂對(duì)于連續(xù)制造技術(shù)應(yīng)用于藥品生產(chǎn)的實(shí)踐是非常重要的�。物料( 成分或組分) 的物理特性對(duì)系統(tǒng)的整體行為起著很大的作用���,這也是科學(xué)和工程領(lǐng)域的共識(shí)���,相關(guān)特性在精細(xì)化工連續(xù)制造中已用作過程和產(chǎn)品質(zhì)量的指標(biāo),雖然口服固體制劑在化學(xué)上與精細(xì)化學(xué)品相似�,但從批制造轉(zhuǎn)變?yōu)檫B續(xù)生產(chǎn)方式時(shí),需要對(duì)原輔料�����、中間產(chǎn)品物料特性表征進(jìn)行深入的研究��,并建立相應(yīng)的標(biāo)準(zhǔn)[32]�。
口服固體制劑的生產(chǎn)可能涉及液體加工以及干燥顆粒��,加工時(shí)物料特性表征、控制�、工藝性能具有緊密的聯(lián)系,通常采用質(zhì)量標(biāo)準(zhǔn)和成熟分析方法對(duì)其進(jìn)行監(jiān)測(cè)和控制��。如果生產(chǎn)條件不變����、工藝運(yùn)行在控制范圍內(nèi),通?����?梢源_定物料的可變性或變化是出現(xiàn)問題的根本原因����。將原料的可變性與工藝過程聯(lián)系起來,建立原料與混合物料性能相關(guān)模型����,可以在生產(chǎn)前就保證產(chǎn)品質(zhì)量,而藥品連續(xù)制造提前考慮到了原材料的可變性���,通過實(shí)時(shí)過程控制進(jìn)行補(bǔ)償��,并將不合格物料及時(shí)轉(zhuǎn)移���。為改進(jìn)控制狀態(tài)���,實(shí)現(xiàn)穩(wěn)健控制策略并符合質(zhì)量源于設(shè)計(jì)理念,物料檢驗(yàn)標(biāo)準(zhǔn)以及分析方法的建立是尤為重要的�。因此, 探索如何測(cè)定物料的特性���,測(cè)定哪些特性����,物料是否需要通過在線技術(shù)進(jìn)行測(cè)定�����,以及考慮是否適合直接采用分析報(bào)告(certificate of analysis�����,COA)的值成為實(shí)現(xiàn)穩(wěn)健控制的亟待明確的問題�。與傳統(tǒng)的批制造不同,粉末成分和混合物的物理性能與連續(xù)生產(chǎn)線性能的相關(guān)性已經(jīng)得到了較充分的研究�,不合格物料的產(chǎn)生很大程度上取決于工藝或設(shè)備組合�、材料或配方特性和適當(dāng)?shù)目刂撇呗缘脑O(shè)計(jì)��。此外�,連續(xù)制造輸入和輸出的物料需精準(zhǔn)計(jì)量和監(jiān)控�,信息和控制范圍較批制造工藝更多,可能會(huì)面臨與物料相關(guān)的特殊問題�����,為此�,需要對(duì)CMA 以及對(duì)應(yīng)的表征方法進(jìn)行深入研究[33],這就需要建立相應(yīng)標(biāo)準(zhǔn)和方法�����,以及明確物料�����、工藝����、過程控制和產(chǎn)品放行的技術(shù)要求。
3���、 國(guó)家標(biāo)準(zhǔn)通用技術(shù)要求增修訂的建議
行業(yè)研究的積極氛圍需要藥典標(biāo)準(zhǔn)全方位的組織和推動(dòng)���,為此���,筆者建議可通過以下幾項(xiàng)措施具體推動(dòng):①推進(jìn)連續(xù)制造的標(biāo)準(zhǔn)化。藥典標(biāo)準(zhǔn)可以促進(jìn)連續(xù)制造的多領(lǐng)域標(biāo)準(zhǔn)化�,包括:控制策略、成分表征���、產(chǎn)品放行���、設(shè)備或系統(tǒng)要求、傳感技術(shù)以及系統(tǒng)建模等�,促進(jìn)連續(xù)制造技術(shù)的規(guī)范應(yīng)用和高質(zhì)量發(fā)展。②擴(kuò)大連續(xù)制造的影響力��。連續(xù)制造需要從藥物發(fā)現(xiàn)��、制劑開發(fā)�����、裝備制造�、數(shù)字化建設(shè)、人才培養(yǎng)、國(guó)際交流等方面共同推進(jìn)�,相關(guān)單位可以利用國(guó)內(nèi)外相關(guān)資源開展培訓(xùn)和交流����,為專業(yè)技術(shù)人才儲(chǔ)備夯實(shí)基礎(chǔ)。③整合連續(xù)制造的各方資源�����。藥典標(biāo)準(zhǔn)的增修訂工作可以與藥品審評(píng)���、檢查�、檢驗(yàn)�、研發(fā)、生產(chǎn)�、供應(yīng)鏈等環(huán)節(jié)工作共同推進(jìn),持續(xù)支持相關(guān)課題的研究���,不斷形成藥品連續(xù)制造通用技術(shù)要求共識(shí)�。
為推進(jìn)連續(xù)制造在我國(guó)的落地實(shí)施��,2022~2023 年�����, 中國(guó)藥品監(jiān)督管理研究會(huì)分別立項(xiàng)了藥品連續(xù)制造監(jiān)管研究和藥品連續(xù)制造實(shí)施中的監(jiān)管研究課題。研究人員組織了系列法規(guī)討論���,分析了現(xiàn)行法規(guī)對(duì)連續(xù)制造的支持程度以及是否存在差異���。從分析結(jié)果可以看出,《中國(guó)藥典》(2020 年版)與Q13 相關(guān)規(guī)定不存在沖突���,多數(shù)技術(shù)要求在用于連續(xù)制造時(shí)均可以加以解釋�。此外���,近紅外分光光度法指導(dǎo)原則中已經(jīng)明確指出���,該方法可以直接進(jìn)行“在線”過程控制,且方法學(xué)驗(yàn)證與其他分析方法的要求相似���, 這說明其他RTRT 類分析方法也基本可以按照現(xiàn)行藥典標(biāo)準(zhǔn)要求開展方法驗(yàn)證工作����。經(jīng)分析�,研究人員認(rèn)為現(xiàn)階段藥典標(biāo)準(zhǔn)需要完善的方面主要應(yīng)聚焦于連續(xù)制造相關(guān)通用技術(shù)要求的補(bǔ)充和細(xì)化。
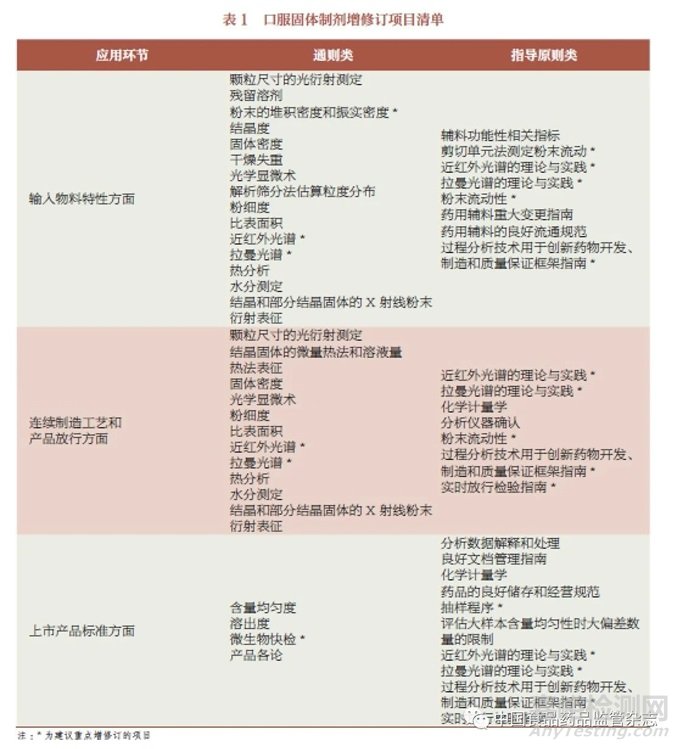
基于上述研究,本文提出了應(yīng)用環(huán)節(jié)方面的口服固體制劑增修訂項(xiàng)目的清單�����,包括:①輸入物料特性方面��,含通則類15 個(gè)項(xiàng)目�����、指導(dǎo)原則類8 個(gè)項(xiàng)目����;②連續(xù)制造工藝和產(chǎn)品放行方面���,含通則類12 個(gè)項(xiàng)目���、指導(dǎo)原則類7 個(gè)項(xiàng)目;③上市產(chǎn)品標(biāo)準(zhǔn)方面�,含通則類4 個(gè)項(xiàng)目、指導(dǎo)原則類10 個(gè)項(xiàng)目���。在不同的應(yīng)用環(huán)節(jié)��,可能需參照相同的通用技術(shù)要求��,本文共計(jì)參考19 個(gè)通則類和16 個(gè)指導(dǎo)原則類文件�����,相關(guān)內(nèi)容也與國(guó)際的其他標(biāo)準(zhǔn)或指南進(jìn)行了對(duì)比�,見表1。值得注意的是�����,表1 中部分項(xiàng)目為大類��,如果相關(guān)產(chǎn)品存在具體的規(guī)定尚需要結(jié)合實(shí)際上市產(chǎn)品情況進(jìn)行分析��。
4�����、 展望
隨著ICH Q13 以及我國(guó)口服固體制劑連續(xù)制造指導(dǎo)原則陸續(xù)發(fā)布��,藥典標(biāo)準(zhǔn)通用技術(shù)要求也在監(jiān)管機(jī)構(gòu)與社會(huì)各界的協(xié)作下不斷完善�����。如前文所述,藥典標(biāo)準(zhǔn)的相關(guān)內(nèi)容與連續(xù)制造規(guī)定不沖突���,筆者認(rèn)為除了通用技術(shù)要求增修訂建議外�����,其他細(xì)節(jié)方面也可考慮結(jié)合連續(xù)制造特點(diǎn)進(jìn)行完善��。例如���,可用于RTRT 相關(guān)的PAT 方法在相對(duì)成熟時(shí)也可以考慮納入藥典通用技術(shù)要求����;關(guān)于亞批的定義和檢驗(yàn)要求建議進(jìn)一步細(xì)化;部分總論���、通則可考慮更適合連續(xù)生產(chǎn)的表述方式�,并結(jié)合自身產(chǎn)品和工藝特點(diǎn)的評(píng)估確定單元操作結(jié)束的范圍�����;在微生物和無菌檢驗(yàn)檢查方面�����,建議考慮納入快檢技術(shù)作為補(bǔ)充等。
連續(xù)制造作為生產(chǎn)模式的轉(zhuǎn)變�,其目的是通過良好控制的工藝、物料和中間過程控制來確保滿足藥品關(guān)鍵質(zhì)量屬性�。建議現(xiàn)階段在連續(xù)制造相關(guān)國(guó)家標(biāo)準(zhǔn)通用技術(shù)要求增修訂方面,主要聚焦相對(duì)成熟的口服固體制劑應(yīng)用領(lǐng)域���,針對(duì)連續(xù)制造本身的技術(shù)特點(diǎn)�,結(jié)合國(guó)內(nèi)外相關(guān)標(biāo)準(zhǔn)制定經(jīng)驗(yàn)進(jìn)行考量��?����?紤]到口服固體制劑應(yīng)符合產(chǎn)品質(zhì)量屬性和產(chǎn)品性能的質(zhì)量標(biāo)準(zhǔn)�,在連續(xù)制造的監(jiān)管策略和產(chǎn)業(yè)應(yīng)用方面,過程控制和物料輸入與最終產(chǎn)品關(guān)鍵質(zhì)量屬性的關(guān)聯(lián)是至關(guān)重要的��,因此�,相關(guān)的規(guī)范和標(biāo)準(zhǔn)對(duì)于連續(xù)制造實(shí)施過程中保障藥品質(zhì)量以及產(chǎn)業(yè)高質(zhì)量健康發(fā)展具有重要意義。
引用本文
曹萌�����,葛淵源,曹輝�����,李香玉�����,陳蕾*.連續(xù)制造口服固體制劑藥典標(biāo)準(zhǔn)通用技術(shù)要求探討[J].中國(guó)食品藥品監(jiān)管.2023.09(236):32-39.