近日,F(xiàn)DA發(fā)布了一份立即生效的指南���,標題為:用于支持患者監(jiān)測的無創(chuàng)遠程監(jiān)測設備的強制執(zhí)行政策 Enforcement Policy for Non-Invasive Remote Monitoring Devices Used to Support Patient Monitoring。
本指南取代了標題為“Enforcement Policy for Non-Invasive Remote Monitoring Devices Used to Support Patient Monitoring During the Coronavirus Disease 2019 (COVID-19) Public Health Emergency” 的最終指南���,該指南的有效期至2023年11月7日�。
【指南適用范圍】
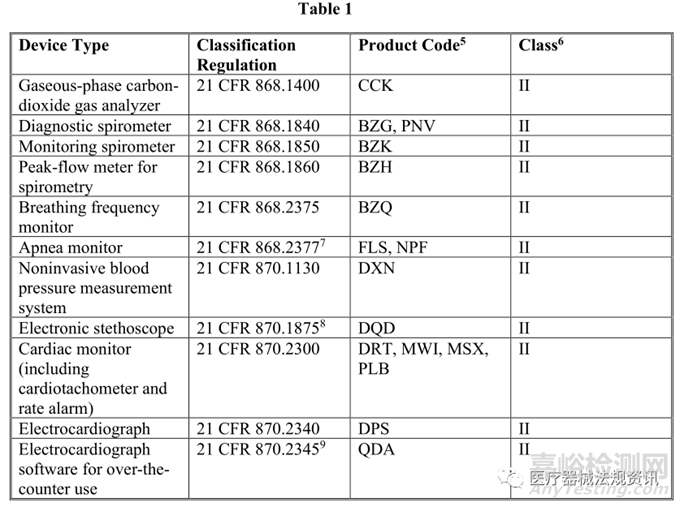
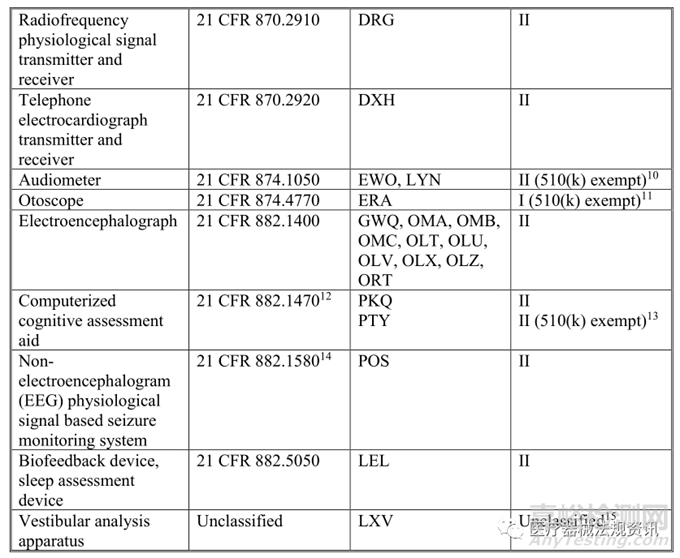
本指南中描述的強制執(zhí)行政策適用于修改后的設備,其中原始設備是指南中列出的合法銷售的非侵入性遠程監(jiān)測設備�,這些設備用于測量或檢測常見生理參數(shù),并用于支持患者監(jiān)測(見下表1)�。
這些非侵入性監(jiān)測設備有可能通過藍牙、Wi-Fi或蜂窩連接連接到無線網絡�����,將患者的測量結果直接傳輸給他們的醫(yī)療保健提供者或其他監(jiān)測實體�。
【指南目的】
本指南是為了促進安全有效的醫(yī)療設備的持續(xù)可用性,同時對非侵入性監(jiān)測設備的某些修改保持靈活性�。它提供了有關修改適應癥、功能和硬件或軟件的建議�����,以提高遠程監(jiān)控的可得性或能力�,并提供有關標簽和/或確認的建議,以支持與執(zhí)行政策相關的此類修改�����。
【強制執(zhí)行政策】
上述表1中列出的非侵入性遠程監(jiān)測設備的制造商,必須向FDA提交上市前通知�,并在這些設備在美國上市前獲得FDA的clearance,前提是這些設備不屬于510(k)豁免范圍���,并符合上市后要求�。
目前���,基于FDA目前對這些設備風險的理解���,當對用于支持患者監(jiān)測的某些非侵入性遠程監(jiān)測設備的適應癥、功能�、或硬件或軟件(以下簡稱“受試者設備”)進行受限更改( limited modifications),且更改不會產生過度風險且不會直接導致影響生理參數(shù)測量算法�����,F(xiàn)DA允許不提交510(k)�����。
此類更改示例包括:
對于以前僅在醫(yī)院或其他醫(yī)療機構銷售的設備�����,改為在家庭環(huán)境中使用的適應癥;和
提高遠程監(jiān)控能力的硬件或軟件更改���。
A. 適應癥或功能的修改
此時,F(xiàn)DA不打算反對對設備的適應癥或功能進行有限的更改���,這些更改允許在沒有提交510(k)的情況下提高遠程監(jiān)測能力�,不會產生過度的風險�,也不會直接影響生理參數(shù)測量算法。FDA通常認為���,對適應癥進行更改以允許在家庭環(huán)境中使用�,不會產生這樣的過度風險�����,也不會影響生理參數(shù)測量算法�����。
相反�����,對可能產生這種過度風險或可能影響生理參數(shù)測量算法的適應癥或功能的修改將不在本政策的范圍內,并且通常需要提交510(k)���。例如���,添加新適應癥或新軟件功能以允許設備的遠程編程、設備的遠程控制�、新警報的生成、新生理參數(shù)的測量或從處方到非處方使用的改變的更改將不在本政策的范圍內�。
FDA還提供了與上述強制執(zhí)行政策相關的標簽建議。FDA建議設備使用標簽�,以幫助用戶更好地了解該設備。FDA建議標簽包括以下內容:
1) 設備新適應癥或功能的可用數(shù)據(jù)的清晰描述�����,包括:
a.設備性能���;和 b.潛在風險�����。
2)使用條件的信息���,特別是設備是否用于抽查�����、趨勢監(jiān)測或連續(xù)監(jiān)測�����。
3)對于以前僅在醫(yī)院或其他醫(yī)療機構銷售的設備,并且其使用環(huán)境已擴大到包括在家庭中使用的設備�����,應提供在家庭環(huán)境中使用的適當說明和適當?shù)耐庑行g語�����。
B.旨在提高遠程監(jiān)控可得性或功能的硬件或軟件更改
當修改不會產生不適當?shù)娘L險并且修改不會直接影響生理參數(shù)測量算法時�,F(xiàn)DA不打算反對對設備進行有限的硬件或軟件架構修改,這些修改允許在沒有提交510(k)的情況下增加遠程監(jiān)測能力�。制造商還應考慮上述A點中的建議,因為為支持患者監(jiān)測而進行的硬件或軟件架構修改也可能影響設備的適應癥和功能���。
FDA預計�����,這些類型的更改通常包括設備連接修改(例如�����,添加無線和/或藍牙功能)�,這可能保證伴隨的非設備和設備硬件或軟件架構修改。當遵循以下列出的適用的FDA認可的標準和指南時�,這類更改通常不會產生過度的風險,并且通常不會影響生理參數(shù)測量算法�;因此,這種改變通常在這項政策的范圍內���。
ANSI/AAMI ES60601-1 Medical Electrical Equipment – Part 1: General Requirements for Basic Safety and Essential Performance
IEC 60601-1-2 Medical Electrical Equipment Part 1-2: General Requirements for Basic Safety and Essential Performance – Collateral Standard: Electromagnetic Disturbances – Requirements and Tests
IEC 60601-1-11 Medical Electrical Equipment Part 1-11: General Requirements for Basic Safety and Essential Performance – Collateral Standard: Requirements for Medical Electrical Equipment and Medical Electrical Systems Used in the Home Healthcare Environment
Any other applicable collateral/particular standards in the 60601-1 family
AAMI TIR69 Technical Information Report Risk Management of Radio-Frequency Wireless Coexistence for Medical Devices and Systems
ANSI/IEEE C63.27 American National Standard for Evaluation of Wireless Coexistence
IEC 62304 Medical Device Software – Software Life Cycle Processes
AIM 7351731 Medical Electrical Equipment and System Electromagnetic Immunity Test for Exposure to Radio Frequency Identification Readers
ANSI/UL 2900-2-1 First Edition 2017 – Standard for Safety, Software Cybersecurity for Network-Connectable Products, Part 2-1: Particular Requirements for Network Connectable Components of Healthcare and Wellness Systems
IEC 81001-5-1 Health software and health IT systems safety, effectiveness and security - Part 5-1: Security - Activities in the product life cycle
制造商必須根據(jù)制造商的質量體系記錄變更和分析���。
此外,旨在提高遠程監(jiān)控能力的硬件或軟件更改可能會影響網絡安全風險���。有效的網絡安全是確保此類設備安全和功能的必要條件�����。制造商必須遵守網絡安全要求�,并應遵守適用于其設備的網絡安全政策���。以下在線資源可能有助于開發(fā)和維護這些網絡安全控制:
Content of Premarket Submissions for Management of Cybersecurity in Medical Device
Postmarket Management of Cybersecurity in Medical Devices; and
FDA Fact Sheet: The FDA’s Role in Medical Device Cybersecurity - Dispelling Myths and Understanding Facts.