在非無(wú)菌藥品生產(chǎn)過(guò)程和有效期內(nèi)控制微生物水平和種類,對(duì)保證非無(wú)菌藥品質(zhì)量和患者安全至關(guān)重要�����,非無(wú)菌藥品中如存在不可接受微生物,有可能降低藥品的療效����,影響藥品質(zhì)量,對(duì)消費(fèi)者健康有潛在風(fēng)險(xiǎn)�。所以藥品注冊(cè)中,需藥品生產(chǎn)企業(yè)建立微生物風(fēng)險(xiǎn)識(shí)別和控制策略����,筆者結(jié)合微生物相關(guān)法規(guī)和指南����,整理分享了非無(wú)菌藥品注冊(cè)檢驗(yàn)中微生物檢驗(yàn)項(xiàng)目相關(guān)考量,歡迎大家一起交流學(xué)習(xí)這個(gè)主題����。
一�、藥品微生物檢驗(yàn)的法規(guī)和指南依據(jù)知多少?
藥品的微生物限度檢查是涉及藥品質(zhì)量和安全的重要項(xiàng)目����,中美藥品相關(guān)監(jiān)管機(jī)構(gòu)陸續(xù)發(fā)布法規(guī)和技術(shù)指南�����,要求對(duì)非無(wú)菌產(chǎn)品污染微生物進(jìn)行控制,期望減少不可接受微生物對(duì)產(chǎn)品質(zhì)量以及患者安全帶來(lái)的風(fēng)險(xiǎn)�����,確保產(chǎn)品有效性和安全性��。筆者整理分享如下表:
|
|
|
|
|
《中國(guó)藥典》三部/四部《1105 非無(wú)菌產(chǎn)品微生物限度檢查:微生物計(jì)數(shù)法》 |
|
|
《中國(guó)藥典》三部/四部《1106 非無(wú)菌產(chǎn)品微生物限度檢查:控制菌檢查法》 |
|
|
《中國(guó)藥典》三部/四部《1107 非無(wú)菌藥品微生物限度標(biāo)準(zhǔn)》 |
|
|
《中國(guó)藥典》三部/四部《9201 藥品微生物檢驗(yàn)替代方法驗(yàn)證指導(dǎo)原則》 |
|
|
《中國(guó)藥典》三部/四部《9203 藥品微生物實(shí)驗(yàn)室質(zhì)量管理指導(dǎo)原則》 |
|
|
《中國(guó)藥典》四部《1108 中藥飲片微生物限度檢查法》 |
|
|
《中國(guó)藥典》四部《1201 抗生素微生物檢定法》 |
|
|
《中國(guó)藥典》四部《3300 微生物檢查法》 |
|
|
《中國(guó)藥典》四部《9201 藥品微生物檢驗(yàn)替代方法驗(yàn)證指導(dǎo)原則》 |
|
|
《中國(guó)藥典》四部《9204 微生物鑒定指導(dǎo)原則》 |
|
|
《中國(guó)藥典》四部《9205 藥品潔凈實(shí)驗(yàn)室微生物監(jiān)測(cè)和控制指導(dǎo)原則》 |
|
|
CDE《非無(wú)菌化學(xué)藥品及原輔料微生物限度研究技術(shù)指導(dǎo)原則(試行)》(2023年2月21日) |
|
|
美國(guó)FDA“Microbiological Quality Considerations in Non-sterile Drug Manufacturing”(非無(wú)菌藥品生產(chǎn)中的微生物質(zhì)量考量)(2021年9月草案) |
|
|
USP通則<60>非無(wú)菌產(chǎn)品的微生物學(xué)檢驗(yàn)-洋蔥伯克霍爾德菌屬試驗(yàn) MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS—TESTS FOR BURKHOLDERIA CEPACIA COMPLEX |
|
|
USP通則<61>非無(wú)菌產(chǎn)品的微生物檢驗(yàn):微生物計(jì)數(shù)試驗(yàn)microbiological examination of nonsterile products: microbial enumeration tests |
|
|
USP通則<62>非無(wú)菌產(chǎn)品的微生物學(xué)檢驗(yàn)-控制菌檢驗(yàn) MICROBIOLOGICAL EXAMINATION OF NONSTERILE PRODUCTS TESTS FOR SPECIFIED MICROORGANISMS |
|
|
USP通則<610>非無(wú)菌吸入和鼻用產(chǎn)品的微生物取樣替代方法 ALTERNATIVE MICROBIOLOGICAL SAMPLING METHODS FOR NONSTERILE INHALED AND NASAL PRODUCTS |
|
|
USP通則<1111> 非無(wú)菌產(chǎn)品微生物檢查法: 藥品及藥用原料的微生物限度標(biāo)準(zhǔn) (Microbiological Examination of Nonsterile Products: Acceptance Criteria for Pharmaceutical Preparations and Substances for Pharmaceutical Use) |
|
|
USP 通則<1115>非無(wú)菌藥用原料和藥品的生物負(fù)載控制(Bioburden Control of Non-sterile Drug Substances and Products) |
二����、非無(wú)菌藥品注冊(cè)檢驗(yàn)中微生物檢驗(yàn)項(xiàng)目常見問(wèn)題?
非無(wú)菌藥品注冊(cè)檢驗(yàn)中��,非無(wú)菌制劑及原料的微生物限度檢查���,由于檢驗(yàn)?zāi)慷啵ㄉ婕靶柩蹙倲?shù)、霉菌及酵母菌總數(shù)以及多種類型的控制菌檢查)�、標(biāo)準(zhǔn)限值設(shè)定要求高和檢驗(yàn)方法靈活多樣等等,因此在注冊(cè)階段存在較多問(wèn)題��。在微生物相關(guān)群及講座中有藥友分享的幾個(gè)注冊(cè)檢驗(yàn)中涉及微生物項(xiàng)目的發(fā)補(bǔ)問(wèn)題��,比較有代表性�����,分享如下:
(1)申報(bào)資料未提供非無(wú)菌化學(xué)藥品的微生物限度控制策略。
(2)申報(bào)單位提供了本品【申報(bào)質(zhì)量標(biāo)準(zhǔn)】����,【檢驗(yàn)方法】和【檢驗(yàn)報(bào)告】,但未提供本品【微生物限度的方法適用性報(bào)告】��。
(3)在注冊(cè)批次穩(wěn)定性關(guān)鍵時(shí)間點(diǎn)和穩(wěn)定性末期未進(jìn)行微生物限度檢查�。
(4)【申報(bào)質(zhì)量標(biāo)準(zhǔn)】附件和【分析方法】中控制菌項(xiàng)目不一致�����,前者為金黃色葡萄球菌�,銅綠假單胞菌,大腸埃希菌和洋蔥伯克霍爾德菌群�,后者僅為金黃色葡萄球菌,銅綠假單胞菌�����,請(qǐng)確認(rèn)最終檢查項(xiàng)目。
(5)【申報(bào)質(zhì)量標(biāo)準(zhǔn)】“微生物限度”項(xiàng)符合中國(guó)藥典�,但【方法適用性資料】中所用試驗(yàn)菌菌株與中國(guó)藥典規(guī)定不一致。
(6)【方法適用性資料】需氧菌總數(shù)計(jì)數(shù)回收試驗(yàn)不充分����,未進(jìn)行白色念珠菌及巴西曲霉在胰酪大豆瓊脂培養(yǎng)基(SCDA)中的回收試驗(yàn)��。
(7)【申報(bào)質(zhì)量標(biāo)準(zhǔn)】“微生物限度”項(xiàng)和【檢驗(yàn)報(bào)告】中檢驗(yàn)項(xiàng)目為:需氧菌總數(shù)���,霉菌和酵母菌總數(shù),金黃色葡萄球菌��,銅綠假單胞菌����,大腸埃希菌,沙門菌���,白色念珠菌,但【方法適用性資料】較上述檢驗(yàn)項(xiàng)目增加了耐膽鹽革蘭陰性菌(定性檢驗(yàn))���,請(qǐng)確認(rèn)最終檢查項(xiàng)目���。
(8)根據(jù)【檢驗(yàn)方法】不能得到【檢驗(yàn)報(bào)告】中的計(jì)數(shù)結(jié)果���。
三�、如何建立非無(wú)菌藥品微生物控制策略��?
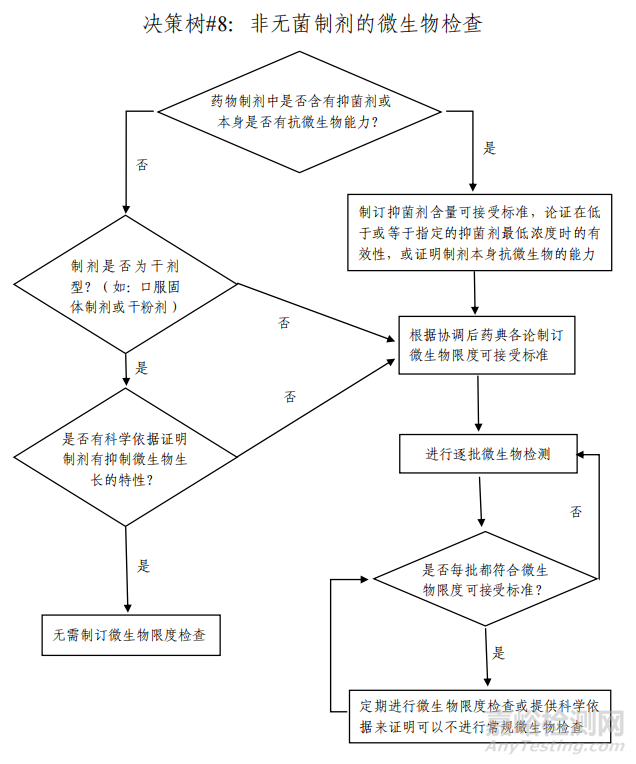
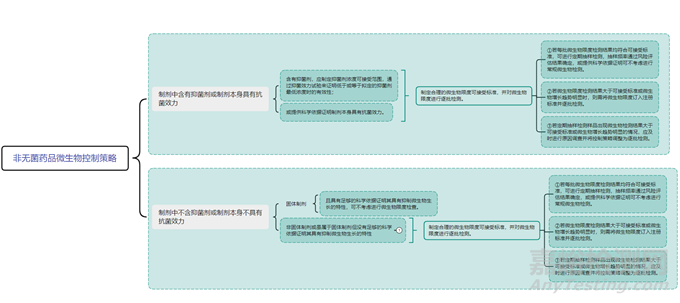
對(duì)于非無(wú)菌藥品�����,微生物限度是反映產(chǎn)品安全性和質(zhì)量可控性的重要指標(biāo)之一�。非無(wú)菌藥品微生物限度研究應(yīng)基于風(fēng)險(xiǎn)評(píng)估�,風(fēng)險(xiǎn)評(píng)估需綜合考慮產(chǎn)品特點(diǎn)、組成成份��、生產(chǎn)工藝�、車間環(huán)境����、設(shè)備清潔狀態(tài)�����、人員素質(zhì)��、最差生產(chǎn)條件���、歷史數(shù)據(jù)及趨勢(shì)等因素�,參考 ICH Q6A 決策樹#8(非無(wú)菌制劑的微生物限度檢查)(見圖1),制定企業(yè)自己產(chǎn)品的微生物限度控制策略(見圖2)�����。
▲圖1-ICH Q6A 決策樹#8(非無(wú)菌制劑的微生物限度檢查)
▲圖2-非無(wú)菌藥品微生物控制策略圖
參考文獻(xiàn)
[1]中國(guó)藥典�、USP官網(wǎng)�、NMPA及CDE文章�、注冊(cè)圈等公眾號(hào)文章