人工血管又叫做人造血管�����,通常是用滌綸、聚四氟乙烯��、聚氨酯等物質通過針織���、編織或者機織的方式制作而成��,一般用于嚴重狹窄或者閉塞性血管疾病���,作為血管替代物或支架,用于恢復血液流動�����,并維持身體組織的供氧和養(yǎng)分供應�����。人工血管仿真度比較高,并且長時間使用并不會發(fā)生退化���、破裂�����、膨脹等現(xiàn)象��,并且人工血管與人體血液相容性比較好�����,并不會出現(xiàn)排斥的反應��。目前��,許多材料已被用于制備人工血管�����。
人工血管(來源:網(wǎng)絡)
按照口徑大小���,人工血管被分為大口徑、中口徑�����、小口徑。其中���,10毫米以上為大口徑���,6-10毫米為中口徑,小于6毫米為小口徑?��,F(xiàn)如今,廣泛應用于臨床的人工血管均為中口徑及大口徑���,主要用于主動脈置換或搭橋��、外周血管旁路移植術���、血管創(chuàng)傷修復、血液透析血管通路��、冠脈旁路移植術等�����。
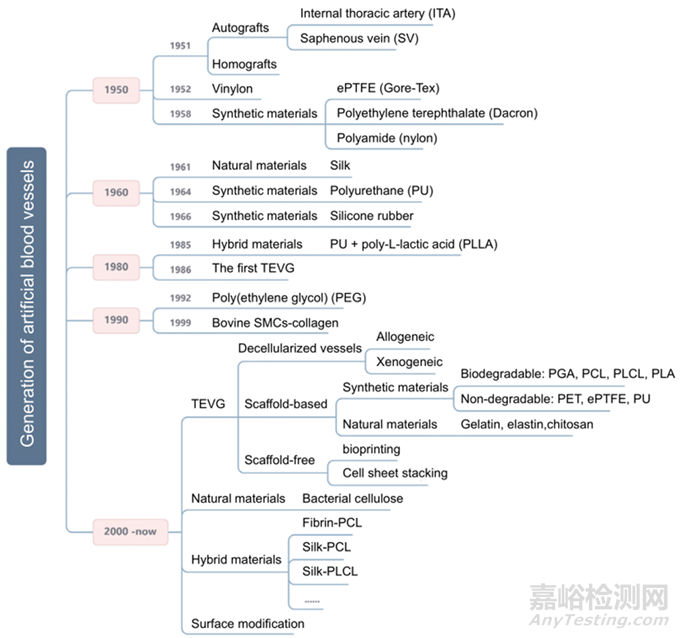
人工血管的發(fā)展歷史
如下圖所示,研究人員始終在嘗試改善對人工血管移植物的需求�����。早在1900年左右��,奧地利-德國外科醫(yī)生Payr用可吸收鎂制成的細管進行了實驗�����,標志著人工血管首次用于人類�����。然而�����,由于鎂誘導的纖維化組織的形成���,患者在3天后死于肺炎�����。1951年3月���,Dubost等利用尸源主動脈同種異體移植物進行了第一次成功的動脈瘤切除和移植物植入�����。1954年��,Blakemore和Voorhees首次用合成動脈替代品治療了10名患者�����,為后來人造血管的快速發(fā)展奠定了基礎��。然后���,在1958年��,De Bakey等人提出了Dacron人造血管作為尸源同種異體移植物的替代物�����,后者易于出現(xiàn)晚期并發(fā)癥���。隨后���,大多數(shù)研究人員將注意力集中在各種其他合成材料上�����,其中滌綸���、聚氨酯和膨體聚四氟乙烯(ePTFE)已被證明是血管外科手術中最可行的,但這種材料不適合血管直徑<6 mm的情況�����。
人工血管的發(fā)展歷史
1986年�����,Weinberg和Bell用滌綸和膠原復合材料生產(chǎn)了第一個組織工程血管�����,從此開啟了組織過程血管時代���。1990年��,一種不銹鋼和滌綸管移植物制成的支架成功應用于人類血管內動脈瘤修復術��。1999年���,首次將完全自體工程動脈植入豬受體體內���,表現(xiàn)出良好的通暢性和機械耐久性。
在過去的二十年里���,各種類型的組織工程血管替代物的開發(fā)取得了重大進展���。組織工程技術將細胞、組織支架和工程相結合�����,以生成血管移植物�����。特別是��,在通過不同方法使用組織工程技術方面���,小直徑人工血管的進展良好���,例如使用可生物降解聚合物作為支架或由脫細胞血管組織組成的人工血管。
臨床研究進展
人工血管在血管外科以及心血管外科均有應用��,其中包括冠狀動脈搭橋血管�����、外周血管補充血管���、血液透析血管等��。相關產(chǎn)品眾多��,本文僅以我國首個獲批上市的國產(chǎn)人工血管VASOLINE為例��,根據(jù)其臨床試驗情況看國產(chǎn)人工血管的有效性和安全性�����。
VASOLINE人工血管于2019年啟動全國多中心臨床試驗���,共入組248例受試者,其中四分叉人工血管采用前瞻性、多中心���、隨機對照��、非劣效性試驗設計�����,共入組188例���,試驗組和對照組各94例;直線型和側分叉人工血管采用單組設計���,各30例��。
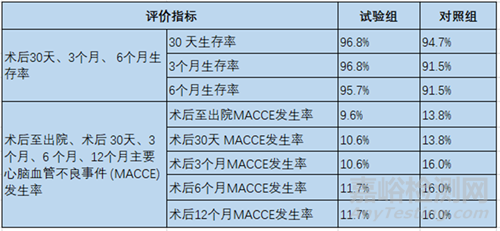
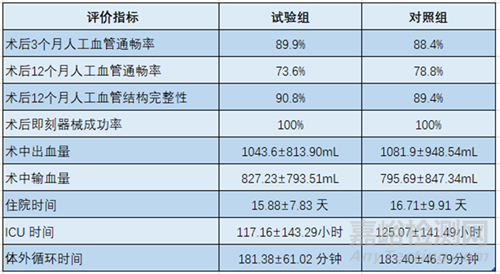
該臨床試驗的主要評價指標為術后12個月生存率�����。次要安全性評價指標包括術后30天���、3 個月、6個月生存率��,術后至出院���、術后30天��、3個月�����、6個月��、12個月�����、2-5年主要心腦血管不良事件(MACCE)發(fā)生率��。次要有效性評價指標包括術后12個月人工血管通暢率�����、術后即刻器械成功率�����、術后3個月人工血管通暢率�����、術后12個月人工血管結構完整性���、術中出血量�����、住院時間等��。
四分叉人工血管試驗中��,試驗組和對照組術后12個月生存率分別為95.7%�����、90.4%�����,生存率差值的95%置信區(qū)間(-1.9%, 13.0%)�����,達到非劣效性�����。次要安全性評價指標見表1��,次要有效性評價指標見表2���。
表1. 次要安全性評價結果
表2. 次要有效性評價指標結果
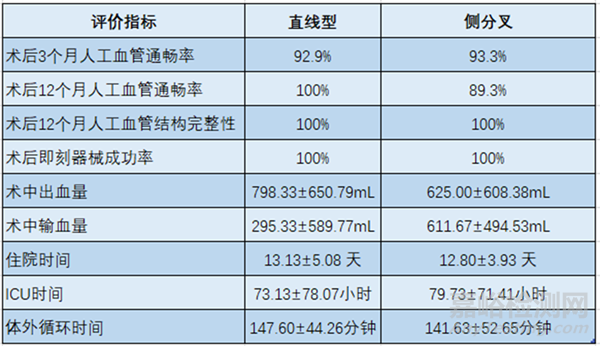
直線型和側分叉人工血管試驗中,術后12個月生存率分別為100%���、96.7%��。次要安全性評價指標見表3��,次要有效性評價指標見表4��。
表3. 次要安全性評價結果
表4. 次要有效性評價結果
不良事件發(fā)生情況為:隨機對照研究中��,試驗組和對照組分別發(fā)生83例���、87例不良事件,與研究器械有關的不良事件分別占1.1%��、2.1%��,兩組間無統(tǒng)計學差異。嚴重不良事件發(fā)生亦無無統(tǒng)計學差異�����。未發(fā)生與研究器械有關的嚴重不良事件��。單組研究中�����,直線型組和側分叉型組均發(fā)生6例嚴重不良事件��,且均與器械無關�����。
醫(yī)療器械行業(yè)是一個多學科交叉的高速發(fā)展的行業(yè)��,產(chǎn)品研發(fā)周期長�����,上市后監(jiān)管嚴厲�����。為了保證一款可以造福人民的醫(yī)療器械誕生,創(chuàng)新的材料�����、精密部件和精密加工工藝不可或缺�����。
人工血管的評價
體外評估
人工血管移植物的體外評估主要包括2個方面:力學性能和生物相容性�����。
人工血管應該具有足夠的機械性能�����,以支撐正常的血液流動和承受血流壓力���。同時,要展現(xiàn)出與自然血管相似的彈性特性���,以避免狹窄�����、擴張或破裂等問題��。機械性能方面���,核心問題在于保持柔順性的同時���,實現(xiàn)高強度。
生物材料的生物相容性也是設計人工血管時應考慮的最基本特性�����,要確保該材料具有良好的血液相容性�����,并且由于過敏反應等問題而產(chǎn)生免疫排斥的可能性較低�����。
體內動物試驗
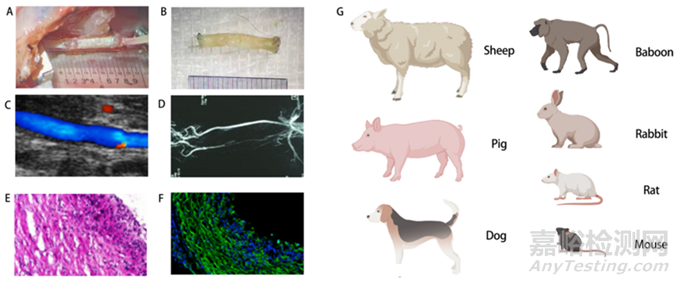
為了滿足合理測試各種類型人工血管性能的需求�����,要建立一個可行且穩(wěn)定的動物模型。目前���,常用的體內血管動物模型是豬�����、綿羊���、狗、兔子和大鼠�����。根據(jù)動物的大小和血管的直徑��,動脈模型的選擇不同��。大鼠腹主動脈置換術和兔頸動脈置換術是小口徑血管體內驗證的可行動物模型�����。
可以使用高分辨率超聲來評估移植物的功效���,例如平坦度、血管管腔、管腔中的血流速度以及植入后人工血管移植物的頻譜波形�����,通過與手術前拍攝的超聲圖像進行對比��,最終也可用于評估植入后的血管通暢性��。此外�����,微型計算機斷層攝影血管造影術還可用于評估人工血管的通暢性和體內人工血管的具體情況��。
人工血管的體內評估��。(A)植入時移植物的大體視圖���。(B)移植術后大體視圖���。(C)移植到大鼠頸總動脈的超聲圖像。(D)顯示移植物通暢性的血管造影記錄代表性圖像��。(E)蘇木精和伊紅橫截面圖��。(F)血管移植物中段的免疫熒光圖像。(G)用于體內評估的常見動物模型��。
4��、人工血管的未來挑戰(zhàn)
目前���,采用滌綸���、聚四氟乙烯、天然真絲等人造材料制備的大��、中口徑人工血管已廣泛應用于臨床�����,主要用于大血管置換術��、血管旁路移植術��、血液透析血管通路的建立等��。小口徑人工血管可用于外周血管替換��、動靜脈瘺建立以及心臟搭橋術等領域��,臨床應用范圍較廣�����。但迄今為止���,尚無小口徑人工血管上市��,其未能實現(xiàn)商業(yè)化的主要是受材料等因素的限制�����。
許多國內企業(yè)及科研院所逐漸將研發(fā)目光聚焦于小口徑人工血管產(chǎn)品及其材料���。該領域研發(fā)重點及難點主要在于,用于制備小口徑人工血管的材料(如聚氨酯材料���、組織工程材料等)性能仍有待提高�����,血液相容性及抗凝血性能不佳���,與血液接觸后會不同程度地產(chǎn)生纖維蛋白和血小板沉積��,從而導致血管管腔狹窄��,甚至造成血管閉塞�����。同時�����,由于小口徑人工血管中血流速度慢��、血壓低��,且現(xiàn)有材料無法較好支持血管內皮細胞黏附和生長��,人工血管植入體內后不能盡快內皮化�����,容易造成血管管腔狹窄、栓塞���,小口徑人工血管的遠期通暢率問題仍難以解決��。
文章整合來源:
1. Hu K, Li Y, Ke Z, et al. History, progress and future challenges of artificial blood vessels: a narrative review. Biomater Transl. 2022 Mar 28;3(1):81-98. doi: 10.12336/biomatertransl.2022.01.008. PMID: 35837341; PMCID: PMC9255792.
2. 關注 | 首個國產(chǎn)人工血管獲批上市. 中國食品藥品監(jiān)管雜志, 2022-11-21.
3. 一文了解:“以假亂真”的人工血管. 思宇MedTech, 2023-08-10.
4. Hu K, Li Y, Ke Z, et al. History, progress and future challenges of artificial blood vessels: a narrative review. Biomater Transl. 2022 Mar 28;3(1):81-98. doi: 10.12336/biomatertransl.2022.01.008. PMID: 35837341; PMCID: PMC9255792.
5. 醫(yī)療器械產(chǎn)品注冊技術審評報告
6. 淺析 | 人工血管市場需求廣闊��,高端材料國產(chǎn)化仍面臨挑戰(zhàn). 翔康醫(yī)學, 2022-09-12.