今日頭條
百利天恒雙抗ADC早期臨床積極�。百利天恒HER3/EGFR雙抗ADC產(chǎn)品BL-B01D1在ESMO2023大會上公布治療非小細(xì)胞肺癌(NSCLC)的I期研究數(shù)據(jù)。在102例可評估患者中�,BL-B01D1的總體客觀緩解率為51%�;EGFR突變型和EGFR野生型患者的中位無進(jìn)展生存期分別為5.6個月和5.4個月;中位緩解持續(xù)時(shí)間分別為8.5個月和未達(dá)到�。藥物耐受性良好,沒有患者出現(xiàn)間質(zhì)性肺疾?。↖LD)。
國內(nèi)藥訊
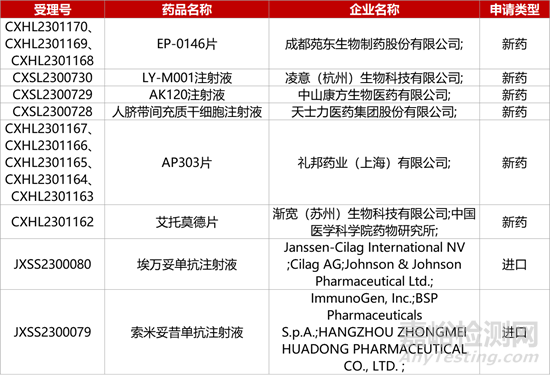
1.華東醫(yī)藥引進(jìn)FRα-ADC報(bào)產(chǎn)�。華東醫(yī)藥旗下中美華東制藥與ImmunoGen公司聯(lián)合開發(fā)的FRα-ADC新藥索米妥昔單抗注射液(IMGN853�、HDM2002)的上市申請獲CDE受理�,用于治療既往接受過1-3線系統(tǒng)性治療的葉酸受體α(FRα)陽性的鉑類耐藥的上皮性卵巢癌、輸卵管癌或原發(fā)性腹膜癌成年患者�。在關(guān)鍵臨床(SORAYA)中�,IMGN853單藥達(dá)到確認(rèn)的客觀緩解率為32.4%;中位緩解持續(xù)時(shí)間為6.9 個月。
2.石藥CLDN6/CD137雙抗獲批臨床�。石藥集團(tuán)基于其專有T細(xì)胞銜接器平臺NovaTE開發(fā)的CLDN6/CD137雙特異性抗體注射用NBL-028獲國家藥監(jiān)局批準(zhǔn)開展臨床研究�,單藥或聯(lián)合標(biāo)準(zhǔn)治療用于治療晚期惡性腫瘤,包括但不限于睪丸癌�、卵巢癌�、子宮內(nèi)膜癌�、胃肝樣腺癌/產(chǎn)AFP型胃癌等�。NBL-028在與TME中的腫瘤細(xì)胞表面CLDN6結(jié)合的同時(shí)�,選擇性地激活T細(xì)胞及其他免疫細(xì)胞中的CD137共激通路。今年8月�,該產(chǎn)品已在美國獲批臨床。
3.普眾發(fā)現(xiàn)CDH6-ADC報(bào)IND�。普眾發(fā)現(xiàn)1類生物制品注射用AMT-707(CUSP06)的臨床試驗(yàn)申請獲CDE受理�。AMT-707是一款靶向CDH6的抗體偶聯(lián)藥物(ADC),已在幾種CDH6高表達(dá)和低表達(dá)的體內(nèi)癌癥模型中顯示出良好的抗腫瘤活性�。2022年6月�,普眾發(fā)現(xiàn)與昂闊醫(yī)藥達(dá)成協(xié)議,授權(quán)昂闊醫(yī)藥在大中華區(qū)以外的全球范圍內(nèi)獨(dú)家開發(fā)和商業(yè)化CUSP06�。
4.百吉TCR-T報(bào)實(shí)體瘤IND。百吉生物1類生物制品BRL03注射液的臨床試驗(yàn)申請獲CDE受理�,擬開發(fā)用于治療多種晚期實(shí)體瘤(包括肺癌�、胃癌等)�。BRL03是一款基因修飾TCR-T細(xì)胞產(chǎn)品�,采用過繼性免疫細(xì)胞治療技術(shù),通過采集患者血液中的免疫細(xì)胞�,在體外進(jìn)行基因工程化改造�,增強(qiáng)T細(xì)胞對腫瘤細(xì)胞的特異性識別與殺傷效力。今年9月,該新藥已在美國獲批開展I/II期臨床。
5.恒瑞2023年前三季度總營收170億。10月25日�,恒瑞醫(yī)藥公布2023年第三季度報(bào)告�。今年1-9月�,恒瑞醫(yī)藥的營業(yè)收入為170.14億元�,同比增長6.7%�;歸母凈利潤為34.74億元�,同比增長9.47%�。今年第三季度,恒瑞醫(yī)藥的營業(yè)收入為58.45億元�,同比增長2.24%�;歸母凈利潤為11.66億元,同比增長10.57%�。研發(fā)費(fèi)用方面,2023年前三季度,公司研發(fā)費(fèi)用為37.25億元,同比上升6.52%�。
國際藥訊
1.艾伏尼布獲批治療骨髓增生異常綜合征。施維雅IDH1抑制劑艾伏尼布片(ivosidenib�,Tibsovo)獲FDA批準(zhǔn)用于治療IDH1突變的復(fù)發(fā)性或難治性骨髓增生異常綜合征(R/R MDS)。這是艾伏尼布在美國獲批的第4項(xiàng)適應(yīng)癥�。在I期研究(AG120-C-001)中,ivosidenib治療達(dá)到83.3%的客觀緩解和38.9%的完全緩解率�,中位總生存期(OS)為35.7個月�。
2.阿斯利康4價(jià)鼻噴流感疫苗報(bào)sBLA�。阿斯利康4價(jià)鼻噴流感疫苗FluMist Quadrivalent的生物制品許可補(bǔ)充申請(sBLA)獲FDA受理。這是一款減毒活疫苗�,以鼻噴劑的形式接種�,用于預(yù)防流感。在臨床研究中�,18歲以上的個體無需任何額外的指導(dǎo)就能夠自行接種FluMist Quadrivalent�,且有大量數(shù)據(jù)表明�,F(xiàn)luMist Quadrivalent的有效性和安全性與其他流感疫苗相當(dāng)�。如果獲批,F(xiàn)luMist Quadrivalent將成為首款可由患者自行接種或由護(hù)理人員接種的流感疫苗�。
3.創(chuàng)新TCR獲再生醫(yī)學(xué)先進(jìn)療法認(rèn)定�。Immatics公司TCR-T療法IMA203獲FDA授予再生醫(yī)學(xué)先進(jìn)療法(RMAT)認(rèn)定,用于治療多種復(fù)發(fā)性/難治性HLA-A*02:01陽性和PRAME表達(dá)的實(shí)體癌�。在Ⅰb期試驗(yàn)中,在包括皮膚黑色素瘤�、葡萄膜黑色素瘤、子宮內(nèi)膜癌�、滑膜肉瘤和卵巢癌等癌癥患者中�,第3個月確證的ORR達(dá)到67%。中位隨訪8.5個月時(shí)�,未達(dá)到中位緩解持續(xù)時(shí)間。此外�,藥物耐受性良好�。
4.渤健ASO療法早期AD臨床積極�。渤健/Ionis公司靶向tau蛋白的反義寡核苷酸(ASO)療法BIIB080(IONIS-MAPT)在治療輕度阿爾茨海默?。ˋD)的Ⅰb期試驗(yàn)結(jié)果積極。結(jié)果顯示�,BIIB080能劑量依賴性降低患者中腦脊液(CSF)中可溶性tau蛋白�;并在第100周時(shí),觀察到高劑量組患者的整體臨床癡呆評定量表總評分(CDR-SB)�、簡易精神狀態(tài)檢查(MMSE)認(rèn)知量表和功能活動問卷(FAQ)改善趨勢�。BIIB080總體耐受性良好�。
5.Alnylam公司RNAi療法AD早期臨床積極�。Alnylam公司RNAi療法ALN-APP治療阿爾茨海默病(AD)和腦淀粉樣血管?。–AA)的Ⅰ期臨床結(jié)果積極。數(shù)據(jù)顯示�,ALN-APP(75mg)單劑治療10個月時(shí)�,患者腦脊液(CSF)中可溶性APPα(sAPPα)和可溶性APPβ(sAPPβ)的最大降幅分別達(dá)到84%和90%;平均降幅分別為33%和39%�。探索性分析顯示�,接受治療2個月后,患者CSF中的Aβ42和Aβ40水平平均降低49%和71%�。
6.諾華2023年Q3超預(yù)期營收118億美元�。10月24日,諾華官網(wǎng)發(fā)布2023年第三季度季報(bào)�。第三季度全球凈銷售額達(dá)117.82億美元,同比增長12%�;核心營業(yè)收入44億美元,同比增長21%�;中國區(qū)凈銷售額為8.48億美元,同比增長14%�。三季度營收增長主要得益于CD20抗體Kesimpta(奧法妥木單抗)、Entresto(沙庫巴曲纈沙坦鈉)�、CDK4/6抑制劑Kisqali(瑞波西利)、核藥Pluvicto和Scemblix等多款產(chǎn)品的持續(xù)強(qiáng)勁增長�。
醫(yī)藥熱點(diǎn)
1.北京長峰醫(yī)院重大火災(zāi)事故調(diào)查報(bào)告公布�。日前�,國務(wù)院常務(wù)會議審議通過北京豐臺長峰醫(yī)院“4·18”重大火災(zāi)事故調(diào)查報(bào)告。這是一起因事發(fā)醫(yī)院違法違規(guī)實(shí)施改造工程�、施工安全管理不力、日常管理混亂、火災(zāi)隱患長期存在�,施工單位違規(guī)作業(yè)、現(xiàn)場安全管理缺失�,加之應(yīng)急處置不力�,地方黨委政府和有關(guān)部門職責(zé)不落實(shí)而導(dǎo)致的重大生產(chǎn)安全責(zé)任事故。目前�,北京長峰醫(yī)院股份有限公司法定代表人汪文杰�、北京長峰醫(yī)院院長王曉玲等20名涉案人員被立案偵查,其中19人已被檢察機(jī)關(guān)批準(zhǔn)逮捕。
2.南昌大學(xué)第四附屬醫(yī)院新班子公布�。10月25日�,南昌大學(xué)第四附屬醫(yī)院召開全體干部大會,宣布醫(yī)院領(lǐng)導(dǎo)干部任免的決定:程志紅同志任第四附屬醫(yī)院黨委書記�,馮珍同志任第四附屬醫(yī)院院長,管煒云同志任第四附屬醫(yī)院黨委委員�、副院長,陳天偉同志任第四臨床醫(yī)學(xué)院學(xué)生黨總支書記(副處級)�,免去宋琛同志第四附屬醫(yī)院副院長職務(wù)、柯華紅同志第四臨床醫(yī)學(xué)院學(xué)生黨總支書記(副處級)職務(wù)�。
3.強(qiáng)生任命新高管�。10月23日,強(qiáng)生宣布�,強(qiáng)生醫(yī)療科技全球負(fù)責(zé)人Ashley McEvoy即將離任,尋找外部機(jī)會�;現(xiàn)任強(qiáng)生醫(yī)療亞太負(fù)責(zé)人Tim Schmid將接替Ashley McEvoy�,成為新任醫(yī)療科技執(zhí)行副總裁兼全球董事長,并將加入公司執(zhí)行委員會�。Tim Schmid擁有加拿大西安大略大學(xué)本科學(xué)位和英國里士滿大學(xué)MBA學(xué)位�。Tim Schmid自1993年加入強(qiáng)生至今已工作30年,曾任強(qiáng)生歐洲�、中東和亞洲副總裁、強(qiáng)生第一大部門Ethicon總裁�、強(qiáng)生醫(yī)療首席戰(zhàn)略客戶官。
評審動態(tài)
1. CDE新藥受理情況(10月26日)
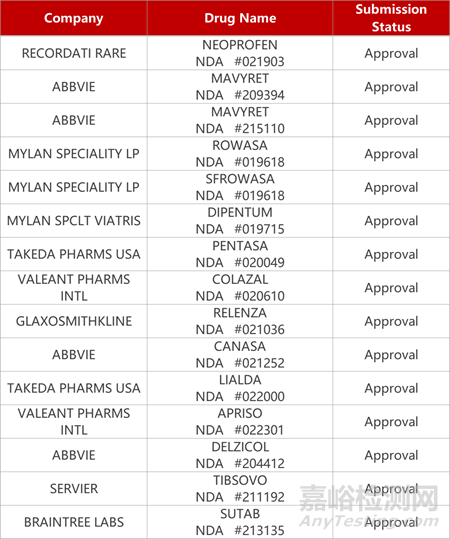
2. FDA新藥獲批情況(北美10月25日)