摘 要 / Abstract
2022 年8 月23 日,世界衛(wèi)生組織(WHO)宣布我國再次通過疫苗國家監(jiān)管體系評估�,為我國疫苗進入國際市場創(chuàng)造了良好的條件。疫苗作為控制傳染病最行之有效的措施����,WHO 及各國和地區(qū)都在積極提高疫苗接種率�,以最經(jīng)濟有效的方式挽救更多生命�。本文分析了疫苗國際市場采購數(shù)據(jù)及全球疫苗免疫聯(lián)盟的需求預(yù)測,對比了我國國內(nèi)市場數(shù)據(jù)與國際市場采購數(shù)據(jù)及通過WHO 資格預(yù)審的疫苗產(chǎn)品之間的差異性����,并分析了我國疫苗進入國際市場的機遇����。
On August 23, 2022, the World Health Organization (WHO) announced that China once again passed the evaluation of National Regulatory Authority for vaccines, creating favorable conditions for Chinese vaccines to enter the international market. As the most effective measure to control infectious diseases, vaccines are being actively promoted by the WHO and various countries to save more lives in a most cost-effective way. This article analyzes the data of vaccine procurement in the international market and the demand forecast by the Global Alliance for Vaccines and Immunization. It compares domestic market data with international procurement data and WHO-prequalified vaccine products, highlighting the opportunities that Chinese vaccine exports face in the international market.
關(guān) 鍵 詞 / Key words
疫苗���;資格預(yù)審(預(yù)認證)�;國際市場�;疫苗監(jiān)管體系
vaccines; pre-qualification; international market; vaccine regulatory system
1���、背 景
世界衛(wèi)生組織(World Health Organization,WHO)對國家監(jiān)管體系(National Regulatory Authority����,NRA)的疫苗質(zhì)量管理體系的評估,是體現(xiàn)國家對疫苗監(jiān)管能力的重要舉措和有效手段����,是一項全球范圍內(nèi)公認的�、可以科學(xué)全面評估一個國家疫苗監(jiān)管水平的國際考核���。我國疫苗監(jiān)管體系已于2011年����、2014 年、2022 年先后三次通過評估����,2022 年7 月迎來了WHO 升級評估標準后的新一輪全面評估����。此次評估指標大幅增加�、內(nèi)容更加全面���、標準更加嚴格。
我國通過NRA 評估�,不僅意味著我國擁有穩(wěn)定、運行良好且完整統(tǒng)一的監(jiān)管體系�,能確保在我國生產(chǎn)����、進口或流通的疫苗質(zhì)量可控、安全����、有效���, 也是我國疫苗出口全球的重要基礎(chǔ)。WHO 將通過NRA 評估作為采購該國疫苗產(chǎn)品的前提����,即只有通過NRA 評估,該國企業(yè)才能申請WHO 疫苗產(chǎn)品的資格預(yù)審���,并列入聯(lián)合國等國際組織采購清單����。此外���,通過NRA 評估也是其他國家注冊和采購他國疫苗產(chǎn)品的重要參考[1]。
2�、疫苗產(chǎn)品資格預(yù)審
2.1 資格預(yù)審目的及意義
WHO 的資格預(yù)審已經(jīng)成為國際社會保證醫(yī)藥制品質(zhì)量和安全的重要標準之一����。多數(shù)國際資助機構(gòu)都要求采購的藥品經(jīng)過WHO或者嚴格監(jiān)管機構(gòu)(Stringent Regulatory Authority����,SRA)的認證。對于疫苗產(chǎn)品,全球疫苗免疫聯(lián)盟(The Global Alliance for Vaccines and Immunisation����,GAVI) 和聯(lián)合國兒童基金會(United Nations International Children's Emergency Fund,UNICEF)只接受通過WHO 資格預(yù)審的疫苗[2]���。我國疫苗想要進入國際市場,需經(jīng)過WHO 的資格預(yù)審���。
藥品資格預(yù)審制度( Prequalification Team :medicines,PQTm)于2001 年建立�, 現(xiàn)稱為藥品資格預(yù)審(Prequalification of Medicines Programme,PQ)�, 亦稱為藥品預(yù)認證����,是指由WHO 牽頭�,由資格預(yù)審項目組負責(zé)具體任務(wù),審核范圍涵蓋制劑���、原料藥以及藥品檢驗實驗室����,并以資格預(yù)審藥品目錄為依托的聯(lián)合國行動計劃����。該項目旨在通過對藥品注冊資料的評審�、生產(chǎn)現(xiàn)場的檢查和提高企業(yè)的藥品生產(chǎn)及監(jiān)管能力,在全球范圍內(nèi)提高患者對于亟待治療和預(yù)防疾病藥物的可及性����,同時保障這些藥品的質(zhì)量[3]。
2.2 資格預(yù)審申請條件
申請WHO 資格預(yù)審的疫苗必須滿足以下條件:① NRA 必須具備監(jiān)管職能并持續(xù)保持該能力���, 即NRA 必須通過WHO 對質(zhì)量管理體系的評估和再評估。②資格預(yù)審的疫苗需要得到生產(chǎn)國和地區(qū)NRA 的批準����。③相關(guān)疫苗的技術(shù)指南或科學(xué)建議已經(jīng)以《 WHO 技術(shù)報告系列》(WHO Technical Report Series���,TRS)的形式得到批準和公布���,即資格預(yù)審疫苗的科學(xué)審評將以TRS 報告作為重要的科學(xué)依據(jù)�。WHO對于急需的疫苗可以緊急起草相關(guān)技術(shù)指南。④ 提出申請的疫苗須為WHO 優(yōu)先采購目錄中列入的疫苗[4]。
2.3 資格預(yù)審程序
疫苗資格預(yù)審包括兩種程序:常規(guī)程序和簡化程序�,其中,簡化程序適用于通過SRA 批準的藥物����。截至目前���,SRA 指定名單僅更新至2015 年10 月23 日,目前我國尚不在其中���,簡化程序還不適用于我國[5]�。
WHO 對疫苗資格預(yù)審的常規(guī)程序:疫苗企業(yè)提出申請���,WHO 給予受理或不受理的初步反饋;已獲受理的申報單位向 WHO 提交產(chǎn)品摘要文件(product summary file,PSF)����,WHO 對文件進行科學(xué)審評����;一旦PSF 被接受���,WHO 將要求申報單位進行3~5 批疫苗樣品的送檢�,該項檢驗由WHO 指定的合作實驗室進行����;當(dāng) PSF 評估和樣品檢驗完成后�,WHO 將組織對申報單位的生產(chǎn)現(xiàn)場進行GMP檢查。在上述流程通過后����,WHO會給聯(lián)合國相關(guān)機構(gòu)GAVI 和UNICEF 發(fā)送資格預(yù)審?fù)ㄟ^的確認信����。在獲得疫苗資格預(yù)審許可后,WHO 還會對生產(chǎn)企業(yè)進行持續(xù)追蹤����,包括產(chǎn)品和生產(chǎn)工藝的變更評價、資格預(yù)審?fù)ㄟ^后質(zhì)量及安全性的監(jiān)測等環(huán)節(jié)���。通過資格預(yù)審的生產(chǎn)企業(yè)需每年向WHO 提供年度報告[4]。
3���、全球免疫計劃與疫苗市場分析
通過研究WHO 戰(zhàn)略發(fā)展方向�、市場需求預(yù)測和近幾年市場采購量,可以進一步了解和提升各類疫苗全球市場未來的增長空間���。
3.1 全球免疫計劃
2005 年,WHO 與UNICEF共同起草了《2006~2015 年全球免疫遠景與戰(zhàn)略》����,旨在提高疫苗接種覆蓋率,降低死亡率和發(fā)病率���,實現(xiàn)了首個10 年戰(zhàn)略計劃[6]����。
2012 年���,第六十五屆世界衛(wèi)生大會通過了“全球疫苗行動計劃” 決議, 確定了2010~2020年充分實現(xiàn)免疫接種的10 年戰(zhàn)略框架�。該戰(zhàn)略框架提出2015年和2020 年的具體目標���,其中2020 年具體目標包括:至2018年消滅脊髓灰質(zhì)炎至實現(xiàn)全球無脊髓灰質(zhì)炎狀態(tài)�;在至少5 個WHO 區(qū)域內(nèi)消除麻疹和風(fēng)疹���;國家免疫規(guī)劃疫苗接種率達到90%,區(qū)域內(nèi)達到80% ���;在低收入和中等收入國家推出一種或更多新疫苗或未得到充分利用的疫苗等具體目標[7]。
WHO 在“全球疫苗行動計劃”之后����,又批準了針對特定疾病的具體目標�,包括至2030 年使慢性乙型病毒性肝炎新病例減少95% ����;媒介傳播的乙型腦炎發(fā)病率降低至少60%����,死亡率降低至少75% ����;消除腦膜炎在各國和地區(qū)的流行;使因狂犬病而死亡的人數(shù)減少至零等具體目標[8]����。
2019 年����,隨著“全球疫苗行動計劃”接近尾聲���,WHO 免疫戰(zhàn)略咨詢專家組回顧了疫苗10 年的工作進展。在尚未實現(xiàn)的目標中���,關(guān)于實現(xiàn)全球無脊髓灰質(zhì)炎的工作仍然面臨挑戰(zhàn)�,衍生的脊髓灰質(zhì)炎病毒還在一些國家和地區(qū)傳播����;消除麻疹的目標雖然多國和地區(qū)已做了很多努力���,但麻疹病毒依然在全球范圍內(nèi)進行傳播���,且接種第一劑麻疹疫苗的全球覆蓋率約為86%����,目前尚無法實現(xiàn)消除目標;關(guān)于2020 年至少5 個區(qū)域內(nèi)消除風(fēng)疹和先天性風(fēng)疹綜合征的目標目前也無法實現(xiàn)���;在全球疫苗接種率方面,許多疫苗的覆蓋率都有所提高�,但尚未達到90% 覆蓋率的目標[9]。
2020 年 8 月���,第七十三屆世界衛(wèi)生大會采用書面默許程序,通過了 WHA73(9)號決定�,其中批準了《2030 年免疫議程》���。該議程提供了戰(zhàn)略框架���,以應(yīng)對2021~2030 年初級衛(wèi)生保健和全民健康覆蓋范圍內(nèi)與免疫接種有關(guān)的關(guān)鍵問題[10]���。
2021 年5 月14 日����,WHO發(fā)布的《實施2030 年免疫議程:通過協(xié)調(diào)一致的計劃、監(jiān)測與評價����、自主與問責(zé)以及溝通與宣傳建立行動框架》中制定����,3 個目標[11] 分別為:①預(yù)防疾病����,挽救生命���,降低死亡率和發(fā)生率����。通過接種疫苗來減少疾病的死亡率���,包括乙型肝炎疫苗����、b 型流感嗜血桿菌疫苗�、人乳頭瘤病毒疫苗����、乙型腦炎疫苗�、麻疹疫苗、A 群腦膜炎疫苗����、肺炎鏈球菌疫苗�、輪狀病毒疫苗、風(fēng)疹疫苗、黃熱病疫苗����、白喉疫苗����、破傷風(fēng)疫苗、百日咳疫苗����、卡介苗�,至2030 年在全球范圍內(nèi)避免5000萬人死亡;根除脊髓灰質(zhì)炎�,消除麻疹����、風(fēng)疹傳播,作為公共衛(wèi)生問題消除人乳頭瘤病毒�、孕產(chǎn)婦和新生兒破傷風(fēng)�、乙型肝炎,控制乙型腦炎���;大規(guī)?;蚱茐男砸咔榈谋┌l(fā)呈下降趨勢���。②增加新疫苗和現(xiàn)有疫苗的公平使用,減少零劑接種兒童數(shù)量����,至2030 年零劑接種兒童數(shù)量減少50%����, 在低收入和中等收入國家引進新疫苗或未充分利用的疫苗,包括:出生首劑乙型肝炎疫苗����、b 型流感嗜血桿菌疫苗����、人乳頭瘤病毒疫苗、第二劑滅活脊髓灰質(zhì)炎疫苗����、第二劑麻疹疫苗、肺炎球菌結(jié)合疫苗����、輪狀病毒疫苗����、風(fēng)疹疫苗、加強用百白破疫苗���、新冠病毒疫苗���、乙型腦炎疫苗���、黃熱病疫苗�、A 群腦膜炎疫苗����、多價腦膜炎疫苗���、傷寒疫苗���、霍亂疫苗、登革熱疫苗���、狂犬病疫苗�、甲型肝炎疫苗、流感疫苗����、水痘疫苗和腮腺炎疫苗����。瘧疾和其他相關(guān)疫苗在未來行動建議中可能會被列入。③為提高全球疫苗覆蓋率�,建立疫苗強化接種計劃���,至2030 年���,第三劑百白破疫苗、第二劑麻疹疫苗����、第三劑肺炎球菌結(jié)合疫苗和人乳頭瘤病毒疫苗(完整系列)全球覆蓋率達到90%。
3.2 疫苗資格預(yù)審優(yōu)先級
WHO 為支持各國和地區(qū)免疫規(guī)劃目標的實現(xiàn)���,制定了疫苗資格預(yù)審的優(yōu)先級,優(yōu)先級共分為四級����,包括高、中����、低和非優(yōu)先級���,且每兩年更新一次����。UNICEF 和泛美衛(wèi)生組織均采用優(yōu)先級清單進行采購����。該清單的制定原則主要包括聯(lián)合國市場需求���,適用于WHO 免疫規(guī)劃需要�,采用WHO免疫戰(zhàn)略咨詢專家組的建議和供應(yīng)安全[12]����。本文列舉了WHO 網(wǎng)站公布的最新疫苗資格預(yù)審優(yōu)先級清單(2018~2020 年),詳見表1。
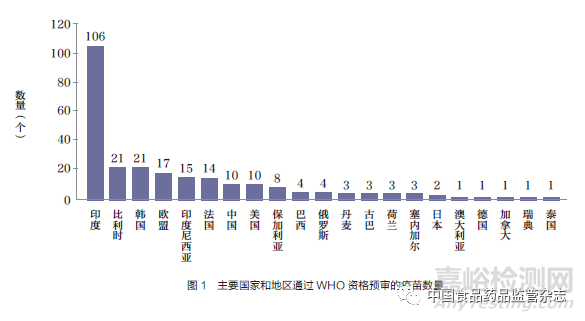
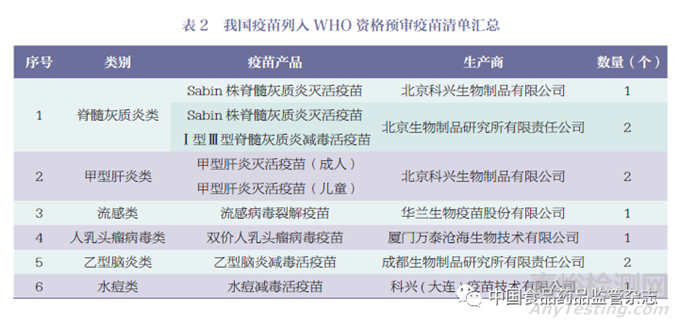
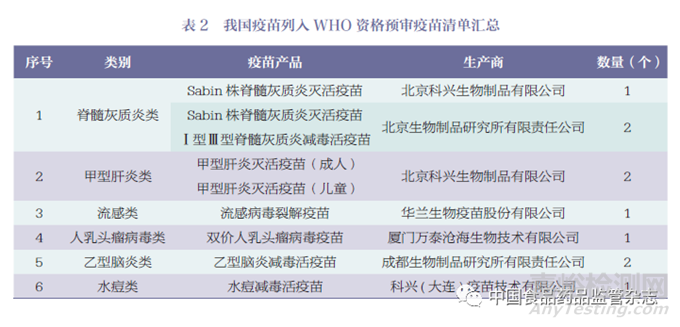
據(jù)WHO 官網(wǎng)顯示[13]���,數(shù)據(jù)查詢截至2023 年5 月15 日���,列入資格預(yù)審疫苗清單的疫苗共計249 個疫苗產(chǎn)品���,其中印度106個疫苗產(chǎn)品(占43%)����、比利時21 個疫苗產(chǎn)品(占8%)����、韓國21 個疫苗產(chǎn)品(占8%)位列榜單前三位�,疫苗產(chǎn)品數(shù)量合計占比超過清單中總數(shù)量的59%�。截至目前我國通過WHO 資格預(yù)審的僅有10 個疫苗產(chǎn)品(占4%)���。主要國家和地區(qū)通過WHO 資格預(yù)審的疫苗數(shù)量情況如圖1 所示。我國通過WHO 資格預(yù)審的疫苗產(chǎn)品����,詳見表2����。
3.3 GAVI 基本需求預(yù)測
2021 年����,GAVI 第五版疫苗基本需求預(yù)測, 涵蓋了2021~2030 年GAVI 支持的74個國家和地區(qū)疫苗基本需求[14]�?;拘枨箢A(yù)測表,詳見表3�。
GAVI 基本需求預(yù)測表中共有12 種疫苗�,其中肺炎球菌結(jié)合疫苗、人乳頭瘤病毒疫苗���、麻疹-風(fēng)疹疫苗�、滅活脊髓灰質(zhì)炎疫苗���、輪狀病毒疫苗���、傷寒結(jié)合疫苗和黃熱病疫苗均屬于高優(yōu)先級疫苗����,麻疹疫苗屬于中優(yōu)先級疫苗����。高����、中優(yōu)先級疫苗在GAVI 基本需求預(yù)測表中占2/3,說明WHO 通過免疫規(guī)劃目標所提出的高����、中優(yōu)先級可以反映市場采購量需求����,此類疫苗未來的市場值得關(guān)注�。
在上述預(yù)測表中�,2021~2030年���,肺炎球菌結(jié)合疫苗每年保持2 億多劑的市場需求���,共計需求21 億多劑�;麻疹- 風(fēng)疹疫苗每年需求量雖有起伏,但預(yù)測總計在23 億多劑�;與麻疹-風(fēng)疹疫苗相比���,麻疹疫苗的需求量相對較少���,近5.9 億劑;輪狀病毒疫苗需求量呈上升趨勢���,共計17 億多劑;人乳頭瘤病毒疫苗需求量整體趨勢向上,共計4.7 億多劑���;根除脊髓灰質(zhì)炎一直是WHO 及各國和地區(qū)努力的方向,滅活脊髓灰質(zhì)炎疫苗需求量約為8.1 億劑�,需求量雖高,但根據(jù)預(yù)測情況2024 年開始呈下降趨勢���;傷寒結(jié)合疫苗在2026 年需求量達到最大,共計8.5 億多劑�;A 群腦膜炎球菌疫苗和黃熱病疫苗需求量分別為3.1 億多劑和7.3 億多劑。
除此之外�,未列入WHO 高�、中優(yōu)先級的疫苗品種,六聯(lián)疫苗在2024 年需求量開始增長�;百白破- 乙型肝炎-b 型流感嗜血桿菌聯(lián)合疫苗雖未在高���、中優(yōu)先級,但10 年需求量在20 億多劑����;乙型腦炎疫苗雖屬于低優(yōu)先級,需求量也在4.7 億多劑����。
3.4全球疫苗市場采購分析
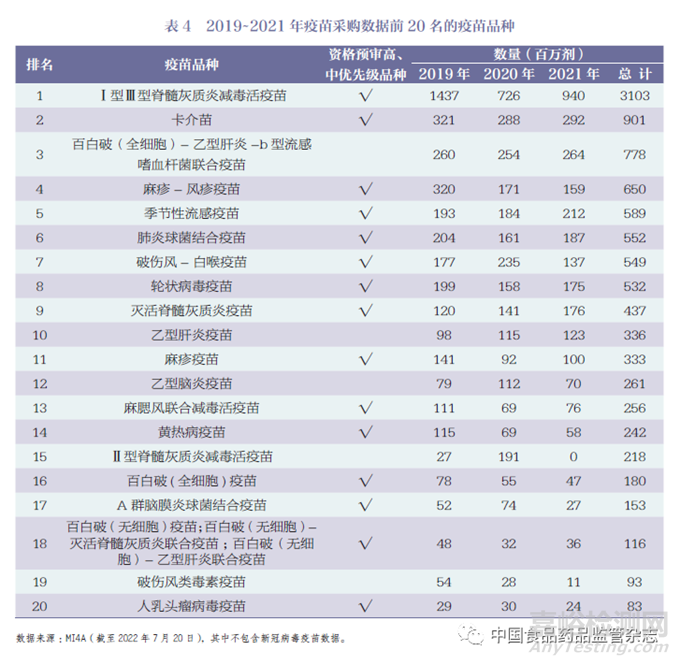
WHO MI4A(Market Information for Access) 發(fā)布的疫苗采購數(shù)據(jù)包含150 多個國家和地區(qū)通過WHO、UNICEF報告的疫苗采購信息����,數(shù)據(jù)顯示2019~2021 年疫苗采購前20 名疫苗產(chǎn)品���,詳見表4[15]����。
通過采購數(shù)據(jù)分析, Ⅰ型Ⅲ型脊髓灰質(zhì)炎減毒活疫苗�、卡介苗和百白破(全細胞)- 乙型肝炎-b 型流感嗜血桿菌聯(lián)合疫苗為采購量前三的疫苗品種����。采購量前20 名中屬于高、中優(yōu)先級的產(chǎn)品共有15 種���,占75%,由此可見���,WHO 資格預(yù)審疫苗的優(yōu)先級順序同時反映了市場需求���。
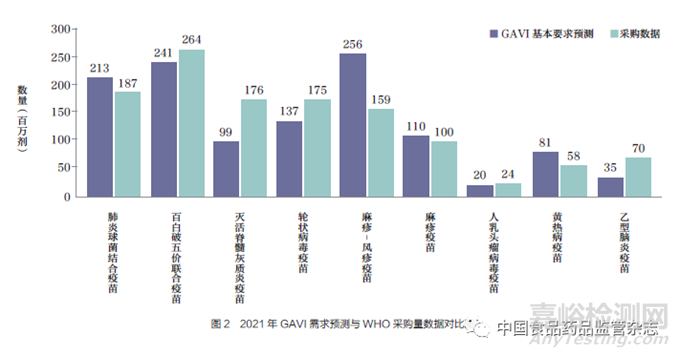
對比WHO 實際采購的疫苗產(chǎn)品與GAVI 基本需求預(yù)測表中的疫苗類型,需求預(yù)測表的12 種疫苗產(chǎn)品中共有9 種位于采購量的前20 名���。以2021 年為例,百白破( 全細胞)- 乙型肝炎-b 型流感嗜血桿菌疫苗(百白破五價聯(lián)合疫苗)���、肺炎球菌結(jié)合疫苗�、麻疹疫苗和人乳頭瘤病毒疫苗這4 類疫苗的需求量和采購數(shù)據(jù)基本一致���。輪狀病毒疫苗、滅活脊髓灰質(zhì)炎疫苗和乙型腦炎疫苗實際采購量比預(yù)測量增加���, 相反麻疹- 風(fēng)疹疫苗和黃熱病疫苗的采購量未達到預(yù)期����,如圖2所示。
除此之外�,根據(jù)WHO 的建議,麻疹- 風(fēng)疹疫苗和麻腮風(fēng)聯(lián)合減毒活疫苗在常規(guī)免疫計劃將逐步取代單價麻疹疫苗,未來單價麻疹疫苗的市場預(yù)計將減少[16]���。關(guān)于人乳頭瘤病毒疫苗,2020 年���,世界衛(wèi)生大會宣布了加速消除宮頸癌全球戰(zhàn)略���。在未來10 年內(nèi)�,將在低收入和中等收入國家和地區(qū)進行大量投資,并改進免疫規(guī)劃活動����,實現(xiàn)90% 的覆蓋率目標���。人乳頭瘤病毒疫苗在獲得首次上市許可后的第16 年����,WHO的60% 成員國已將人乳頭瘤病毒疫苗納入了國家常規(guī)免疫計劃[17]�。由此推斷�,未來人乳頭瘤病毒疫苗市場將會有較大增長����。
新冠病毒疫苗作為2021 年和2022 年市場上的重要疫苗產(chǎn)品���,根據(jù)WHO 成員國報告的新冠病毒疫苗采購數(shù)據(jù)中可以看出,2021 年采購了18 億劑����、2022年共采購46 億劑[18]���。
4�、我國疫苗市場分析及機遇
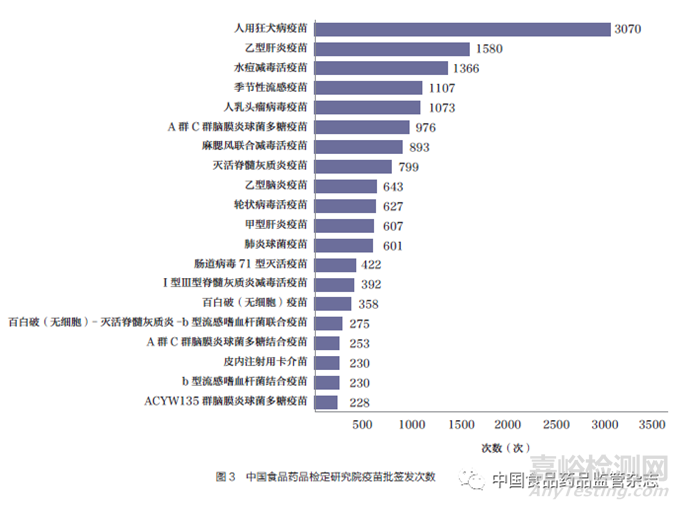
根據(jù)中國食品藥品檢定研究院在網(wǎng)站上公示的批簽發(fā)疫苗數(shù)據(jù)(數(shù)據(jù)查詢截至2023 年5 月15日)�,2020 年1 月6 日~2023 年5 月7 日公布的批簽發(fā)次數(shù)中前5項分別為人用狂犬病疫苗���、乙型肝炎疫苗�、水痘減毒活疫苗�、季節(jié)性流感疫苗和人乳頭瘤病毒疫苗[19]���,如圖3 所示�。
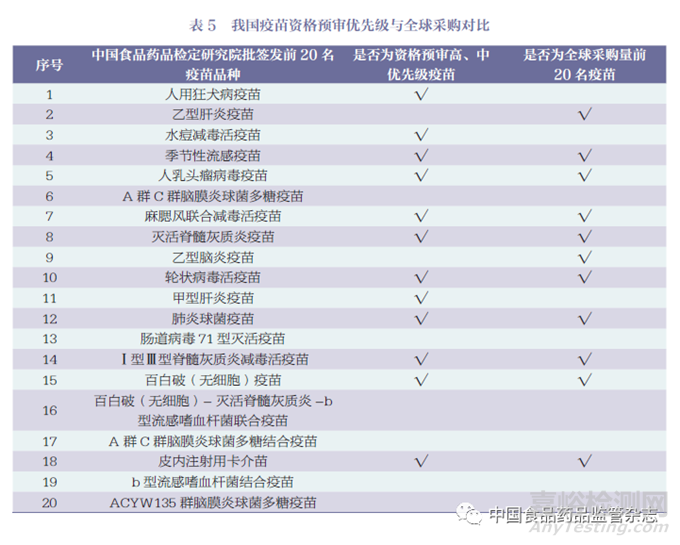
將中國食品藥品檢定研究院批簽發(fā)前20 名疫苗與全球采購數(shù)據(jù)及WHO 資格預(yù)審高����、中優(yōu)先級疫苗進行比對�,結(jié)果表明季節(jié)性流感疫苗、麻腮風(fēng)聯(lián)合減毒活疫苗����、人乳頭瘤病毒疫苗���、滅活脊髓灰質(zhì)炎疫苗�、輪狀病毒活疫苗�、肺炎球菌疫苗����、百白破(無細胞)疫苗、Ⅰ型Ⅲ型脊髓灰質(zhì)炎減毒活疫苗和皮內(nèi)注射用卡介苗等均屬于高����、中優(yōu)先級疫苗,且均位列全球采購量前20 名����,說明我國市場成熟疫苗在國際市場也具有巨大發(fā)展空間,值得我國疫苗生產(chǎn)企業(yè)的關(guān)注����,詳見表5。
根據(jù)國家藥監(jiān)局網(wǎng)站上公布的信息顯示(數(shù)據(jù)查詢截至2023年5 月15 日)����,我國已注冊的疫苗共327 個產(chǎn)品����,但通過資格預(yù)審的疫苗僅有10 個產(chǎn)品。我國是全球疫苗企業(yè)最多的疫苗生產(chǎn)國�,國家藥監(jiān)局網(wǎng)站顯示獲得注冊的疫苗產(chǎn)品共涉及50 余家疫苗相關(guān)生產(chǎn)企業(yè)����,是全球為數(shù)不多的能夠依靠自身能力解決全部計劃免疫疫苗的國家和地區(qū)之一,應(yīng)有能力面對更加廣闊的國際市場����。提高我國疫苗在國際市場的占有率,需要我國疫苗生產(chǎn)企業(yè)付出更多的努力[20]����。
2019 年12 月1 日,《疫苗管理法》正式實施����,第九十八條規(guī)定:“國家鼓勵疫苗生產(chǎn)企業(yè)按照國際采購要求生產(chǎn)����、出口疫苗���。出口的疫苗應(yīng)當(dāng)符合進口國(地區(qū))的標準或者合同要求”[21]。如今���,我國疫苗監(jiān)管體系再次通過NRA 評估���,我國疫苗國際化也面臨前所未有的機遇。在進一步優(yōu)化疫苗產(chǎn)業(yè)鏈供應(yīng)鏈的關(guān)鍵環(huán)節(jié)方面����,建議可通過借鑒先進的NRA 監(jiān)管經(jīng)驗����,例如建立“僅供出口”疫苗審評審批的獨立專用通道[22]�,必將加速暢通我國疫苗出口路徑����,激勵我國更多企業(yè)依靠其產(chǎn)能優(yōu)勢走出國門����。隨著我國疫苗供應(yīng)鏈服務(wù)的不斷完善和質(zhì)量提升,可以更快地為全球更多的國家和地區(qū)提供安全���、有效、質(zhì)量可控的疫苗���。疫苗作為公共產(chǎn)品將更好地助力全球公共健康事業(yè)的發(fā)展�。