今日頭條
綠葉老年癡呆新藥獲批上市���。綠葉制藥利斯的明透皮貼劑(2次/W)獲國家藥監(jiān)局批準上市,用于治療輕���、中度阿爾茨海默病的癥狀。這是綠葉旗下Luye Pharma公司通過透皮釋藥技術(shù)平臺自主研發(fā)的一款利斯的明改良貼劑���,一周兩次���、經(jīng)皮膚給藥���,可有效降低惡心���、嘔吐等腸胃不良反應的發(fā)生率。此前該藥已在歐洲多個國家和地區(qū)獲得上市許可���。金賽藥業(yè)擁有該新藥在中國大陸的商業(yè)化權(quán)利���。
國內(nèi)藥訊
1.優(yōu)時比FcRn單抗中國報產(chǎn)���。優(yōu)時比FcRn單抗羅澤利昔珠單抗(rozanolixizumab)注射液上市申請獲CDE受理���,用于治療全身型重癥肌無力(gMG)���。rozanolixizumab可抑制FcRn與IgG的結(jié)合���,然后非結(jié)合狀態(tài)的IgG會被溶酶體降解���,進而降低自身免疫性和同種免疫性疾病中致病性IgG水平。在III期MycarinG研究中���,rozanolixizumab較安慰劑顯著降低患者日?��;顒佣龋∕G-ADL)評分,兩組患者MG-ADL評分分別降低3.4分和0.8分���。
2.復宏漢霖PD-1單抗肺癌Ⅲ期臨床積極。復宏漢霖PD-1抑制劑斯魯利單抗(漢斯狀)聯(lián)合化療一線治療晚期非鱗狀非小細胞肺癌(NSCLC)的Ⅲ期ASTRUM-002研究達到主要終點���。根據(jù)IRRC評估���,與安慰劑聯(lián)合化療相比���,斯魯利單抗聯(lián)合化療顯著提高患者的無進展生存期(PFS)���,藥物安全性良好,未觀察到新的安全性信號���。目前,該新藥已獲批用于治療MSI-H實體瘤���、鱗狀NSCLC���、廣泛期小細胞肺癌和食管鱗狀細胞癌。
3.百利天恒HER3/EGFR雙抗ADC上III期臨床���。百利天恒HER3/EGFR雙抗ADC新藥BL-B01D1登記啟動一項III期臨床,在既往經(jīng)PD-1/PD-L1單抗治療且經(jīng)至少兩線化療(至少一線含鉑)治療失敗的復發(fā)性或轉(zhuǎn)移性鼻咽癌(NPC)患者中對比BL-B01D1與醫(yī)生選擇的化療方案(末線)的有效性與安全性���。該項研究主要研究者由中山大學腫瘤防治中心醫(yī)學博士張力擔任���。在I期研究中,BL-B01D1治療NPC達到ORR為45.8%���,疾病控制率(DCR)為100%���。
4.勁方CDK9抑制劑獲快速通道資格���。勁方醫(yī)藥CDK9抑制劑SLS009(GFH009)獲FDA授予快速通道資格���,用于治療復發(fā)/難治性成人外周T細胞淋巴瘤(PTCL)患者���。在Ⅰ期試驗中���,GFH009可使PTCL等血液腫瘤患者體內(nèi)MYC、MCL1等原癌基因表達顯著降低至期望水平���,其中4例PTCL患者(36.4%)觀察到臨床療效���。SELLAS生命科學集團擁有GFH009在大中華區(qū)外的全球開發(fā)和商業(yè)化授權(quán)。
5.樂普EGFR靶向ADC美國獲批臨床���。樂普生物自研EGFR靶向ADC新藥MRG003獲FDA臨床試驗許可���,擬開發(fā)用于治療晚期鼻咽癌(NPC)及晚期頭頸鱗癌(HNSCC)。樂普生物近期在ESMO2023會議上公布的MRG003用于治療HNSCC的Ⅱ期臨床���,以及治療NPC的IIa期臨床積極結(jié)果���。在IIa期臨床中,MRG003(2.0mg/kg和2.3mg/kg)的ORR分別為39.3%和55.2%,DCR分別為71.4%和86.2%���。此前���,MRG003用于NPC適應癥已獲FDA授予孤兒藥資格。
6.科霸LILRB2/PD-L1雙抗獲批臨床���。科霸生物自主研發(fā)的LILRB2/PD-L1雙抗SPX-303獲FDA批準開展Ⅰ期臨床���,評估用于治療晚期或難治性實體瘤的安全性、藥物動力學特性與初步療效���,并探索其作為免疫抗腫瘤創(chuàng)新療法的藥理和分子機制。SPX-303同時阻斷人體免疫系統(tǒng)的兩個關(guān)鍵免疫檢查點LILRB2和PD-L1���,從而使免疫系統(tǒng)能夠更高效地鑒別并有效地清除惡性腫瘤細胞���。
國際藥訊
1.II型RAF抑制劑報兒童膠質(zhì)瘤NDA。Day One公司高腦滲透性II型RAF抑制劑Tovorafenib的上市申請獲FDA受理���,單藥用于治療復發(fā)或進展型兒科低級別膠質(zhì)瘤(pLGG)���,PDUFA日期為明年4月30日。Tovorafenib能夠抑制攜帶BRAF融合或BRAF V600突變的腫瘤的生長���。在關(guān)鍵II期研究中���,tovorafenib單藥達到67%總緩解率���,臨床獲益率為93%���,緩解持續(xù)時間尚未達到(95% CI:9.0個月,NE)���。
2.創(chuàng)新CXCR4拮抗劑獲優(yōu)先審評資格���。X4 Pharmaceuticals公司CXCR4拮抗劑mavorixafor的新藥申請(NDA)獲FDA受理,用于治療12歲及以上WHIM綜合癥患者���。FDA同時授予其優(yōu)先審評資格���,PDUFA日期為2024年4月30日���。在Ⅲ期臨床4WHIM中,與安慰劑相比���,mavorixafor顯著改善患者TATANC值(24小時內(nèi)維持中性粒細胞數(shù)大于500個細胞/微升的時間)���,兩組平均TATANC分別為15.04小時與2.75小時(P<0.0001)。
3.輝瑞流感mRNA疫苗Ⅲ期臨床積極���。輝瑞與BioNTech開發(fā)的流感mRNA疫苗modFlu(PF-07252220)在預防流感的Ⅲ期試驗中獲積極結(jié)果���。在18至64歲隊列中,與上市的流感疫苗相比���,PF-07252220的有效性達到非劣效性與優(yōu)效性標準���;但在次要免疫原性療效終點方面,該疫苗僅針對甲型流感病毒株(而非乙型流感病毒株)達到次要終點���。此外���,疫苗的安全性良好。
4.創(chuàng)新TCR-T療法滑膜肉瘤關(guān)鍵臨床積極���。Adaptimmune公司靶向NY-ESO-1抗原的TCR-T產(chǎn)品lete-cel在治療滑膜肉瘤或黏液樣/圓細胞脂肪肉瘤(MRCLS)經(jīng)治患者的關(guān)鍵IGNYTE-ESO研究達到主要終點���。中期分析顯示,獨立審評評估的總體緩解率達到40%(99.6% CI:20.3%-62.3%)���,其中23例滑膜肉瘤患者中的9例(39%)和22例MRCLS患者中的9例(41%)顯示緩解���。中位緩解持續(xù)時間為10.6個月。安全性結(jié)果與已知研究一致���。
5.Mersana公司重啟HER2-ADC臨床���。FDA解除對Mersana公司/葛蘭素史克開發(fā)的靶向HER2新表位的STING激動型ADC藥物XMT-2056的Ⅰ期臨床暫停。此前SAE發(fā)生在第2例患者身上���,該患者是HER2+���、復發(fā)性或轉(zhuǎn)移性實體腫瘤經(jīng)治患者,在Ⅰ期試驗的劑量遞增部分以初始劑量水平入組���。Mersana公司表示將降低Ⅰ期劑量遞增設計的起始劑量���。
6.禮來購進心血管疾病基因編輯項目選擇權(quán)���。禮來與Verve公司就后者靶向Lp(a)的體內(nèi)基因編輯項目擴展合作協(xié)議���,獲得該項目(包括針對PCSK9���、ANGPTL3和未公開的肝臟介導的心血管靶點項目)選擇權(quán)���。此前���,Verve與Beam達成戰(zhàn)略合作���,利用Beam專有的堿基編輯技術(shù)���,聯(lián)合開發(fā)針對心血管靶點的基因療法���。目前���,Verve已與Beam修訂合作協(xié)議���,并與禮來擴展合作���,禮來將持有之前由Beam持有的產(chǎn)品權(quán)(PCSK9和ANGPTL3候選產(chǎn)品)���,以及第三個未披露的心血管疾病靶點項目的選擇權(quán)。
醫(yī)藥熱點
1.GSK中國最新人事變動���。10月26日,葛蘭素史克(GSK)中國特藥業(yè)務負責人余錦毅宣布���,趙亮將擔任特藥事業(yè)部多渠道客戶互動負責人���,全面負責特藥事業(yè)部倍力騰���、新可來產(chǎn)品組在目標市場的醫(yī)保政策落地執(zhí)行策略。這項任命自11月1日起生效���。趙亮曾任職于拜耳���、楊森制藥,2010年加入GSK���,現(xiàn)任GSK中國呼吸業(yè)務部區(qū)域總監(jiān)。
2.第三批鼓勵仿制藥品建議目錄公示���。10月30日,國家衛(wèi)健委藥物政策與基本藥物制度司發(fā)布《關(guān)于第三批鼓勵仿制藥品建議目錄的公示》���。為落實國務院辦公廳《關(guān)于改革完善仿制藥供應保障及使用政策的意見》有關(guān)制定仿制藥品目錄的部署和要求���,2023年,國家衛(wèi)健委���、工信部等多部門組織專家對國內(nèi)專利即將到期尚未提出注冊申請及臨床供應短缺(競爭不充分)的藥品進行遴選論證���,共有貝美替尼、伏環(huán)孢素���、氯巴占等41種藥物入選《第三批鼓勵仿制藥品建議目錄》,涉及抗腫瘤、罕見病治療等治療領域���。
3.福建醫(yī)保基金飛檢啟動���。近日,2023年國家醫(yī)療保障基金第20次飛行檢查啟動會在福建廈門召開���。根據(jù)國家醫(yī)保局部署���,由河北省醫(yī)保局���、財政廳���、衛(wèi)健委組成的飛行檢查組���,將對廈門2家定點醫(yī)療機構(gòu)���、1家定點零售藥店及市醫(yī)保中心���,開展為期10天左右的檢查���。此次飛檢聚焦醫(yī)學影像檢查���、臨床檢驗、康復3個重點領域���,檢查范圍為2021年1月1日至2022年12月31日期間醫(yī)保基金使用和管理情況���。
評審動態(tài)
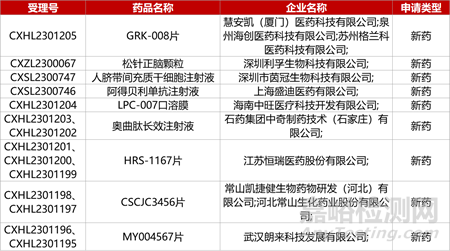
1. CDE新藥受理情況(11月01日)
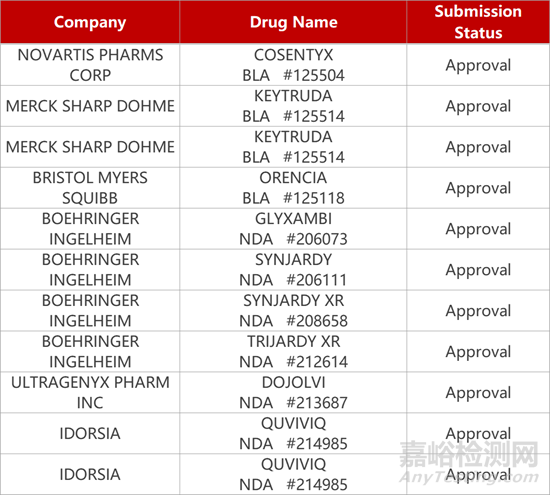
2. FDA新藥獲批情況(北美10月30日)