摘要
目的:通過分析中藥注冊(cè)分類政策的歷史變革過程����,為新形勢下中藥注冊(cè)分類管理制度和審評(píng)審批技術(shù)評(píng)價(jià)體系的繼續(xù)改革和完善提供思路����。方法:運(yùn)用多源流理論模型��,從問題源流�、政策源流、政治源流3個(gè)方面分析我國中藥注冊(cè)分類管理制度的政策演變過程��,說明中藥注冊(cè)分類制度改革和建立并完善遵循中藥發(fā)展規(guī)律的審評(píng)審批技術(shù)評(píng)價(jià)體系的重要性及必要性��。結(jié)果與結(jié)論:注冊(cè)分類作為中藥注冊(cè)管理制度的核心內(nèi)容�,直接關(guān)系到中藥未來的研發(fā)注冊(cè)和創(chuàng)新趨勢。結(jié)合中藥注冊(cè)審批的實(shí)際情況��,針對(duì)上市中藥審評(píng)核查資源有限等現(xiàn)實(shí)挑戰(zhàn)����,建議國家相關(guān)部門、政策企業(yè)家等多方主體加強(qiáng)配合�,進(jìn)一步推進(jìn)中藥注冊(cè)分類制度的改革和完善,促進(jìn)中藥研發(fā)和創(chuàng)新�。
藥品注冊(cè)分類制度是國家藥品監(jiān)督管理部門根據(jù)藥品的特點(diǎn)及其屬性所規(guī)劃的藥品注冊(cè)通道,從藥品的注冊(cè)分類及申報(bào)資料要求看��,不同藥品的注冊(cè)技術(shù)要求有所不同[1]�。中醫(yī)藥作為我國獨(dú)特的衛(wèi)生資源����、潛力巨大的經(jīng)濟(jì)資源��、具有原創(chuàng)優(yōu)勢的科技資源�、優(yōu)秀的文化資源和重要的生態(tài)資源[2],在我國經(jīng)濟(jì)社會(huì)發(fā)展中發(fā)揮著重要作用�,也是我國醫(yī)療衛(wèi)生健康系統(tǒng)中不可或缺的部分。中藥注冊(cè)分類作為中藥注冊(cè)管理制度的核心內(nèi)容��,對(duì)推動(dòng)中醫(yī)藥事業(yè)的傳承與創(chuàng)新具有重要意義�。我國第一部有關(guān)藥品管理的基本法律《中華人民共和國藥品管理法》于1984年頒布且于1985年正式施行,首次將中藥納入藥品管理范疇[3]��。此后�,我國中藥注冊(cè)分類管理相關(guān)制度歷經(jīng)多次修訂、頒布試行或正式實(shí)施��,主要包括1985年�、1999年兩版《新藥審批辦法》,2002年《藥品注冊(cè)管理辦法》(試行版)�,2005年�、2007年及2020年三版《藥品注冊(cè)管理辦法》[4]。中藥注冊(cè)分類制度一直是歷版中藥注冊(cè)管理改革過程中的重點(diǎn)內(nèi)容����,也是常有爭議的核心問題[5]��。2017年����,國務(wù)院發(fā)布的《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》中明確了建立符合中藥特點(diǎn)的注冊(cè)管理制度和審評(píng)審批體系的重要性[6]����。本研究運(yùn)用多源流理論模型,從問題源流����、政策源流、政治源流3個(gè)角度分析中藥注冊(cè)分類制度的演變過程以及當(dāng)前存在的問題�,以期促進(jìn)我國中醫(yī)藥事業(yè)的傳承與創(chuàng)新發(fā)展。
一�、我國中藥注冊(cè)分類管理歷史變革過程
我國對(duì)于中藥的分類注冊(cè)管理最早見于1985年原中華人民共和國衛(wèi)生部發(fā)布的《新藥審批辦法》,該文件將中藥分為5類[5];2002年�,原國家藥品監(jiān)督管理局頒布的《藥品注冊(cè)管理辦法》(試行),第一次明確藥品注冊(cè)的概念��,同時(shí)將中藥分類由5類增加至11類[7]�。《藥品注冊(cè)管理辦法》經(jīng)歷4次變革�,在此過程中��,其對(duì)中藥的分類及其新藥的界定均做出了調(diào)整[4,7,8,9](見表1),2020版《藥品注冊(cè)管理辦法》將中藥的注冊(cè)分類簡化為4類����,即中藥創(chuàng)新藥�、中藥改良型新藥、古代經(jīng)典名復(fù)方制劑及同名同方藥[4]����,更加注重中醫(yī)藥自身的發(fā)展規(guī)律,這也意味著我國中藥注冊(cè)管理進(jìn)入了全新發(fā)展階段��。
二�、中藥分類注冊(cè)的多源流政策分析
美國公共政策學(xué)家約翰·金登在借鑒科恩、馬奇和奧爾森的“垃圾桶模型”的基礎(chǔ)上建立多源流理論����,該理論模型最早出現(xiàn)于1984年金登出版的《議程、備選方案與公共政策》一書[10]��。在多源流理論模型中�,問題源流、政策源流和政治源流的產(chǎn)生��、發(fā)展和運(yùn)行是密切相關(guān)的,三者既是獨(dú)立運(yùn)行又會(huì)適時(shí)耦合����,此時(shí)“政策之窗”被開啟��,政策議程建立��,在此基礎(chǔ)上政策出臺(tái)并且發(fā)生變遷����。“政策之窗”通常是指政策倡導(dǎo)者可以采取偏好的方案并能夠解決其所關(guān)注的政策問題的機(jī)會(huì)。社會(huì)上的焦點(diǎn)性事件或者政策問題的逐步累積都有機(jī)率成為“政策之窗”的啟動(dòng)機(jī)制��。本文主要基于多源流理論的分析視角��,對(duì)促進(jìn)中藥注冊(cè)分類改革的問題源流��、政策源流�、政治源流進(jìn)行探析,開啟政策之窗��,揭示推動(dòng)政策發(fā)展的動(dòng)因����,以便進(jìn)一步完善注冊(cè)分類制度,促進(jìn)中醫(yī)藥的傳承與創(chuàng)新發(fā)展。
2.1 問題源流
問題源流是指在制度實(shí)施的過程中所浮現(xiàn)出的有待政府加以解決或者是在社會(huì)發(fā)展過程中引起大眾關(guān)注的問題�,主要包括社會(huì)影響力較強(qiáng)的熱議話題、相關(guān)衡量指標(biāo)的變化以及尚需解決的公共危機(jī)等因素��。其中�,影響力較強(qiáng)的社會(huì)焦點(diǎn)事件是能夠推動(dòng)政策制定者、專家學(xué)者�、新聞媒體以及社會(huì)公眾去積極發(fā)現(xiàn)潛在的新問題并加以關(guān)注和探索解決方法的重大事件。衡量指標(biāo)的變化通常是引起政策制定者重視的關(guān)鍵因素����。尚待解決的公共危機(jī)往往是推動(dòng)客觀存在的現(xiàn)實(shí)問題成為社會(huì)問題進(jìn)而進(jìn)入政策議程階段的主要因素。
2.1.1 社會(huì)發(fā)展歷程中的焦點(diǎn)話題促進(jìn)中藥注冊(cè)分類制度的變革
自1984年國家頒布的《中華人民共和國藥品管理法》首次從法律層面將中藥納入藥品范疇并進(jìn)行管理以來[3]�,其發(fā)展持續(xù)獲得國家的重視和支持。在2007年版《藥品注冊(cè)管理辦法》的配套文件《中藥注冊(cè)管理補(bǔ)充規(guī)定》中��,首次提出中藥注冊(cè)應(yīng)當(dāng)體現(xiàn)出中醫(yī)藥的特色[11]��,這一提議充分說明中藥注冊(cè)分類制度的制定結(jié)合中藥特性的重要性����。抗擊新冠肺炎疫情過程中��,中藥參與臨床治療取得顯著成績��,社會(huì)公眾對(duì)于中醫(yī)、中藥產(chǎn)生了新的認(rèn)識(shí)��,與此同時(shí)��,也對(duì)中藥未來的發(fā)展寄予了更高的期望����。黨中央��、國務(wù)院高度重視我國中醫(yī)藥事業(yè)的發(fā)展����,2019年10月印發(fā)的《中共中央國務(wù)院關(guān)于促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展的意見》對(duì)中醫(yī)藥發(fā)展作出戰(zhàn)略性部署,要求改革完善中藥注冊(cè)管理����,及時(shí)完善中藥注冊(cè)分類并加快構(gòu)建中醫(yī)藥理論、人用經(jīng)驗(yàn)和臨床試驗(yàn)相結(jié)合的中藥注冊(cè)審評(píng)證據(jù)體系[12]��。但值得注意的是��,在我國2016年發(fā)布的《中醫(yī)藥發(fā)展戰(zhàn)略規(guī)劃綱要(2016-2030年)》中��,也明確指出我國中醫(yī)藥的可持續(xù)發(fā)展面臨資源總量不足�、野生中藥材資源破壞嚴(yán)重以及部分中藥材品質(zhì)下降等諸多問題[2]����,這也意味著對(duì)于中藥新藥前期的注冊(cè)申請(qǐng)存在缺乏原材料的問題����。2020年版《藥品注冊(cè)管理辦法》將中藥注冊(cè)分類由2007年《藥品注冊(cè)管理辦法》中的9類劃分簡化為中藥創(chuàng)新藥、中藥改良型新藥����、古代經(jīng)典名復(fù)方制劑和同名同方藥4類,其配套文件《中藥注冊(cè)分類及申報(bào)資料要求》對(duì)相關(guān)審批材料進(jìn)行了模塊化處理����,相較以往的審批效率有了很大程度提升,并明確要求了相關(guān)注冊(cè)需提交中藥材資源評(píng)估情況及古代經(jīng)典名方中藥復(fù)方制劑的申報(bào)路徑����。至此,我國中藥注冊(cè)申請(qǐng)進(jìn)入了全新發(fā)展時(shí)期�,綜觀我國2017-2021年間的中醫(yī)藥事業(yè)發(fā)展態(tài)勢,中藥注冊(cè)量總體上先降后升�,2021年中藥發(fā)展明顯改善,但與化學(xué)藥品��、生物制品注冊(cè)申請(qǐng)量仍相差較大��,而且目前還沒有完全確立符合中醫(yī)藥特色的標(biāo)準(zhǔn)化規(guī)范,迫切需要進(jìn)一步深化中藥審評(píng)審批改革����。
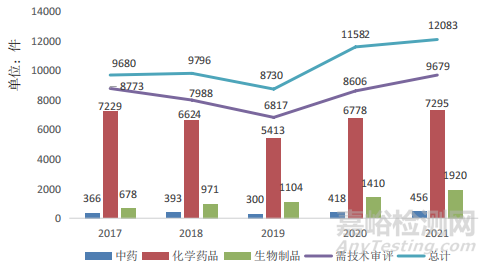
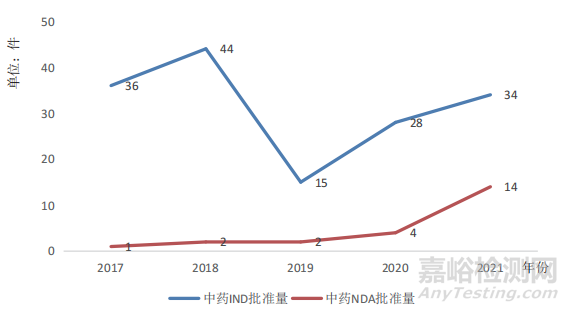
據(jù)國家藥品監(jiān)督管理局藥品審評(píng)中心(以下簡稱藥審中心)數(shù)據(jù)最新統(tǒng)計(jì),根據(jù)《藥品注冊(cè)管理辦法》及相關(guān)配套文件要求����,2021年藥審中心共計(jì)完成中藥(包括民族藥,下同)��、化學(xué)藥品�、生物制品各類注冊(cè)申請(qǐng)9679件(其中包含器械組合產(chǎn)品8件)��,同比增長35.66%�。其中,化學(xué)藥品注冊(cè)申請(qǐng)數(shù)量為7295件����,同比增長34.22%;中藥注冊(cè)申請(qǐng)計(jì)456件����,同比增長22.25%;生物制品注冊(cè)申請(qǐng)1920件��,同比增長45.12%;化學(xué)藥品約占全部需技術(shù)審評(píng)審結(jié)量的75.43%�。具體情況見圖1、圖2����。由圖1可以看出,歷年中藥的注冊(cè)申請(qǐng)受理量所占比例最小��,化學(xué)藥品注冊(cè)申請(qǐng)數(shù)量����、完成審評(píng)以及通過上市批準(zhǔn)的占比最大;同一時(shí)期數(shù)據(jù)情況見圖2�,藥審中心批準(zhǔn)中藥受理新藥臨床試驗(yàn)申請(qǐng)(Investigational New Drug,IND)34件,新藥上市許可申請(qǐng)(New Drug Application,NDA)14件��,相較2019年����,中藥新藥臨床審批及上市審批取得了明顯進(jìn)展。
▲圖1-2017-2021年中藥�、化藥、生物制品注冊(cè)申請(qǐng)審評(píng)審批完成情況
注:1.數(shù)據(jù)來自于國家藥品監(jiān)督管理局藥品審評(píng)中心�;2.完成總量中包含器械組合產(chǎn)品的注冊(cè)申請(qǐng),故注冊(cè)申請(qǐng)完成總量大于中藥�、化學(xué)藥品及生物制品注冊(cè)申請(qǐng)完成量之和����。
▲圖2-2017-2021年中藥IND申請(qǐng)和中藥NDA申請(qǐng)批準(zhǔn)情況
2.1.2 相關(guān)指標(biāo)變化推動(dòng)中藥注冊(cè)管理制度和技術(shù)評(píng)價(jià)體系的構(gòu)建與完善
藥品注冊(cè)分類管理制度自1985年誕生至今已30年有余����,在這過程之中經(jīng)歷多次變革,變革的產(chǎn)生引起制度體系周期性��、安全性����、高效性以及創(chuàng)新性等相關(guān)指標(biāo)的變化,更進(jìn)一步推動(dòng)中藥注冊(cè)分類管理制度和技術(shù)評(píng)價(jià)指標(biāo)體系的構(gòu)建與完善����,指標(biāo)變化情況主要有(1)高效性穩(wěn)步提升��。一方面�,《中藥注冊(cè)分類及申報(bào)材料》中提出的溝通交流、監(jiān)管機(jī)構(gòu)��、申請(qǐng)人“三結(jié)合”的審評(píng)證據(jù)體系開辟了具有中醫(yī)藥特色的注冊(cè)申報(bào)路徑�,不再只是以物質(zhì)基礎(chǔ)作為注冊(cè)分類的依據(jù),簡化審批程序����,提高審批效率�;另一方面����,《中藥注冊(cè)分類及申報(bào)材料》中指出,“要將中藥研發(fā)的各項(xiàng)資料進(jìn)行模塊化處理”�,這一措施促進(jìn)中藥注冊(cè)和申報(bào)效率的進(jìn)一步提高,降低時(shí)間成本����。(2)藥品安全性增強(qiáng)。2020年版《藥品注冊(cè)管理辦法》將已上市中藥生產(chǎn)工藝等改變引起藥用物質(zhì)基礎(chǔ)或藥物吸收��、利用明顯改變的部分納入到最新分類中藥改良型新藥中�,鼓勵(lì)對(duì)上市中藥開展更深入的研究,促進(jìn)“老藥新用”�,在把控中藥質(zhì)量方面邁出了新的一步。(3)創(chuàng)新性提升��。2020年版《藥品注冊(cè)管理辦法》及其配套材料《中藥注冊(cè)分類及其申報(bào)材料》相較歷年《藥品注冊(cè)管理辦法》充分體現(xiàn)出中藥的研發(fā)規(guī)律和中藥特色����,其中對(duì)于中藥改良型新藥的細(xì)化分類“中藥增加功能主治”的申報(bào)路徑更改為納入新藥范疇這一措施,促進(jìn)了基于臨床需要的新適應(yīng)癥開發(fā)[4,13];(4)完善周期性。新版中藥注冊(cè)分類制度修訂過程中遵循“完善全生命周期管理”的理念�,鼓勵(lì)中藥“二次開發(fā)”,完善中藥藥品全生命周期管理�,加大對(duì)來源于古代經(jīng)典名方、名老中醫(yī)驗(yàn)方等具有人用經(jīng)驗(yàn)的中藥新藥安全性評(píng)價(jià)技術(shù)標(biāo)準(zhǔn)的研究��。通過總結(jié)以往中藥注冊(cè)分類及審評(píng)審批制度改革實(shí)踐經(jīng)驗(yàn)����、充分探析現(xiàn)有藥品審批制度改革成果,發(fā)現(xiàn)中藥分類注冊(cè)制度與現(xiàn)存中藥的特色和研發(fā)實(shí)際��、臨床實(shí)踐情況仍然存在不相匹配的情況��,需要引起關(guān)注��。
2.2 政策源流
政策源流是政策建議��、政策主張和政策方案制定�、產(chǎn)生和不斷完善的過程�。金登將這一過程比喻為“類似于一種生物自然選擇的過程”[10]。專家學(xué)者�、科研工作者、社會(huì)公眾和其他利益相關(guān)者對(duì)中藥注冊(cè)分類管理領(lǐng)域的政策問題��,給予高度關(guān)注并針對(duì)該領(lǐng)域存在的政策問題進(jìn)行頭腦風(fēng)暴����,提出政策議案�、初步擬定政策建議����,這些不同的思想在政策共同體中碰撞重組、相互結(jié)合����,最后形成符合現(xiàn)實(shí)技術(shù)可行性的觀點(diǎn)。2020年6月�,習(xí)近平總書記在專家學(xué)者座談會(huì)上指出要改革完善中藥審評(píng)審批機(jī)制,促進(jìn)中藥新藥研發(fā)和產(chǎn)業(yè)發(fā)展����,為新時(shí)代中醫(yī)藥傳承創(chuàng)新發(fā)展指明了方向。
2.2.1 中藥注冊(cè)管理制度及審評(píng)審批技術(shù)體系的實(shí)踐探索歷程
國家相關(guān)部門根據(jù)不同時(shí)期中藥注冊(cè)分類管理存在的問題和發(fā)展趨勢進(jìn)行了相應(yīng)的制度設(shè)計(jì)并出臺(tái)相關(guān)政策��,詳見表2����,表中包括了1963-2021年由原中華人民共和國衛(wèi)生部、原國家藥品監(jiān)督管理局等部門發(fā)布的部分關(guān)于中藥注冊(cè)管理的指導(dǎo)文件��。
表2 1963-2021年發(fā)布的關(guān)于中藥注冊(cè)管理部分相關(guān)指導(dǎo)文件
2.2.2 各方多視角提出觀點(diǎn)與政策落實(shí)
近年來,越來越多的專家學(xué)者��、相關(guān)政府監(jiān)管部門針對(duì)中藥注冊(cè)分類制度從不同視角提出了自己的思考和觀點(diǎn)��,且督促相關(guān)部門因地��、因事��、因時(shí)制宜����,“對(duì)癥下藥”落實(shí)這一政策。為深入貫徹落實(shí)《中共中央國務(wù)院關(guān)于促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展的意見》����,加快推進(jìn)中醫(yī)藥的傳承創(chuàng)新發(fā)展,2020年以來��,廣東��、上海�、江西等地均結(jié)合本地實(shí)際情況,相繼制定和發(fā)布了促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展的實(shí)施意見或措施��。與此同時(shí)����,河北、陜西及安徽等地已經(jīng)完成本省中醫(yī)藥條例的修訂并頒布實(shí)施����。學(xué)者林凡儒認(rèn)為,中藥審評(píng)審批環(huán)節(jié)仍存在一些問題�,在一定程度上制約了中醫(yī)藥創(chuàng)新發(fā)展。中藥新藥注冊(cè)申請(qǐng)批準(zhǔn)數(shù)量少��、批準(zhǔn)率低導(dǎo)致中藥企業(yè)對(duì)中藥新藥的開發(fā)積極性不高[14]����,中藥產(chǎn)業(yè)的發(fā)展也會(huì)因此滯后。針對(duì)中藥審評(píng)審批制度�,學(xué)者林凡儒提出了3項(xiàng)改革措施,主要是希望在現(xiàn)有中藥注冊(cè)����、審評(píng)審批管理制度基礎(chǔ)上,加強(qiáng)與中藥價(jià)格�、醫(yī)保及報(bào)銷等政策制度的有效銜接,建立符合中藥特點(diǎn)的技術(shù)評(píng)價(jià)體系��,加快審評(píng)審批進(jìn)程[14]��。
2.3 政治源流
政治源流由公眾情緒、利益集團(tuán)間的競爭����、選舉結(jié)果、政黨或者意識(shí)形態(tài)在國會(huì)中的分布狀況以及政治理念變化等因素構(gòu)成�。公眾情緒是指大多數(shù)人會(huì)針對(duì)某一熱議話題產(chǎn)生同向思考,并且這種方向會(huì)與時(shí)間變化形成正向線性關(guān)系�。政治源流為中藥注冊(cè)分類管理制度的制定與施行提供了合法性基礎(chǔ)和保障。在我國中藥注冊(cè)分類及審評(píng)審批制度改革的過程中�,中國共產(chǎn)黨對(duì)總體政策的把握和民眾給予的關(guān)注與討論起到了較大的推動(dòng)作用,但推動(dòng)政策議程建立的關(guān)鍵驅(qū)動(dòng)力應(yīng)是政治理念的變化��。
2.3.1 黨中央����、國務(wù)院關(guān)于中藥注冊(cè)分類制度完善的方針和理念
黨的全面領(lǐng)導(dǎo)是我國最具特色的制度設(shè)計(jì),國務(wù)院《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》(以下簡稱“兩辦”文件)構(gòu)成了中藥注冊(cè)改革與完善政策制定的政治源流�,“兩辦”文件自出臺(tái)以來,國家藥品監(jiān)管機(jī)構(gòu)一直在積極思考如何完善中藥注冊(cè)制度和技術(shù)評(píng)價(jià)體系����,如何落實(shí)中藥傳承與創(chuàng)新。此后�,為進(jìn)一步促進(jìn)符合中醫(yī)藥特點(diǎn)的注冊(cè)分類和技術(shù)評(píng)價(jià)體系的建立完善,國家相繼頒布了一系列中藥研究指導(dǎo)文件��。
2.3.2 公眾情緒加速政策議程建立
自古至今,中藥一直是我國中醫(yī)藥事業(yè)發(fā)展和傳承的重要載體��,中藥產(chǎn)業(yè)作為我國獨(dú)具特色和原創(chuàng)優(yōu)勢的民族產(chǎn)業(yè)歷來備受關(guān)注��。中藥的研發(fā)注冊(cè)管理也是經(jīng)歷了艱難的起步階段����、逐漸適應(yīng)的成長階段才進(jìn)入到如今的發(fā)展完善時(shí)期�。一直以來,藥品注冊(cè)工作作為藥品監(jiān)管的重要環(huán)節(jié)��,深受社會(huì)各界廣泛關(guān)注[15]����。抗擊新冠肺炎疫情過程中����,清肺排毒顆粒、化濕敗毒顆粒��、宣肺敗毒顆粒(簡稱“三方”)等根據(jù)臨床觀察總結(jié)出來的有效中藥方劑在阻斷新冠肺炎病情轉(zhuǎn)重�、改善癥狀,特別是在縮短病程方面取得良好的療效�。2021年3月2日�,國家藥品監(jiān)督管理局正式批準(zhǔn)“三方”上市�,標(biāo)志著中醫(yī)藥科技原創(chuàng)優(yōu)勢再一次轉(zhuǎn)化為重大成果,這一次中醫(yī)藥守正創(chuàng)新的生動(dòng)實(shí)踐也使中藥在抗疫過程當(dāng)中受到更多公眾的支持與重視����。化濕敗毒顆粒正式以藥品身份進(jìn)入阿聯(lián)酋市場��,中國的“中醫(yī)藥力量”在全球抗疫中得到認(rèn)可��,也為人類健康命運(yùn)共同體建設(shè)作出了積極貢獻(xiàn)[16]��。
2.3.3 醫(yī)療理念變化推動(dòng)中藥注冊(cè)分類政策的完善
健康是促進(jìn)人的全面發(fā)展的必然要求�,也是經(jīng)濟(jì)社會(huì)發(fā)展的重要基礎(chǔ)。黨和國家高度重視人民健康�,新中國成立以來,特別是改革開放以來����,我國在健康領(lǐng)域的改革取得顯著成效。
2016年����,國務(wù)院印發(fā)《“健康中國2030”規(guī)劃綱要》,將“健康中國”理念落到實(shí)踐層面��,要求必須充分發(fā)揮我國中醫(yī)藥的獨(dú)特優(yōu)勢,到2030年要使中醫(yī)藥充分發(fā)揮在治未病中的主導(dǎo)作用����、在重大疾病治療中的協(xié)同作用以及在疾病康復(fù)中的核心作用,強(qiáng)調(diào)注重中西醫(yī)結(jié)合[17]�。雖然中西醫(yī)各自的醫(yī)療體系都尚不完善��,但相比之下大眾對(duì)中藥的信任度及就醫(yī)傾向遠(yuǎn)不及西藥��,這也意味著進(jìn)一步完善中藥新藥的審評(píng)審批體系及注冊(cè)分類制度����、推動(dòng)中藥發(fā)展,提高中藥在現(xiàn)代醫(yī)療服務(wù)系統(tǒng)中的地位是十分必要的�。
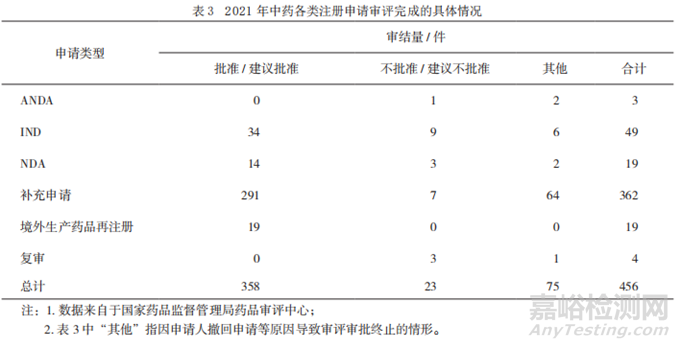
2021年藥審中心審結(jié)需技術(shù)審評(píng)的中藥注冊(cè)申請(qǐng)共計(jì)456件。其中��,按注冊(cè)申請(qǐng)類別統(tǒng)計(jì)����,完成中藥IND 49件,NDA 19件��,同名同方藥����、仿制藥�、生物類似藥上市許可申請(qǐng)(Abbreviated New Drug Application,ANDA)3件����;審結(jié)批準(zhǔn)中藥IND申請(qǐng)34件,批準(zhǔn)率達(dá)69.4%��,審結(jié)建議批準(zhǔn)NDA 14件�,審評(píng)批準(zhǔn)率達(dá)73.7%(審評(píng)批準(zhǔn)率=審結(jié)批準(zhǔn)數(shù)量/同年審結(jié)總量×100%)。具體見表3�。總體而言����,在2007年版《藥品注冊(cè)管理辦法》實(shí)施后期,尤其在之后的5年時(shí)間里��,我國中藥新藥注冊(cè)的申請(qǐng)和審批現(xiàn)狀不甚理想�。IND作為連接新藥研發(fā)與上市注冊(cè)的中間關(guān)鍵環(huán)節(jié),其受理量直接反映出新藥研發(fā)的活躍程度低[18]��。雖然�,目前我國中藥IND申請(qǐng)受理量、審結(jié)量較往年明顯增加,但當(dāng)前中藥研發(fā)與技術(shù)評(píng)價(jià)體系以及審評(píng)審批過程的監(jiān)管交流仍需進(jìn)一步加強(qiáng)��。2020年版《藥品注冊(cè)管理辦法》的發(fā)布及其配套文件《中藥注冊(cè)分類及申報(bào)資料要求》對(duì)中藥注冊(cè)分類進(jìn)一步細(xì)化����,將中藥研發(fā)所需的各項(xiàng)資料模塊化,為進(jìn)一步提高中藥注冊(cè)申報(bào)和審評(píng)效率��,更好地傳承和創(chuàng)新中醫(yī)藥奠定了基礎(chǔ)����。
2.4 多源流耦合�,政策之窗開啟
金登將政策之窗分為問題之窗和政治之窗[10]。當(dāng)人們意識(shí)到推動(dòng)中醫(yī)藥傳承和創(chuàng)新發(fā)展的必要性����,領(lǐng)悟到中藥注冊(cè)分類及審評(píng)審批技術(shù)體系完善在中醫(yī)藥發(fā)展過程中的重要性,明確了當(dāng)前中藥注冊(cè)管理過程中出現(xiàn)的問題之后����,相應(yīng)的政策建議、備選方案和解決辦法與權(quán)威政策因素進(jìn)行結(jié)合�,就能促進(jìn)相互獨(dú)立的問題源流、政策源流和政治源流實(shí)現(xiàn)耦合����,在三大源流匯合開啟政策之窗時(shí)����,中藥注冊(cè)分類的政治之窗和問題之窗也同時(shí)開啟��。三大源流處于一個(gè)動(dòng)態(tài)環(huán)境中��,三流匯聚的實(shí)現(xiàn)需要國家相關(guān)部門��、國民情緒����、政策企業(yè)家等多維度配合。
2017年��,國務(wù)院辦公廳印發(fā)《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)醫(yī)療器械創(chuàng)新的意見》����,對(duì)建立具備中藥特色的注冊(cè)管理制度和審評(píng)審批技術(shù)評(píng)價(jià)體系作出明確規(guī)定。2020年��,國家藥品監(jiān)督管理局發(fā)布《藥品注冊(cè)管理辦法》和審評(píng)審批的配套資料��,標(biāo)志著中藥分類注冊(cè)制度的進(jìn)一步完善��,也表明我國中醫(yī)藥進(jìn)入傳承創(chuàng)新的新階段,國家領(lǐng)導(dǎo)人的指示和政策出臺(tái)成為政策之窗打開的契機(jī)��。政策之窗開啟��,并不代表問題已經(jīng)解決����,國家監(jiān)管部門應(yīng)繼續(xù)帶領(lǐng)社會(huì)相關(guān)領(lǐng)域工作者在尊重中醫(yī)藥特色基礎(chǔ)上引導(dǎo)研發(fā)往前走,把握下一次政策之窗開啟的新時(shí)機(jī)����。
三、展望
中藥注冊(cè)分類管理制度和審評(píng)審批技術(shù)評(píng)價(jià)體系的改革過程是問題源流����、政治源流和政策源流三者耦合、政策之窗開啟推動(dòng)的結(jié)果��。2020年版《藥品注冊(cè)管理辦法》及《中藥注冊(cè)分類及申報(bào)資料要求》是具有指導(dǎo)性意義的政策規(guī)定�,但是能否有效解決中藥注冊(cè)分類存在的問題��、改變中藥新藥申請(qǐng)的現(xiàn)狀還具有較強(qiáng)的不確定性����。綜上,通過對(duì)中藥注冊(cè)分類多源流政策的分析可見,其改革的政策之窗已經(jīng)開啟����,2020年是中藥注冊(cè)制度變遷的一個(gè)重要拐點(diǎn),但是后續(xù)的制度改革和完善應(yīng)如何進(jìn)行仍然是政策制定者面臨的重大難題����,如上市中藥注冊(cè)分類過程中存在的申報(bào)數(shù)量增加而審評(píng)核查資源有限,最新分類3.2類中藥復(fù)方制劑采取何種方式能夠減免藥效學(xué)與臨床試驗(yàn)等都是未來政策改革中需要面臨的重大難題����。總體來說��,中藥作為我國具有獨(dú)特原創(chuàng)優(yōu)勢的科技領(lǐng)域����,其發(fā)展過程應(yīng)當(dāng)尊重中藥特色、遵循中藥研發(fā)規(guī)律�,與中醫(yī)藥傳承發(fā)展的理念和實(shí)踐特點(diǎn)相結(jié)合,應(yīng)進(jìn)一步完善中藥注冊(cè)監(jiān)管政策����,以促進(jìn)企業(yè)研發(fā)更有臨床價(jià)值的中藥新藥,推動(dòng)中藥創(chuàng)新事業(yè)的強(qiáng)盛發(fā)展�。
參考文獻(xiàn)
[1] 陸文亮�,李鴻彬����,董海鷗,等. 對(duì)現(xiàn)行的中藥注冊(cè)分類制度改革的建議和思考[J]. 中草藥����,2015,46(9):1410-1412
[2] 中共中央辦公廳����,國務(wù)院辦公廳. 中共中央辦公廳 國務(wù)院辦公廳印發(fā)《中醫(yī)藥發(fā)展戰(zhàn)略規(guī)劃綱要(2016-2030年)》[EB/OL].(2016-02-26)[2022-04-20]. http://www.gov.cn/zhengce/content/2016-02/26/content_5046678.htm.
[3] 國家藥品監(jiān)督管理局. 中華人民共和國藥品管理法[EB/OL].(2019-08-27)[2022-04-20]. https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20190827083801685.html
[4] 國家藥品監(jiān)督管理局.藥品注冊(cè)管理辦法[EB/OL].(2020-03-30)[2022-04-20]. https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/20200330180501220.html.
[5] 瞿禮萍,唐健元��,張磊��,等. 我國中藥注冊(cè)分類的歷史演變��、現(xiàn)狀與問題[J]. 中國中藥雜志�,2022,47(2):562-568.
[6] 中共中央辦公廳��,國務(wù)院辦公廳. 中共中央辦公廳國務(wù)院辦公廳印發(fā)《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見》[EB/OL].(2017-10-08)[2022-04-20]. http://www.gov.cn/zhengce/2017-10/08/content_5230105.htm.
[7] 國家藥品監(jiān)督管理局. 藥品注冊(cè)管理辦法[EB/OL].(2002-10-31)[2022-04-20]. https://www.nmpa.gov.cn/xxgk/f gwj/bm gzh/20021031010101123.html.
[8] 國 家 藥 品 監(jiān) 督 管 理 局 . 藥 品 注 冊(cè) 管 理 辦 法 [ E B /OL].(2005-05-28)[2022-04-20]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/bmgzh/20050228010101137.html.
[9] 國 家 藥 品 監(jiān) 督 管 理 局 . 藥 品 注 冊(cè) 管 理 辦 法 [ E B /OL].(2007-07-10)[2022-04-20]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/bmgzh/20070710010101571.html.
[10] 鄧劍偉. 社會(huì)管理政策的多源流分析:議程����、方案與機(jī)制[J]. 東北大學(xué)學(xué)報(bào)(社會(huì)科學(xué)版),2013��,15(3):276-281.[11] 國 家 藥 品 監(jiān) 督 管 理 局 . 關(guān) 于 印 發(fā) 中 藥 注 冊(cè) 管 理補(bǔ)充規(guī)定的通知[EB/OL].(2008-01-07)[2022-04-20]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20080107120001991.html.
[12] 中華人民共和國 國務(wù)院關(guān)于促進(jìn)中醫(yī)藥傳承創(chuàng)新發(fā)展的意見[EB/OL].(2020-12-25)[2022-04-20]. http://www.gov.cn/xinwen/2019-10/30/content_5446673.htm.
[13] 王青云. 國家藥監(jiān)局發(fā)布《中藥注冊(cè)分類及申報(bào)資料要求》[J]. 中醫(yī)藥管理雜志��,2020�,28(20):79.
[14] 盧夢勻. 推進(jìn)審評(píng)審批制度改革 激發(fā)中藥企業(yè)創(chuàng)新活力[N]. 上海證券報(bào),2022-03-10(009).
[15] 陶晶����,操瑋,陸巍. 中藥注冊(cè)管理的歷史沿革及現(xiàn)狀分析[J]. 中成藥�,2014,36(7):1509-1512.
[16] 王小波�,曾德金. 走中醫(yī)藥特色的中藥新藥評(píng)審之路[N]. 經(jīng)濟(jì)參考報(bào),2021-04-07(006).
[17] 中共中央辦公廳����,國務(wù)院辦公廳. 中共中央辦公廳國務(wù)院辦公廳印發(fā)《“健康中國2030”規(guī)劃綱要》[EB/OL].(2016-10-25)[2022-04-20]. http://www.gov.cn/xinwen/2016-10/25/content_5124174.htm.
[18] 瞿禮萍,陳楊��,王筱竺����,等. 2007-2019年國內(nèi)中藥新藥注冊(cè)的審批情況分析[J]. 中草藥,2021��,52(3):894-901