摘 要 / Abstract
本文利用ClinicalTrials.gov數(shù)據(jù)庫(kù)信息�����,簡(jiǎn)要分析4家大型醫(yī)療器械外資企業(yè)(美敦力���、強(qiáng)生���、雅培及波士頓科學(xué))近年來(lái)在我國(guó)開(kāi)展上市前臨床試驗(yàn)的現(xiàn)狀,并結(jié)合相關(guān)政策法規(guī)的進(jìn)展��,探討政策法規(guī)對(duì)外資企業(yè)在我國(guó)開(kāi)展臨床試驗(yàn)的影響以及展望未來(lái)的發(fā)展趨勢(shì)��。結(jié)果顯示��,在篩選的52個(gè)臨床試驗(yàn)研究中�����,最早的研究從2011年開(kāi)始���,2011~2022年4家外資企業(yè)在我國(guó)開(kāi)展上市前臨床試驗(yàn)的數(shù)量總體呈現(xiàn)增長(zhǎng)趨勢(shì),但近3年有所下降���。52個(gè)臨床試驗(yàn)研究涉及的產(chǎn)品以心血管領(lǐng)域?yàn)橹?��,單臂研究居多,樣本量中位?shù)為82�����,大部分研究時(shí)限不超過(guò)12個(gè)月。從分析結(jié)果可以看出�����,政策法規(guī)對(duì)外資企業(yè)在我國(guó)開(kāi)展臨床試驗(yàn)具有決定性的影響�����。
Using data from the ClinicalTrials.gov website, this article briefly analyzes the pre-market clinical trials conducted in China during recent years by four major foreign medical device companies(Medtronic, Johnson & Johnson, Abbott and Boston Scientific). Considering the progress of relevant regulations and policies, it explores the impact of relevant policies on the participation of foreign companies in pre-market clinical trials in China and offers insights into potential future trends. The analysis of 52 selected clinical trials reveals a trend of increasing numbers from 2011 to 2022 for these four companies. However, there has been a decrease in the past three years. The 52 selected clinical trials predominantly focus on cardiovascular products, often adopting single-arm study designs with a median sample size of 82 and a follow-up period of fewer than 12 months. The findings underline the significant impact of policies and regulations on clinical trials conducted by foreign medical device companies in China.
關(guān) 鍵 詞 / Key words
醫(yī)療器械���;外資企業(yè)�����;臨床試驗(yàn)��;注冊(cè)���;上市前
medical device; foreign company, clinical trial; registration; pre-market
過(guò)去20多年,我國(guó)醫(yī)療器械監(jiān)管實(shí)踐發(fā)生了較大的變化,對(duì)醫(yī)療器械臨床試驗(yàn)的要求也在不斷發(fā)展之中。2000年,《醫(yī)療器械監(jiān)督管理?xiàng)l例》[1]發(fā)布實(shí)施,并于2014年和2021年經(jīng)歷了兩次重大修訂[2-3],與其配套的相關(guān)規(guī)定也隨之進(jìn)行了多次修訂與完善[4-6]�����。此外,還發(fā)布了一系列涉及具體產(chǎn)品的指導(dǎo)原則,其中與外資企業(yè)密切相關(guān)的指導(dǎo)原則,包括《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》[7]等。
臨床試驗(yàn)是評(píng)價(jià)產(chǎn)品安全性和有效性的重要途徑,對(duì)于高風(fēng)險(xiǎn)產(chǎn)品更是不可或缺的環(huán)節(jié)���。但由于臨床試驗(yàn)耗時(shí)耗力耗資,企業(yè)在進(jìn)行臨床試驗(yàn)前需反復(fù)權(quán)衡,慎重決策,特別是在境外已有臨床數(shù)據(jù)證實(shí)產(chǎn)品安全性和有效性的基礎(chǔ)之上���。基于此,本文簡(jiǎn)要分析了近年來(lái)美敦力��、強(qiáng)生���、雅培及波士頓科學(xué)4家大型醫(yī)療器械外資企業(yè)在我國(guó)開(kāi)展上市前臨床試驗(yàn)的現(xiàn)狀,并結(jié)合相關(guān)政策法規(guī)的進(jìn)展,探討相關(guān)政策對(duì)外資企業(yè)在我國(guó)開(kāi)展臨床試驗(yàn)的影響以及展望未來(lái)的發(fā)展趨勢(shì)�����。
1、方 法
本文數(shù)據(jù)主要來(lái)自美國(guó)臨床試驗(yàn)注冊(cè)庫(kù)(Clinical Trials.gov)[8]��。該數(shù)據(jù)庫(kù)是由美國(guó)食品藥品監(jiān)督管理局(Food and Drug Administration,FDA)和美國(guó)國(guó)立醫(yī)學(xué)圖書(shū)館(National Library of Medicine,NLM)共同開(kāi)發(fā),并于2002年正式對(duì)公眾開(kāi)放[9]��。盡管該數(shù)據(jù)庫(kù)設(shè)定了一些格式化的條目及定義,但具體查找和搜索時(shí)仍可能存在不同的理解,且有些信息不夠完整甚至可能存在差錯(cuò),進(jìn)而影響相關(guān)研究分析的準(zhǔn)確性�����。因此,本文明確了篩選上市前注冊(cè)臨床試驗(yàn)的判定標(biāo)準(zhǔn):(1)明確表明是上市前臨床試驗(yàn)研究的可直接入選�����;(2)對(duì)于未明確表明是上市前臨床試驗(yàn)研究的,通讀整個(gè)記錄并結(jié)合特定產(chǎn)品在我國(guó)上市的情況以及其他行業(yè)內(nèi)的信息進(jìn)行綜合判斷。此外,本文還通過(guò)檢索中國(guó)臨床試驗(yàn)注冊(cè)中心相關(guān)數(shù)據(jù),核實(shí)是否存在遺漏信息,以保證研究的準(zhǔn)確性�����。
在Clinical Trials.gov數(shù)據(jù)庫(kù)的高級(jí)檢索“Sponsor(Lead)”欄中分別輸入美敦力��、強(qiáng)生��、雅培及波士頓科學(xué)4家醫(yī)療器械外資企業(yè)的英文名稱(Medtronic��、Johnson&Johnson�����、Abbott���、Boston Scientific),考慮到強(qiáng)生還有較多子公司,又將其子公司的英文名稱(Biosense Webster、Cordis���、De Puy���、Ethicon��、Life Scan�����、Vision Care)進(jìn)行輸入���;在“Country”欄中選擇China(中國(guó))或在“Other terms”欄中輸入China(中國(guó));檢索日期為2000年1月1日~2022年12月31日��。按照篩選標(biāo)準(zhǔn)逐條閱讀分析檢索記錄,剔除誤檢記錄(如檢索Johnson&Johnson時(shí)會(huì)出現(xiàn)Mead Johnson)后共獲得206個(gè)臨床試驗(yàn)研究��。再剔除藥物�����、體外診斷試劑�����、上市后研究以及研究中心包含中國(guó)香港而不包含中國(guó)內(nèi)地的記錄等,最終有52個(gè)臨床試驗(yàn)研究符合本文分析要求,其中包括6個(gè)在海南博鰲開(kāi)展的真實(shí)世界研究項(xiàng)目���。
2、結(jié) 果
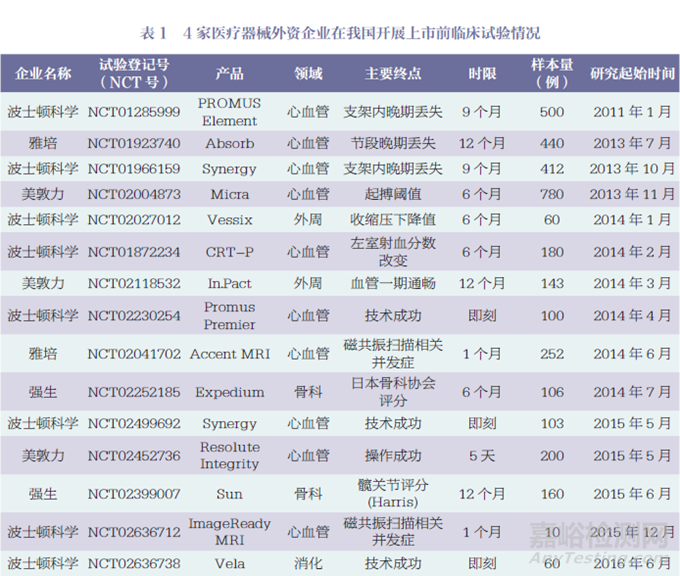
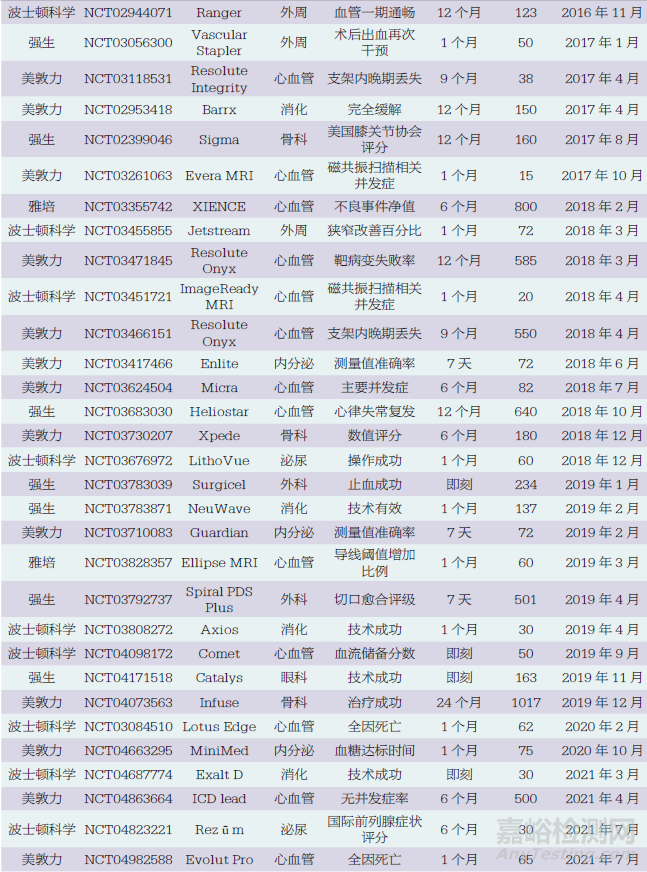
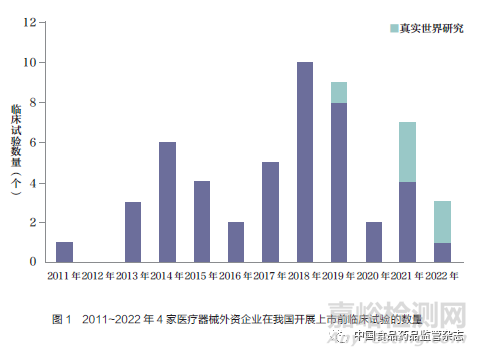
本文對(duì)4家醫(yī)療器械外資企業(yè)在我國(guó)開(kāi)展上市前臨床試驗(yàn)情況進(jìn)行統(tǒng)計(jì),結(jié)果顯示,在52個(gè)臨床試驗(yàn)研究中,其中波士頓科學(xué)18個(gè)��、美敦力16個(gè)、強(qiáng)生14個(gè)���、雅培4個(gè),如表1所示��。最早的研究從2011年開(kāi)始,2011~2022年4家醫(yī)療器械外資企業(yè)在我國(guó)開(kāi)展臨床試驗(yàn)的數(shù)量總體呈現(xiàn)增長(zhǎng)趨勢(shì),但近3年有所下降,如圖1所示��。
按醫(yī)療器械治療領(lǐng)域分類,52個(gè)臨床試驗(yàn)研究中,心血管內(nèi)科24個(gè)(冠狀動(dòng)脈11個(gè)�����、心臟起搏9個(gè)�����、電生理2個(gè)�����、心臟瓣膜2個(gè)),消化介入6個(gè),外周血管領(lǐng)域5個(gè),骨科5個(gè),眼科4個(gè),內(nèi)分泌3個(gè),泌尿外科3個(gè),外科2個(gè)�����。冠狀動(dòng)脈領(lǐng)域中10個(gè)為冠狀動(dòng)脈支架,心臟起搏領(lǐng)域中5個(gè)為磁共振兼容起搏器或植入型心律轉(zhuǎn)復(fù)除顫器(implantable cardioverter defibrillator,ICD)��。
按研究設(shè)計(jì)分類,52個(gè)臨床試驗(yàn)研究中,單臂研究38個(gè),隨機(jī)對(duì)照試驗(yàn)(randomized controlled trial,RCT)14個(gè),其中包括一致性評(píng)價(jià)研究1個(gè)��。
52個(gè)臨床試驗(yàn)研究中,主要終點(diǎn)的隨訪時(shí)間范圍為即刻至24個(gè)月���。具體為:即刻7個(gè),1個(gè)月及以下20個(gè),1個(gè)月以上至12個(gè)月以下15個(gè)(主要為6個(gè)月和9個(gè)月),12個(gè)月9個(gè),12個(gè)月以上1個(gè)���。
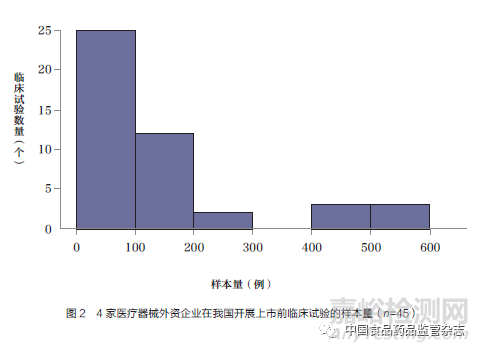
52個(gè)臨床試驗(yàn)研究中,國(guó)際多中心臨床研究7個(gè),包括2個(gè)亞太地區(qū)多中心臨床研究。2個(gè)亞太地區(qū)多中心臨床研究中,我國(guó)內(nèi)地臨床研究中心數(shù)量/亞太地區(qū)多中心臨床研究中心總數(shù)分別為1/13和3/21��;其他5個(gè)國(guó)際多中心臨床研究中,我國(guó)內(nèi)地臨床研究中心數(shù)量/國(guó)際多中心臨床研究中心總數(shù)分別為1/56���、2/51��、2/41��、3/27�����、2/46��。除了這7個(gè)研究外,其他45個(gè)研究在我國(guó)內(nèi)地開(kāi)展的試驗(yàn)樣本量最小為10例,最大為585例,中位數(shù)為82(四分位間距60~160),如圖2所示。其中,樣本量為200例以上的有8個(gè),包括6個(gè)冠狀動(dòng)脈支架產(chǎn)品和2個(gè)外科產(chǎn)品���。
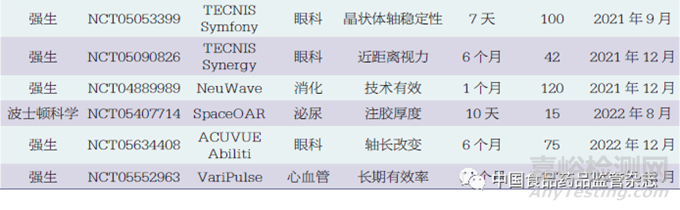
本文納入了6個(gè)在海南博鰲開(kāi)展的真實(shí)世界研究,即Catalys飛秒激光(強(qiáng)生)��、Exalt D一次性十二指腸鏡(波士頓科學(xué)),Rezūm前列腺水蒸氣熱療消融系統(tǒng)(波士頓科學(xué)),Space OAR水凝膠(波士頓科學(xué)),ACUVUE Abiliti人工晶體(強(qiáng)生),TECNIS Synergy人工晶體(強(qiáng)生)���。盡管這6個(gè)研究為真實(shí)世界研究,但考慮到其支持產(chǎn)品注冊(cè)的性質(zhì),故納入分析范圍。除此之外,52個(gè)臨床試驗(yàn)研究中有5個(gè)研究提前終止,其中2個(gè)因入選困難,3個(gè)因企業(yè)戰(zhàn)略變化�����。
綜上所述,共有52個(gè)臨床試驗(yàn)研究納入本文分析,其中波士頓科學(xué)18個(gè)��、美敦力16個(gè)��、強(qiáng)生14個(gè)�����、雅培4個(gè)�����。研究起始時(shí)間從2011年開(kāi)始,2011~2022年4家醫(yī)療器械外資企業(yè)在我國(guó)開(kāi)展上市前臨床試驗(yàn)的數(shù)量總體呈現(xiàn)增長(zhǎng)趨勢(shì),但近3年有所下降�����。臨床試驗(yàn)涉及的產(chǎn)品以心血管領(lǐng)域?yàn)橹?單臂研究居多,樣本量中位數(shù)為82,大部分臨床研究時(shí)限不超過(guò)12個(gè)月。
3�����、討 論
2000年發(fā)布的《醫(yī)療器械監(jiān)督管理?xiàng)l例》尚未明確提出臨床試驗(yàn)的表述,相關(guān)表述為臨床試用和臨床驗(yàn)證��。2004年發(fā)布的《醫(yī)療器械注冊(cè)管理辦法》和《醫(yī)療器械臨床試驗(yàn)規(guī)定》[10]開(kāi)始使用臨床試驗(yàn)的表述,2014年修訂的《醫(yī)療器械監(jiān)督管理?xiàng)l例》刪除臨床試用和臨床驗(yàn)證的表述�����。2016年發(fā)布的《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》[11]第三條將臨床試驗(yàn)定義為:在經(jīng)資質(zhì)認(rèn)定的醫(yī)療器械臨床試驗(yàn)機(jī)構(gòu)中,對(duì)擬申請(qǐng)注冊(cè)的醫(yī)療器械在正常使用條件下的安全性和有效性進(jìn)行確認(rèn)或者驗(yàn)證的過(guò)程��。2022年修訂的《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》[12]刪除臨床試驗(yàn)定義中的“或者驗(yàn)證”��。
2004年發(fā)布的《醫(yī)療器械注冊(cè)管理辦法》在附件12中規(guī)定:境外政府醫(yī)療器械主管部門(mén)未批準(zhǔn)在本國(guó)(地區(qū))上市的第二類��、第三類產(chǎn)品,以及境外政府醫(yī)療器械主管部門(mén)已批準(zhǔn)申請(qǐng)產(chǎn)品在本國(guó)(地區(qū))上市但企業(yè)無(wú)產(chǎn)品進(jìn)入過(guò)我國(guó)市場(chǎng)的第三類植入型產(chǎn)品,需要在我國(guó)境內(nèi)進(jìn)行臨床試驗(yàn)���。因此,在較長(zhǎng)的一段時(shí)間內(nèi)未檢索到外資企業(yè)在我國(guó)開(kāi)展上市前臨床試驗(yàn)的注冊(cè)記錄,直至2011年才出現(xiàn)冠狀動(dòng)脈藥物支架的上市前臨床試驗(yàn)���。
2014年修訂的《醫(yī)療器械監(jiān)督管理?xiàng)l例》及《醫(yī)療器械注冊(cè)管理辦法》明確提出:申請(qǐng)第二類、第三類醫(yī)療器械注冊(cè),應(yīng)當(dāng)進(jìn)行臨床試驗(yàn)(另有免于進(jìn)行臨床試驗(yàn)的醫(yī)療器械除外)��。2018年發(fā)布的《冠狀動(dòng)脈藥物洗脫支架臨床試驗(yàn)指導(dǎo)原則》[13]指出:境外已上市產(chǎn)品如已經(jīng)在境外完成設(shè)計(jì)良好的�����、前瞻性的臨床試驗(yàn),同一試驗(yàn)方案下試驗(yàn)組樣本量不少于600例且符合我國(guó)對(duì)于該類產(chǎn)品的臨床試驗(yàn)要求,除應(yīng)按相關(guān)規(guī)定提供產(chǎn)品境外的臨床資料外,還應(yīng)提供產(chǎn)品在中國(guó)境內(nèi)開(kāi)展的隨機(jī)對(duì)照試驗(yàn)研究資料���。并建議冠狀動(dòng)脈藥物洗脫支架確證性試驗(yàn)由兩個(gè)臨床試驗(yàn)組成,其中一個(gè)臨床試驗(yàn)為隨機(jī)對(duì)照試驗(yàn),另一個(gè)臨床試驗(yàn)為單組目標(biāo)值試驗(yàn)�����。其中隨機(jī)對(duì)照試驗(yàn)為與對(duì)照產(chǎn)品進(jìn)行的以晚期管腔丟失(Late Loss)為主要研究終點(diǎn)的1:1的不少于200對(duì)的試驗(yàn)�����;單組目標(biāo)值試驗(yàn)以靶病變失敗率(TLF)為主要研究終點(diǎn),樣本量應(yīng)不少于800例,其中部分病例可來(lái)源于隨機(jī)對(duì)照試驗(yàn)的試驗(yàn)組��。本文列選的臨床試驗(yàn)研究中有5個(gè)冠狀動(dòng)脈支架開(kāi)展了200對(duì)以上的試驗(yàn),實(shí)際上還有上市后臨床試驗(yàn)的要求但是不在本文討論范圍內(nèi)���。
對(duì)于心臟瓣膜類產(chǎn)品,2019年發(fā)布的《經(jīng)導(dǎo)管植入式人工主動(dòng)脈瓣膜臨床試驗(yàn)指導(dǎo)原則》[14]要求境外已上市產(chǎn)品在我國(guó)開(kāi)展臨床試驗(yàn),但樣本量要求較低,也未強(qiáng)調(diào)隨機(jī)對(duì)照試驗(yàn)。具體要求為:在有境外良好數(shù)據(jù)的前提下,在我國(guó)境內(nèi)需開(kāi)展樣本量不少于50例的臨床試驗(yàn)�����。本文列選的臨床試驗(yàn)研究中有2個(gè)主動(dòng)脈瓣,其樣本量分別為62例和65例�����。
2018年發(fā)布的《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》更規(guī)范、科學(xué),旨在為申請(qǐng)人通過(guò)醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)申報(bào)注冊(cè)以及監(jiān)管部門(mén)對(duì)該類臨床試驗(yàn)數(shù)據(jù)的審評(píng)提供技術(shù)指導(dǎo),避免或減少重復(fù)性臨床試驗(yàn),加快醫(yī)療器械在我國(guó)上市進(jìn)程���。從國(guó)家藥品監(jiān)管部門(mén)公布的相關(guān)數(shù)據(jù)來(lái)看,已經(jīng)有一些產(chǎn)品通過(guò)該途徑獲批在國(guó)內(nèi)上市,免于國(guó)內(nèi)臨床試驗(yàn)�����。此外,為了使相關(guān)單位更好地理解關(guān)于如何界定的不同因素對(duì)臨床數(shù)據(jù)產(chǎn)生有臨床意義影響,該指導(dǎo)原則特意列舉了2個(gè)具有人群差異的產(chǎn)品,即脈搏血氧儀設(shè)備和用于遺傳病基因檢測(cè)的體外診斷試劑��。
2020年發(fā)布的《真實(shí)世界數(shù)據(jù)用于醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》[15]在可考慮將真實(shí)世界證據(jù)用于醫(yī)療器械臨床評(píng)價(jià)的常見(jiàn)情形中列出:臨床急需進(jìn)口醫(yī)療器械在國(guó)內(nèi)特許使用中產(chǎn)生的真實(shí)世界數(shù)據(jù),可用于支持產(chǎn)品注冊(cè),作為已有證據(jù)的補(bǔ)充���。當(dāng)前在海南博鰲開(kāi)展的臨床真實(shí)世界數(shù)據(jù)應(yīng)用試點(diǎn)工作正是該項(xiàng)政策的重要體現(xiàn),因此本文也納入了截至2022年12月的6個(gè)醫(yī)療器械真實(shí)世界研究項(xiàng)目。
4�����、展 望
本文納入的臨床試驗(yàn)以心血管領(lǐng)域的產(chǎn)品為主,特別是冠狀動(dòng)脈藥物支架,因藥物支架是以醫(yī)療器械為主的藥械組合產(chǎn)品,因產(chǎn)品的特殊性,國(guó)家藥品監(jiān)管部門(mén)要求相關(guān)單位在我國(guó)境內(nèi)開(kāi)展臨床試驗(yàn)�����。從臨床實(shí)踐的角度來(lái)看,目前全球范圍內(nèi)冠狀動(dòng)脈藥物支架的使用尚未發(fā)現(xiàn)具有明顯的人群差異,未來(lái)隨著臨床實(shí)踐大量數(shù)據(jù)的積累,境外已上市產(chǎn)品在充分的境外臨床數(shù)據(jù)基礎(chǔ)之上,是否可以減少或者免除臨床試驗(yàn),值得研究人員關(guān)注與探討��。
2018年發(fā)布的《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》,要求在提供境外數(shù)據(jù)時(shí)應(yīng)分析技術(shù)審評(píng)要求的差異�����、受試人群的差異及臨床試驗(yàn)條件的差異,其中較難把握的是受試人群的差異。國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心網(wǎng)站的審評(píng)論壇中有兩個(gè)問(wèn)答可以為上述難點(diǎn)提供一些思路:一個(gè)是“通過(guò)臨床試驗(yàn)路徑開(kāi)展臨床評(píng)價(jià)時(shí),指導(dǎo)原則中要求除提供境外臨床試驗(yàn)數(shù)據(jù),仍需在中國(guó)境內(nèi)開(kāi)展臨床試驗(yàn),申請(qǐng)人是否需開(kāi)展臨床試驗(yàn)”,回答為“《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》第四條中已明確‘若特定醫(yī)療器械的技術(shù)審評(píng)指導(dǎo)原則中含有對(duì)其臨床試驗(yàn)的相關(guān)要求,該器械境外臨床試驗(yàn)應(yīng)考慮有關(guān)要求,存在不一致時(shí),應(yīng)提供充分�����、合理的理由和依據(jù)’���。因此,若申請(qǐng)人已經(jīng)按照《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》提交了符合倫理、依法���、科學(xué)原則的臨床試驗(yàn)數(shù)據(jù),且充分考慮了技術(shù)審評(píng)要求的差異���、受試人群的差異、臨床試驗(yàn)條件差異,可不在中國(guó)境內(nèi)額外開(kāi)展臨床試驗(yàn)��。”另一個(gè)是“《需進(jìn)行臨床試驗(yàn)審批的第三類醫(yī)療器械目錄》中的產(chǎn)品是否可以用境外臨床試驗(yàn)資料進(jìn)行申報(bào)�����?臨床試驗(yàn)是否還需在中國(guó)境內(nèi)進(jìn)行審批”,回答為“根據(jù)2018年1月發(fā)布的《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》,列入《需進(jìn)行臨床試驗(yàn)審批的第三類醫(yī)療器械目錄》(下稱《目錄》)的醫(yī)療器械,亦可按照上述指導(dǎo)原則要求用境外臨床試驗(yàn)數(shù)據(jù)進(jìn)行申報(bào)�����。對(duì)于產(chǎn)品境外臨床試驗(yàn)資料不符合相應(yīng)要求,仍需在中國(guó)境內(nèi)進(jìn)行臨床試驗(yàn)的《目錄》中產(chǎn)品,臨床試驗(yàn)仍需審批后方能開(kāi)展�����。”這兩個(gè)解讀可為相關(guān)企業(yè)提供臨床試驗(yàn)工作思路,減輕企業(yè)負(fù)擔(dān),節(jié)約社會(huì)資源,同時(shí)也能使患者及時(shí)獲益。相關(guān)文件的修訂與發(fā)布規(guī)范了我國(guó)臨床試驗(yàn)的發(fā)展方向,這也符合本文發(fā)現(xiàn)近年來(lái)外資企業(yè)在我國(guó)開(kāi)展上市前臨床試驗(yàn)數(shù)量下降的趨勢(shì)�����。
目前,我國(guó)參與國(guó)際多中心臨床研究上市前臨床試驗(yàn)的案例并不多,其中開(kāi)展臨床試驗(yàn)的前期準(zhǔn)備時(shí)間較長(zhǎng)是重要原因之一�����。此外,如果產(chǎn)品檢驗(yàn)及人類遺傳資源審批這兩個(gè)節(jié)點(diǎn)能有所突破(如2021年修訂的《醫(yī)療器械監(jiān)督管理?xiàng)l例》對(duì)自檢報(bào)告的認(rèn)可),我國(guó)同步參與全球研究的項(xiàng)目將會(huì)有所增長(zhǎng)�����。
是否開(kāi)展臨床試驗(yàn),對(duì)于企業(yè)來(lái)說(shuō)是重大的決策�����。2021年發(fā)布的《決策是否開(kāi)展醫(yī)療器械臨床試驗(yàn)技術(shù)指導(dǎo)原則》《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》[16]等系列文件,對(duì)于相關(guān)企業(yè)具有重要的指導(dǎo)意義���。但是在實(shí)際操作層面上,可能還是會(huì)存在各方理解的偏差�����。因此,希望在是否需要開(kāi)展臨床試驗(yàn)及對(duì)臨床試驗(yàn)等關(guān)鍵的問(wèn)題上監(jiān)管部門(mén)能開(kāi)展更多的溝通,以減少臨床試驗(yàn)中的不確定性�����。
醫(yī)療器械更新?lián)Q代速度快,這對(duì)監(jiān)管部門(mén)和企業(yè)來(lái)說(shuō)都是挑戰(zhàn)���。是否需要開(kāi)展臨床試驗(yàn)(特別是在有境外臨床數(shù)據(jù)的基礎(chǔ)上)及如何開(kāi)展臨床試驗(yàn),將是監(jiān)管部門(mén)�����、企業(yè)及研究人員持續(xù)關(guān)注的問(wèn)題。國(guó)家藥品監(jiān)管部門(mén)一直在探索前進(jìn),外資企業(yè)在國(guó)內(nèi)開(kāi)展臨床試驗(yàn)的圖景將逐漸明晰起來(lái),相信未來(lái)將會(huì)有更多的安全有效的醫(yī)療器械引入我國(guó),造?�;颊?��。
引用本文
曾治宇,韓磊,張曉星,彭琳,曾理.關(guān)于醫(yī)療器械外資企業(yè)在我國(guó)開(kāi)展上市前臨床試驗(yàn)的探討[J].中國(guó)食品藥品監(jiān)管,2023(8):38-45.