摘 要 / Abstract
習(xí)近平總書(shū)記強(qiáng)調(diào)��,生物醫(yī)藥產(chǎn)業(yè)是關(guān)系國(guó)計(jì)民生和國(guó)家安全的戰(zhàn)略性新興產(chǎn)業(yè)��。要加強(qiáng)基礎(chǔ)研究和科技創(chuàng)新能力建設(shè)����,把生物醫(yī)藥產(chǎn)業(yè)發(fā)展的命脈牢牢掌握在我們自己手中。醫(yī)療器械產(chǎn)業(yè)作為生物醫(yī)藥產(chǎn)業(yè)的重要組成部分����,醫(yī)療器械注冊(cè)審查指導(dǎo)原則的科學(xué)性是其基礎(chǔ)研究能力的重點(diǎn)體現(xiàn)之一,醫(yī)療器械上市前安全有效性評(píng)價(jià)的科學(xué)性是其科技創(chuàng)新能力的影響因素之一����。本文從指導(dǎo)原則體系的規(guī)劃、程序��、分布�、結(jié)構(gòu)、管理等方面����,對(duì)比分析中國(guó)、美國(guó)����、歐盟、日本等指導(dǎo)原則現(xiàn)狀��,呈現(xiàn)我國(guó)指導(dǎo)原則體系建設(shè)的特點(diǎn)�。按照國(guó)家藥監(jiān)局“提前介入、一企一策、全程指導(dǎo)����、研審聯(lián)動(dòng)”的要求,通過(guò)調(diào)研明確我國(guó)指導(dǎo)原則體系建設(shè)的下一步重點(diǎn)工作����,以期進(jìn)一步發(fā)揮指導(dǎo)原則提高科學(xué)審評(píng)能力、促進(jìn)產(chǎn)業(yè)高質(zhì)量發(fā)展的作用�。
General Secretary Xi Jinping has stressed that the biomedical industry is a strategic emerging industry crucial to national economy, people's livelihood, and national security. It is necessary to strengthen basic research and scientific and technological innovation capabilities and maintain control over the development of the biomedical industry. As an important part of the biomedical industry, the quality of guidance practices for medical device registration review is a key manifestation of its basic research ability, and the scientific evaluation of safety and effectiveness of medical devices before premarket is a determinant of its scientific and technological innovation ability. This paper compares and analyzes the current status of guidance practices in China, the United States, the European Union, and Japan from six aspects: planning, procedures, distribution, structure, and management of guidance practices systems, highlighting the characteristics of China’s Good Guidance Practices system construction. According to NMPA’s requirements of "early intervention, tailored approach for each enterprise, whole-process guidance, and integration of research and evaluation", the next key work for the construction of Good Guidance Practices in China is clarified through investigation, aiming to maximize the role of Good Guidance Practices in enhancing scientific evaluation capabilities and promoting high-quality development of the industry.
關(guān) 鍵 詞 / Key words
醫(yī)療器械;指導(dǎo)原則����;體系;審評(píng)科學(xué)����;高質(zhì)量發(fā)展
medical devices, guidance practices, system, evaluation science, high-quality development
當(dāng)前,全球醫(yī)療器械科技創(chuàng)新方興未艾����,市場(chǎng)規(guī)模持續(xù)擴(kuò)大。弗若斯特沙利文機(jī)構(gòu)(Frost & Sullivan)預(yù)測(cè)�,未來(lái)5 年醫(yī)療器械產(chǎn)值年均復(fù)合增長(zhǎng)率將達(dá)4.4%�,到2027 年,醫(yī)療器械產(chǎn)業(yè)規(guī)模將突破5100 億美元[1]。醫(yī)療器械涉及聲����、光、電����、磁、材料�、臨床醫(yī)學(xué)等多個(gè)專業(yè),具有學(xué)科交叉廣泛��、技術(shù)知識(shí)密集�、產(chǎn)業(yè)創(chuàng)新活躍等鮮明特點(diǎn),是衡量一個(gè)國(guó)家/ 地區(qū)高科技發(fā)展綜合實(shí)力的重要標(biāo)志之一[2]��。
習(xí)近平總書(shū)記強(qiáng)調(diào)�,生物醫(yī)藥產(chǎn)業(yè)是關(guān)系國(guó)計(jì)民生和國(guó)家安全的戰(zhàn)略性新興產(chǎn)業(yè),要加強(qiáng)基礎(chǔ)研究和科技創(chuàng)新能力建設(shè)����,把生物醫(yī)藥產(chǎn)業(yè)發(fā)展的命脈牢牢掌握在我們自己手中[3]。醫(yī)療器械產(chǎn)業(yè)是生物醫(yī)藥產(chǎn)業(yè)的重要組成部分之一�,與藥品、醫(yī)療技術(shù)并駕齊驅(qū)��,共同構(gòu)成完整的醫(yī)療服務(wù)體系[4]。醫(yī)療器械監(jiān)督管理遵循風(fēng)險(xiǎn)管理����、全程管控、科學(xué)監(jiān)管��、社會(huì)共治的原則[5]����。對(duì)醫(yī)療器械進(jìn)行上市前安全性、有效性的評(píng)價(jià)(技術(shù)審評(píng))是國(guó)際通用的監(jiān)督管理模式����,具有高度的專業(yè)性和技術(shù)性。
醫(yī)療器械注冊(cè)審查指導(dǎo)原則的科學(xué)性是醫(yī)療器械產(chǎn)業(yè)基礎(chǔ)研究能力的重點(diǎn)體現(xiàn)之一��,醫(yī)療器械上市前安全有效性評(píng)價(jià)的科學(xué)性是醫(yī)療器械產(chǎn)業(yè)科技創(chuàng)新能力的影響因素之一����。醫(yī)療器械技術(shù)審評(píng)機(jī)構(gòu)要加強(qiáng)基礎(chǔ)研究和科技創(chuàng)新能力建設(shè),構(gòu)建與我國(guó)醫(yī)療器械產(chǎn)業(yè)發(fā)展相適應(yīng)的指導(dǎo)原則體系�,筑牢審評(píng)科學(xué)的技術(shù)文件根基�,從而推動(dòng)醫(yī)療器械監(jiān)管效能,進(jìn)一步助力��、引導(dǎo)醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展[6]。
1����、指導(dǎo)原則體系
醫(yī)療器械注冊(cè)審查指導(dǎo)原則(以下簡(jiǎn)稱指導(dǎo)原則)是由醫(yī)療器械技術(shù)審評(píng)機(jī)構(gòu)制定��,面向技術(shù)審評(píng)人員��、注冊(cè)申請(qǐng)人��、社會(huì)公眾�,用以配套上市前監(jiān)管政策的執(zhí)行或明確注冊(cè)技術(shù)審評(píng)要求的指導(dǎo)性文件。指導(dǎo)原則體系是醫(yī)療器械技術(shù)審評(píng)機(jī)構(gòu)制定��、發(fā)布和使用指導(dǎo)原則的程序和規(guī)范[7]��。
從內(nèi)容來(lái)看��,指導(dǎo)原則可分為通用類指導(dǎo)原則和產(chǎn)品類指導(dǎo)原則�。通用類指導(dǎo)原則是以《醫(yī)療器械監(jiān)督管理?xiàng)l例》以及配套法規(guī)、規(guī)范性文件為基準(zhǔn)��,進(jìn)一步明確注冊(cè)申報(bào)的程序要求�、資料內(nèi)容、評(píng)價(jià)要點(diǎn)等的文件�。產(chǎn)品類指導(dǎo)原則是以《醫(yī)療器械安全和性能的基本原則》為核心����,基于產(chǎn)品特點(diǎn)�,明確監(jiān)管產(chǎn)品的設(shè)計(jì)、生產(chǎn)��、驗(yàn)證����、確認(rèn)、標(biāo)識(shí)等內(nèi)容的文件����。
指導(dǎo)原則是醫(yī)療器械技術(shù)審評(píng)過(guò)程中制定的共識(shí)文件,同時(shí)具有解讀法律法規(guī)規(guī)范����、指導(dǎo)注冊(cè)申報(bào)和適應(yīng)產(chǎn)業(yè)發(fā)展的屬性。指導(dǎo)原則作為醫(yī)療器械技術(shù)審評(píng)的新工具�、新方法、新標(biāo)準(zhǔn)��,是實(shí)現(xiàn)審評(píng)科學(xué)的必經(jīng)路徑[8]����,是醫(yī)療器械監(jiān)管科學(xué)行動(dòng)計(jì)劃的重要產(chǎn)出��,是醫(yī)療器械產(chǎn)業(yè)高質(zhì)量發(fā)展的可靠保證����。同時(shí)����,考慮到醫(yī)療器械結(jié)構(gòu)組成復(fù)雜��,風(fēng)險(xiǎn)程度不一�,從事審評(píng)的工作人員,因知識(shí)結(jié)構(gòu)和專業(yè)背景各不相同����,對(duì)產(chǎn)品風(fēng)險(xiǎn)和受益的分析往往具有一定的主觀性,指導(dǎo)原則體系建設(shè)的作用在于審評(píng)思維的培養(yǎng)和審評(píng)認(rèn)知的統(tǒng)一����,使得審評(píng)員及時(shí)跟蹤產(chǎn)品相關(guān)的基礎(chǔ)研究成果,熟悉掌握法規(guī)要求和技術(shù)知識(shí)����,提煉審評(píng)獲得經(jīng)驗(yàn),梳理轉(zhuǎn)化成為指導(dǎo)原則�,為審評(píng)提供技術(shù)支持[4]��。
2��、指導(dǎo)原則體系的國(guó)際比較
使用指導(dǎo)原則開(kāi)展醫(yī)療器械上市前安全有效性評(píng)價(jià)是許多國(guó)家施行的監(jiān)管模式��。不同監(jiān)管機(jī)構(gòu)制定的指導(dǎo)原則基于自身監(jiān)管實(shí)際�,在指導(dǎo)原則的制定主體����、編制目的、管理模式等方面存在異同����,詳見(jiàn)表1。
(一)中國(guó)指導(dǎo)原則體系概況
中國(guó)第三類指導(dǎo)原則由國(guó)家藥品監(jiān)督管理局醫(yī)療器械技術(shù)審評(píng)中心(以下簡(jiǎn)稱器審中心)制定并發(fā)布����。第二類指導(dǎo)原則由器審中心組織省級(jí)醫(yī)療器械審評(píng)機(jī)構(gòu)編制,器審中心負(fù)責(zé)相關(guān)組織協(xié)調(diào)��、質(zhì)量把控和發(fā)布����。
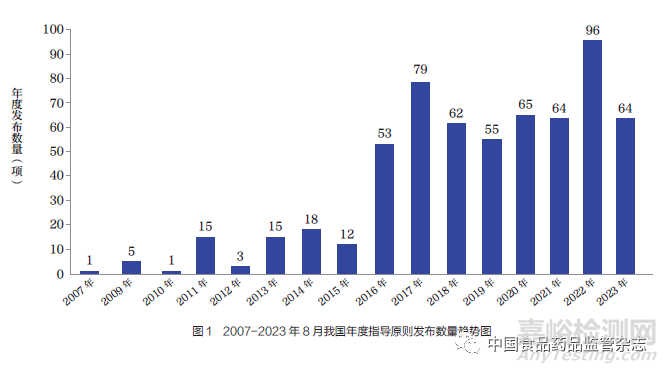
2007 年,我國(guó)發(fā)布第一項(xiàng)醫(yī)療器械指導(dǎo)原則。截至2023 年8 月底�,我國(guó)醫(yī)療器械指導(dǎo)原則制修訂數(shù)量已達(dá)608 項(xiàng)。自2016 年“十三五”規(guī)劃以來(lái)����,發(fā)布數(shù)量顯著提升,“十三五”“十四五”規(guī)劃期間發(fā)布的指導(dǎo)原則數(shù)量(含修訂)為538 項(xiàng)�,占發(fā)布總數(shù)的88.5%。2022 年發(fā)布了96 項(xiàng)指導(dǎo)原則�,為歷年發(fā)布數(shù)量之最(圖1)。
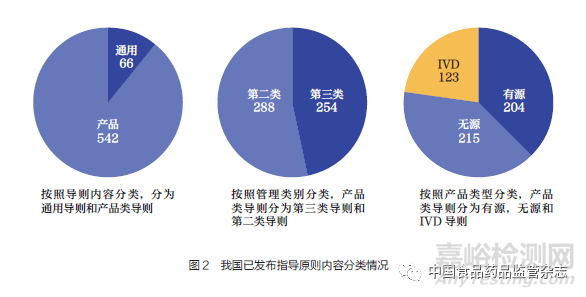
我國(guó)制修訂的通用類指導(dǎo)原則為66 項(xiàng)�,產(chǎn)品類指導(dǎo)原則為542 項(xiàng)��。產(chǎn)品類指導(dǎo)原則按照管理類別包括第三類指導(dǎo)原則和第二類指導(dǎo)原則��。產(chǎn)品類指導(dǎo)原則按照產(chǎn)品類型包括有源類�、無(wú)源類和體外診斷試劑類產(chǎn)品指導(dǎo)原則(圖2)。
(二)美國(guó)指導(dǎo)原則體系概況
美國(guó)醫(yī)療器械監(jiān)管起步早�,經(jīng)過(guò)長(zhǎng)期的經(jīng)驗(yàn)積累,美國(guó)食品藥品監(jiān)督管理局(Food and Drug Administration�,F(xiàn)DA)指導(dǎo)原則體系建設(shè)較為成熟。美國(guó)有關(guān)醫(yī)療器械指導(dǎo)原則的制定等工作由FDA 下屬醫(yī)療器械和輻射健康中心(Center for Devices and Radiological Health����,CDRH)承擔(dān)。FDA 于1997 年發(fā)布了良好指導(dǎo)原則規(guī)范(Good Guidance Practices,GGP)草案����,明確了FDA 指導(dǎo)原則文件制定、發(fā)布和使用的基本要求[7]�。該文件申明了FDA 指導(dǎo)原則不具有強(qiáng)制力,但同時(shí)強(qiáng)調(diào)了對(duì)FDA 工作人員的約束力����,F(xiàn)DA 工作人員僅在有正當(dāng)理由和監(jiān)管同意的情況下才可違背指導(dǎo)原則文件要求開(kāi)展審評(píng)工作。
CDRH 公開(kāi)了指導(dǎo)原則制定標(biāo)準(zhǔn)操作規(guī)程�,詳細(xì)介紹了指導(dǎo)原則發(fā)文流程。此外��,CDRH 每財(cái)年發(fā)布指導(dǎo)原則清單�,包括本年度擬制定指導(dǎo)原則和擬開(kāi)展回顧性審查的指導(dǎo)原則,對(duì)部分既往已發(fā)布指導(dǎo)原則進(jìn)行回顧性審查�,接收外部反饋信息,并適時(shí)進(jìn)行修訂��,進(jìn)一步加強(qiáng)了監(jiān)管的透明度和公眾參與性�。截至2023 年8 月底,通過(guò)FDA 官方網(wǎng)站查詢到��,F(xiàn)DA 醫(yī)療器械指導(dǎo)原則文件共約1100 余項(xiàng)����,其中通用程序性指導(dǎo)原則84 項(xiàng)��,通用技術(shù)性指導(dǎo)原則430 項(xiàng)�,有源產(chǎn)品類指導(dǎo)原則284 項(xiàng)�,無(wú)源產(chǎn)品類指導(dǎo)原則182 項(xiàng)�,體外診斷試劑(In Vitro Diagnostic Devices,IVD)產(chǎn)品類指導(dǎo)原則128 項(xiàng)����。
(三)歐盟指導(dǎo)原則體系概況
歐盟由第三方公告機(jī)構(gòu)(Notified Body,NB)進(jìn)行上市前審評(píng)�,歐盟委員會(huì)及成員國(guó)家主管部門(mén)負(fù)責(zé)監(jiān)督和管理第三方公告機(jī)構(gòu)。為幫助醫(yī)療器械生產(chǎn)企業(yè)��、公告機(jī)構(gòu)等利益相關(guān)方更好地理解�、執(zhí)行醫(yī)療器械相關(guān)法規(guī)��,歐盟委員會(huì)發(fā)布了一系列指導(dǎo)原則文件�。
歐盟醫(yī)療器械指導(dǎo)原則文件類型包括:對(duì)特定醫(yī)療器械產(chǎn)品定義范圍的進(jìn)一步闡釋,醫(yī)療器械產(chǎn)品性能評(píng)估基本要求�,醫(yī)療器械分類規(guī)則,公告機(jī)構(gòu)審查認(rèn)證評(píng)定程序��,臨床評(píng)價(jià)相關(guān)要求等。
自醫(yī)療器械法規(guī)(第 2017/745 號(hào))和體外診斷醫(yī)療器械法規(guī)( 第 2017/746 號(hào)) 實(shí)施以來(lái)��,歐盟委員會(huì)下設(shè)的公共衛(wèi)生部的醫(yī)療器械協(xié)調(diào)小組(Medical Device Coordination Group�,MDCG),根據(jù)歐盟委員會(huì)的要求�,組織制定了多項(xiàng)闡釋醫(yī)療器械法規(guī)的指導(dǎo)原則[9],加大了指導(dǎo)原則的編制力度����,進(jìn)一步規(guī)范了公告機(jī)構(gòu)的審查要求����。據(jù)不完全統(tǒng)計(jì),歐盟委員會(huì)已發(fā)布指導(dǎo)原則150余項(xiàng)�,征求意見(jiàn)稿60 余項(xiàng)��。
(四)日本指導(dǎo)原則體系概況
日本厚生勞動(dòng)?���。∕inistry of Health, Labour and Welfare�,MHLW) 是日本負(fù)責(zé)醫(yī)療衛(wèi)生和社會(huì)保障的主要部門(mén)��,其下設(shè)獨(dú)立法人機(jī)構(gòu)日本藥品和醫(yī)療器械管理局(Pharmaceuticals and Medical Devices Agency,PMDA) 是醫(yī)療器械監(jiān)管的主要職責(zé)部門(mén)��。日本醫(yī)療器械的上市前許可方式為委托管理與直接管理相結(jié)合����,對(duì)于有且符合該產(chǎn)品適用的審查依據(jù)性文件的醫(yī)療器械����,應(yīng)當(dāng)采取第三方認(rèn)證機(jī)構(gòu)認(rèn)證方式獲得上市許可,否則需PMDA 進(jìn)行審評(píng)��、日本厚生勞動(dòng)省承認(rèn)后�,獲得上市許可。
為適應(yīng)不同的上市前許可路徑��,日本醫(yī)療器械注冊(cè)審查依據(jù)性文件也存在多種類型��,包括認(rèn)證基準(zhǔn)����、承認(rèn)基準(zhǔn)以及審查指導(dǎo)原則[10]�。認(rèn)證基準(zhǔn)由厚生勞動(dòng)省發(fā)布,用于供審查醫(yī)療器械申請(qǐng)的注冊(cè)認(rèn)證機(jī)構(gòu)評(píng)估醫(yī)療器械的合規(guī)性����。承認(rèn)基準(zhǔn)是指厚生勞動(dòng)省認(rèn)可的國(guó)際標(biāo)準(zhǔn)化組織(International Organization for Standardization����,ISO)或國(guó)際電工委員會(huì)(International Electrotechnical Commission ��,IEC) 等國(guó)際組織發(fā)布的文件����。審查指導(dǎo)原則同樣由厚生勞動(dòng)省發(fā)布�,主要內(nèi)容為描述評(píng)估醫(yī)療器械安全性和有效性所需的主要技術(shù)要求和(或)驗(yàn)收標(biāo)準(zhǔn)等,幫助醫(yī)療器械生產(chǎn)企業(yè)更有效地對(duì)醫(yī)療器械進(jìn)行PMDA 審查�。截至2023 年8 月底,日本厚生勞動(dòng)省制定了950 個(gè)認(rèn)證基準(zhǔn)��、44 個(gè)承認(rèn)基準(zhǔn)和10 個(gè)審查指導(dǎo)原則��。
3��、我國(guó)指導(dǎo)原則體系的建設(shè)特點(diǎn)
通過(guò)對(duì)比分析中國(guó)����、美國(guó)、歐盟�、日本等國(guó)際監(jiān)管機(jī)構(gòu)指導(dǎo)原則體系概況��,我國(guó)指導(dǎo)原則體系呈現(xiàn)出全面(基本覆蓋全部子目錄)����、完善(基本建立指導(dǎo)原則體系)��、豐富(指導(dǎo)原則體系有效延伸)��、開(kāi)放(競(jìng)速真實(shí)世界研究賽道)的特點(diǎn)��。
(一)基本覆蓋全部子目錄
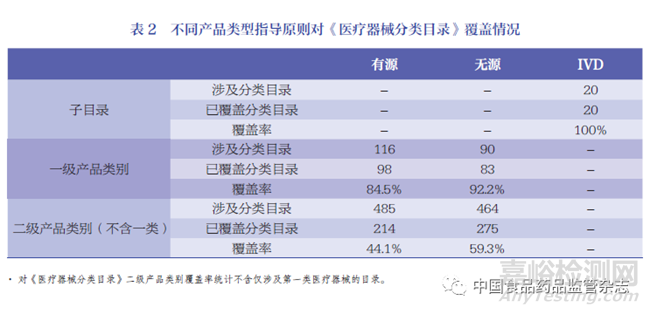
為分析我國(guó)醫(yī)療器械指導(dǎo)原則結(jié)構(gòu)的完整性�,審評(píng)人員曾在不同時(shí)期統(tǒng)計(jì)過(guò)產(chǎn)品類指導(dǎo)原則對(duì)應(yīng)一級(jí)產(chǎn)品類別的覆蓋率[11-12]。目前����,醫(yī)療器械產(chǎn)品類指導(dǎo)原則已全部覆蓋《醫(yī)療器械分類目錄》的22 個(gè)子目錄,覆蓋率100% ��;覆蓋一級(jí)產(chǎn)品類別181 個(gè)��,覆蓋率為87.9% ��;覆蓋二級(jí)產(chǎn)品類別489 個(gè)�,覆蓋率為51.5%(不含第一類醫(yī)療器械)�。已發(fā)布指導(dǎo)原則對(duì)醫(yī)療器械分類目錄按產(chǎn)品類別有源�、無(wú)源��、IVD 分類覆蓋情況見(jiàn)表2�。《體外診斷試劑分類子目錄》的20 個(gè)產(chǎn)品類別已實(shí)現(xiàn)全覆蓋�。
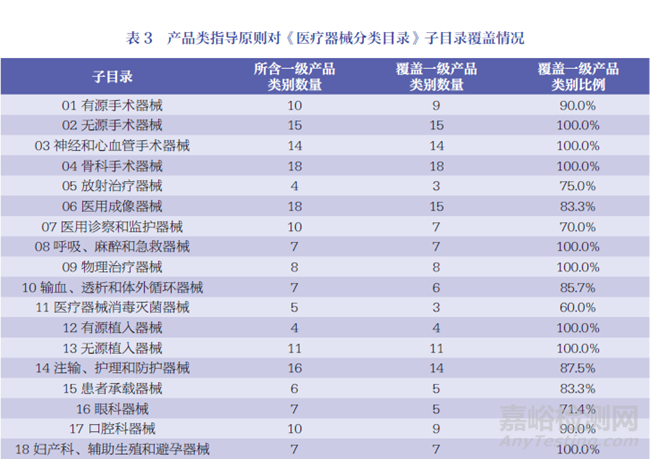
《醫(yī)療器械分類目錄》22 個(gè)子目錄中02、03��、04��、08����、09、12����、13、18����、21 等9 項(xiàng)子目錄的一級(jí)產(chǎn)品類別目錄已實(shí)現(xiàn)指導(dǎo)原則的全覆蓋,詳見(jiàn)表3����。
(二)基本建立指導(dǎo)原則體系
“十三五”以來(lái)�,我國(guó)醫(yī)療器械指導(dǎo)原則編制工作成效明顯�,指導(dǎo)原則的質(zhì)量和數(shù)量均有明顯提升。為應(yīng)對(duì)器械注冊(cè)管理及審評(píng)工作開(kāi)展的新形勢(shì)��,器審中心發(fā)布《醫(yī)療器械注冊(cè)審查指導(dǎo)原則“十四五”規(guī)劃》��,對(duì)指導(dǎo)原則的編制工作進(jìn)行科學(xué)規(guī)劃�,制定到2025 年的指導(dǎo)原則發(fā)展目標(biāo)。建設(shè)指導(dǎo)原則體系過(guò)程中��,器審中心堅(jiān)持科學(xué)性原則��,優(yōu)化指導(dǎo)原則編制流程�,編制了一系列制修訂操作規(guī)范,加強(qiáng)過(guò)程管理��,明確各環(huán)節(jié)的責(zé)任����、時(shí)限要求。
在指導(dǎo)原則體系建立過(guò)程中��,器審中心根據(jù)產(chǎn)品風(fēng)險(xiǎn)等級(jí)委托省級(jí)醫(yī)療器械審評(píng)機(jī)構(gòu)編制第二類醫(yī)療器械指導(dǎo)原則�,同時(shí)加強(qiáng)國(guó)家級(jí)和省級(jí)、省級(jí)技術(shù)審評(píng)機(jī)構(gòu)之間的交流和共享,協(xié)同促進(jìn)全國(guó)技術(shù)審評(píng)機(jī)構(gòu)監(jiān)管能力提升�。鼓勵(lì)生產(chǎn)企業(yè)、高等院校����、科研機(jī)構(gòu)����、臨床機(jī)構(gòu)等社會(huì)力量廣泛參與指導(dǎo)原則編制工作。通過(guò)器審云課堂的形式�,組織編制人員錄制指導(dǎo)原則培訓(xùn)視頻。截至目前��,器審中心已發(fā)布189 個(gè)第三類指導(dǎo)原則和42 個(gè)第二類指導(dǎo)原則的講解視頻�。
(三)指導(dǎo)原則體系有效延伸
指導(dǎo)原則體系有效延伸至醫(yī)療器械技術(shù)審評(píng)要點(diǎn)(以下簡(jiǎn)稱審評(píng)要點(diǎn))的管理。技術(shù)審評(píng)機(jī)構(gòu)以制定審評(píng)要點(diǎn)的形式����,對(duì)注冊(cè)申請(qǐng)項(xiàng)目相關(guān)技術(shù)信息和(或)相關(guān)領(lǐng)域科學(xué)研究的綜合分析,提煉出對(duì)醫(yī)療器械安全性�、有效性和質(zhì)量控制方面有重要影響的技術(shù)要求或?qū)徳u(píng)共識(shí),用于指導(dǎo)和規(guī)范技術(shù)審評(píng)工作����。隨著同類產(chǎn)品的后續(xù)申報(bào)(一般為3個(gè)及以上),產(chǎn)品類審評(píng)要點(diǎn)會(huì)通過(guò)分技術(shù)委員會(huì)集體決策的形式進(jìn)行完善,轉(zhuǎn)化為產(chǎn)品類指導(dǎo)原則向社會(huì)發(fā)布��。
器審中心對(duì)每一類醫(yī)療器械均編制了審評(píng)要點(diǎn)��,并及時(shí)公開(kāi)了一批創(chuàng)新醫(yī)療器械����、臨床急需醫(yī)療器械、應(yīng)對(duì)公共衛(wèi)生事件急需醫(yī)療器械等相關(guān)審評(píng)要點(diǎn)��,緩解了指導(dǎo)原則從立項(xiàng)到發(fā)布周期較長(zhǎng)無(wú)法匹配器械領(lǐng)域新技術(shù)��、新材料更迭速度快的缺陷��,發(fā)揮了指導(dǎo)原則體系及時(shí)規(guī)范�、早期指導(dǎo)的作用。
截至2023 年8 月底����,器審中心已制修訂審評(píng)要點(diǎn)761 項(xiàng),其中產(chǎn)品類審評(píng)要點(diǎn)333 項(xiàng)�,占比 43.8%,臨床評(píng)價(jià)類審評(píng)要點(diǎn)428 項(xiàng)��,占比56.2%��。
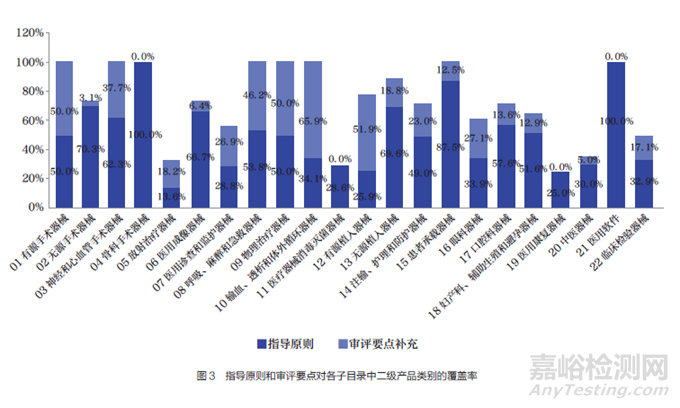
圖3 為指導(dǎo)原則和審評(píng)要點(diǎn)在各子目錄中二級(jí)產(chǎn)品類別的覆蓋率,其中��,深色為指導(dǎo)原則在子目錄中二級(jí)產(chǎn)品類別的覆蓋率�,淺色為審評(píng)要點(diǎn)補(bǔ)充后在該子目錄中二級(jí)產(chǎn)品類別的覆蓋率。
(四)競(jìng)速真實(shí)世界研究賽道
2023 年8 月 30 日����,美國(guó) FDA 發(fā)布了《使用真實(shí)世界數(shù)據(jù)(Real World Data��,RWD)和真實(shí)世界證據(jù)(Real World Evidence��,RWE)支持藥品和生物制品監(jiān)管決策的考量因素》[13]的指導(dǎo)原則�, 是FDA 建立的RWE 計(jì)劃框架[14] 的最新文件,重申了真實(shí)世界研究(Real World Study, RWS) 無(wú)需申請(qǐng)新藥臨床研究(Investigational New Drug��,IND)����,增加了受理前的溝通交流,明確了監(jiān)管決策所期望的RWD/RWE����。
RWD/RWE 在醫(yī)療器械領(lǐng)域同樣有廣闊的應(yīng)用前景。RWD/RWE 用于臨床評(píng)價(jià)��,與傳統(tǒng)臨床試驗(yàn)形成互補(bǔ),共同促進(jìn)醫(yī)療器械監(jiān)管和決策��。中國(guó)藥品監(jiān)管科學(xué)行動(dòng)計(jì)劃將“真實(shí)世界數(shù)據(jù)用于醫(yī)療器械臨床評(píng)價(jià)的方法學(xué)研究”列為第一批9 個(gè)行動(dòng)計(jì)劃項(xiàng)目中的一項(xiàng)��,隨后依然將“真實(shí)世界數(shù)據(jù)支持創(chuàng)新和臨床急需醫(yī)療器械評(píng)價(jià)方法研究” 列為第二批10 個(gè)行動(dòng)計(jì)劃項(xiàng)目的一項(xiàng)�。
依托于中國(guó)藥品監(jiān)管科學(xué)行動(dòng)計(jì)劃,RWS 取得一系列重要成果��,包括發(fā)布《真實(shí)世界數(shù)據(jù)用于醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》��,批準(zhǔn)多個(gè)使用境內(nèi)真實(shí)世界數(shù)據(jù)的醫(yī)療器械產(chǎn)品����,建設(shè)海南博鰲樂(lè)城先行區(qū)醫(yī)療器械臨床真實(shí)世界數(shù)據(jù)研究平臺(tái),運(yùn)行真實(shí)世界數(shù)據(jù)應(yīng)用前置溝通機(jī)制等�。
4、相關(guān)思考及探討
學(xué)習(xí)貫徹習(xí)近平新時(shí)代中國(guó)特色社會(huì)主義思想主題教育開(kāi)展以來(lái)����,器審中心提升科學(xué)審評(píng)能力調(diào)研組問(wèn)策于實(shí)踐,取經(jīng)于實(shí)踐�,就如何編制準(zhǔn)確性高、規(guī)范性好��、實(shí)用性強(qiáng)����、滿意度優(yōu)的指導(dǎo)原則�,進(jìn)行深入調(diào)研�、積極思考。下一步����,建議技術(shù)審評(píng)機(jī)構(gòu)緊緊圍繞國(guó)家藥監(jiān)局“提前介入、一企一策�、全程指導(dǎo)、研審聯(lián)動(dòng)”的要求����,牢牢把握好鼓勵(lì)創(chuàng)新發(fā)展和保障科學(xué)審評(píng)的關(guān)系��,通過(guò)有效運(yùn)行指導(dǎo)原則體系�,加強(qiáng)指導(dǎo)原則全鏈條管理,加快指導(dǎo)原則制修訂頻率����,優(yōu)化指導(dǎo)原則結(jié)構(gòu)布局,對(duì)接國(guó)際指導(dǎo)原則進(jìn)行轉(zhuǎn)化�。
(一)深化落實(shí)“放管服”要求,加強(qiáng)指導(dǎo)原則全鏈條管理
全鏈條管理是一種思維方式����。通過(guò)有效運(yùn)行指導(dǎo)原則體系����,把握并串聯(lián)指導(dǎo)原則立項(xiàng)��、編制����、審校、發(fā)布��、培訓(xùn)�、使用、評(píng)估�、修訂等全環(huán)節(jié),提高指導(dǎo)原則的質(zhì)量和價(jià)值��。
在立項(xiàng)環(huán)節(jié)�,以揭榜掛帥形式確定指導(dǎo)原則編制主體;在編制環(huán)節(jié)��,明確各類指導(dǎo)原則的格式和內(nèi)容要求��,重視研發(fā)機(jī)構(gòu)�、臨床機(jī)構(gòu)����、檢測(cè)機(jī)構(gòu)等各方反饋意見(jiàn)����;在審核環(huán)節(jié),運(yùn)行分技術(shù)委員會(huì)集體審校機(jī)制����,試行第二類指導(dǎo)原則專家評(píng)審機(jī)制;在發(fā)布環(huán)節(jié)�,上報(bào)國(guó)家藥監(jiān)局審核同意后簡(jiǎn)化發(fā)布流程;在培訓(xùn)環(huán)節(jié)�,加大云課堂錄制力度,進(jìn)行宣貫�;在使用環(huán)節(jié)����,增加指導(dǎo)原則關(guān)鍵詞標(biāo)簽,以分類目錄為架構(gòu)搭建指導(dǎo)原則查詢下載平臺(tái)��;在評(píng)估環(huán)節(jié)����,發(fā)布五年以上的指導(dǎo)原則均列入評(píng)估范圍����;在修訂環(huán)節(jié)����,綜合運(yùn)用評(píng)估結(jié)果建立快速修訂、微小修訂��、合并修訂和全面修訂模式��。
(二)鼓勵(lì)醫(yī)療器械創(chuàng)新�,加快指導(dǎo)原則制修訂頻率
當(dāng)前,醫(yī)療器械的創(chuàng)新速度加快�,人工智能、生物材料�、3D 打印等新技術(shù)涌入醫(yī)療器械行業(yè),“主動(dòng)健康”“遠(yuǎn)程診療”“組合產(chǎn)品”“腦機(jī)接口”等多學(xué)科融合的醫(yī)療器械持續(xù)引發(fā)關(guān)注��。與此同時(shí)����,真實(shí)世界證據(jù)、計(jì)算機(jī)建模��、器官芯片、類器官等新方法逐漸取代傳統(tǒng)臨床療效的確認(rèn)方式��,降低了醫(yī)療器械的研發(fā)成本����,進(jìn)一步加快創(chuàng)新產(chǎn)品上市步伐[2]。
在器審中心提升科學(xué)審評(píng)能力調(diào)研組開(kāi)展的調(diào)研座談過(guò)程中�,多位醫(yī)療器械生產(chǎn)企業(yè)的研發(fā)人員、有意進(jìn)行產(chǎn)品轉(zhuǎn)化的臨床醫(yī)生�,均表示希望盡快發(fā)布適合本領(lǐng)域的、提供解決路徑的�、指導(dǎo)價(jià)值高的指導(dǎo)原則,認(rèn)為這便是不斷創(chuàng)新的“助推劑”和抵御風(fēng)險(xiǎn)的“壓艙石”����。國(guó)家藥監(jiān)局“十四五”以來(lái)發(fā)布的多項(xiàng)指導(dǎo)原則定位于國(guó)家重點(diǎn)研發(fā)計(jì)劃、中國(guó)藥品監(jiān)管科學(xué)行動(dòng)計(jì)劃�、重點(diǎn)領(lǐng)域創(chuàng)新任務(wù)揭榜掛帥項(xiàng)目的成果產(chǎn)出。下一步更是需秉持“一企一策”的服務(wù)理念����,及時(shí)制定未上市產(chǎn)品的審評(píng)要點(diǎn)��,加大創(chuàng)新產(chǎn)品指導(dǎo)原則的發(fā)布力度��,第一時(shí)間修訂與產(chǎn)業(yè)發(fā)展脫節(jié)的指導(dǎo)原則內(nèi)容��,依托前沿科技攻關(guān),進(jìn)行審評(píng)重心前移�,協(xié)同加快產(chǎn)品上市步伐。
(三)以學(xué)促干提升科學(xué)審評(píng)能力��,優(yōu)化指導(dǎo)原則結(jié)構(gòu)布局
單從數(shù)量看��,現(xiàn)階段我國(guó)制定發(fā)布的通用類指導(dǎo)原則僅占10%����,但正是占比10% 的指導(dǎo)原則,在解讀監(jiān)管法規(guī)��、闡釋審評(píng)理念等方面發(fā)揮了關(guān)鍵的作用����。安全和性能基本原則、受益- 風(fēng)險(xiǎn)判定����、真實(shí)世界數(shù)據(jù)、附條件批準(zhǔn)等相關(guān)指導(dǎo)原則揭示了科學(xué)審評(píng)的新方法����,臨床評(píng)價(jià)、臨床試驗(yàn)設(shè)計(jì)、接受境外臨床試驗(yàn)數(shù)據(jù)�、等同性論證等相關(guān)指導(dǎo)原則成為科學(xué)審評(píng)的新工具,網(wǎng)絡(luò)安全研究����、動(dòng)物試驗(yàn)研究、注冊(cè)單元?jiǎng)澐?���、技術(shù)要求編寫(xiě)、體外診斷試劑說(shuō)明書(shū)編寫(xiě)等相關(guān)指導(dǎo)原則組成了科學(xué)審評(píng)的新標(biāo)準(zhǔn)�。
器審中心通過(guò)制定指導(dǎo)原則“十四五”規(guī)劃和年度編制計(jì)劃,正在逐步提高通用類指導(dǎo)原則的比例����,完善產(chǎn)品類臨床評(píng)價(jià)指導(dǎo)原則。目前�,醫(yī)療器械說(shuō)明書(shū)編寫(xiě)、真實(shí)世界研究設(shè)計(jì)和統(tǒng)計(jì)分析�、人因設(shè)計(jì)、可靠性研究�、體外診斷試劑主要原材料、穩(wěn)定性研究��、變更注冊(cè)等指導(dǎo)原則正在加緊編制��,擬于近期發(fā)布����。真實(shí)世界研究試點(diǎn)品種、計(jì)算機(jī)輔助診斷軟件��、心臟封堵器����、HIV 檢測(cè)試劑、腫瘤個(gè)體化治療相關(guān)基因突變檢測(cè)試劑的臨床研究指導(dǎo)原則也已立項(xiàng)��,將有效補(bǔ)充對(duì)相關(guān)產(chǎn)品設(shè)計(jì)開(kāi)發(fā)和臨床確認(rèn)的指導(dǎo)�。
(四)推進(jìn)全球醫(yī)療器械法規(guī)的監(jiān)管信賴,吸收轉(zhuǎn)化國(guó)際指導(dǎo)原則
2019 年6 月24 日起��,國(guó)家藥監(jiān)局正式啟用醫(yī)療器械注冊(cè)電子申報(bào)信息化(eRPS)系統(tǒng)����,開(kāi)始實(shí)施電子申報(bào)制度。通過(guò)轉(zhuǎn)化國(guó)際醫(yī)療器械監(jiān)管機(jī)構(gòu)論壇(International Medical Device Regulators Forum��,IMDRF)注冊(cè)申報(bào)工作組(Regulated Product Submission�,RPS) 文件[15],編制了《醫(yī)療器械注冊(cè)申請(qǐng)電子提交技術(shù)指南(試行)》��,成為全球首個(gè)實(shí)現(xiàn)全項(xiàng)目、全流程注冊(cè)申報(bào)電子化的國(guó)家[16]��。在之后《醫(yī)療器械監(jiān)督管理?xiàng)l例》配套規(guī)范性文件的修訂過(guò)程中�,以注冊(cè)申報(bào)資料電子目錄(Table of Contents,ToC)為基礎(chǔ)����,明確各目錄的注冊(cè)申報(bào)資料要求。IMDRF 管委會(huì)各成員國(guó)逐步認(rèn)識(shí)到其應(yīng)用價(jià)值����,積極推動(dòng)在本國(guó)醫(yī)療器械注冊(cè)監(jiān)管中使用國(guó)際統(tǒng)一的ToC,并一致認(rèn)為其是統(tǒng)一醫(yī)療器械產(chǎn)品電子提交格式的基礎(chǔ)[17]����。
eRPS 系統(tǒng)的上線、ToC 的國(guó)際應(yīng)用均已成為全球醫(yī)療器械法規(guī)監(jiān)管信賴的典型案例�。審評(píng)面向國(guó)際,審評(píng)出的產(chǎn)品才能走向國(guó)際����。技術(shù)審評(píng)機(jī)構(gòu)仍需持續(xù)密切關(guān)注美國(guó)、歐盟����、日本等成熟醫(yī)療器械監(jiān)管機(jī)構(gòu)的指導(dǎo)原則發(fā)布進(jìn)展����,根據(jù)指導(dǎo)原則體系的現(xiàn)有特點(diǎn)進(jìn)行規(guī)劃�、布局����。據(jù)不完全統(tǒng)計(jì),IMDRF 現(xiàn)行指導(dǎo)原則44 項(xiàng)��,全球醫(yī)療器械監(jiān)管法規(guī)協(xié)調(diào)會(huì)(Global Harmonization of MedicalDevice Regulation��,GHWP)制定指導(dǎo)原則56項(xiàng)����,共計(jì)100 項(xiàng)的國(guó)際醫(yī)療器械監(jiān)管共識(shí)文件可為成員所用,供成員進(jìn)行參考�、轉(zhuǎn)化和采用。
5����、結(jié) 語(yǔ)
我們應(yīng)積極應(yīng)對(duì)醫(yī)療器械新技術(shù)、新產(chǎn)品帶來(lái)的新挑戰(zhàn)��,堅(jiān)持審評(píng)科學(xué)理念��,面對(duì)科技創(chuàng)新發(fā)展趨勢(shì)、國(guó)際形勢(shì)風(fēng)險(xiǎn)考驗(yàn)����,制定和轉(zhuǎn)化醫(yī)療器械上市前安全性、有效性評(píng)價(jià)的新工具�、新方法、新標(biāo)準(zhǔn)����,努力提升指導(dǎo)原則的科學(xué)性、前瞻性和引領(lǐng)性��。指導(dǎo)原則與審評(píng)能力相輔相成�,指導(dǎo)原則體系讓兩者形成良性循環(huán)。通過(guò)制定指導(dǎo)原則����、運(yùn)行指導(dǎo)原則體系,技術(shù)審評(píng)機(jī)構(gòu)的審評(píng)人員方能在特定領(lǐng)域擁有深厚的專業(yè)知識(shí)和技能��,技術(shù)審評(píng)機(jī)構(gòu)的審評(píng)能力方能對(duì)行業(yè)重點(diǎn)領(lǐng)域進(jìn)行深入研究和理解����,技術(shù)審評(píng)機(jī)構(gòu)的審評(píng)結(jié)論方能具有國(guó)際認(rèn)可度和影響力。
引用本文
高國(guó)彪,仉琪,張世慶,姜雨萌.構(gòu)建醫(yī)療器械指導(dǎo)原則體系 筑牢注冊(cè)技術(shù)審評(píng)科學(xué)基礎(chǔ)[J].中國(guó)食品藥品監(jiān)管,2023(10):8-17.