病毒很小�����,變異很快�����,每天都會(huì)復(fù)制成千上萬(wàn)個(gè)自己�����。更確切地說(shuō)�����,是受感染的宿主細(xì)胞被挾持,成為產(chǎn)生這些新病毒拷貝的溫床�����。病毒無(wú)法自行繁殖�����,它們處于惰性狀態(tài)�����,直到侵入宿主細(xì)胞�����。
除了人體自身的免疫系統(tǒng)之外�����,抗病毒藥物是人類對(duì)抗病毒入侵的最重要的武器�����。但肆虐全球數(shù)年的SARS-CoV-2病毒�����,讓人類意識(shí)到了自身在對(duì)抗病毒時(shí)的困窘�����。其中一個(gè)很大的問(wèn)題在于病毒沒(méi)有很多屬于它們自己的蛋白質(zhì)和酶�����,可以作為藥物開發(fā)的目標(biāo)�����。病毒所擁有的少數(shù)蛋白和酶�����,也許只是在于執(zhí)行最基本的功能�����,即允許病毒進(jìn)入細(xì)胞�����、復(fù)制和逃逸,以及周而復(fù)始�����。即使如此�����,這些蛋白至的序列和結(jié)構(gòu)在跨病毒�����,甚至同一類病毒中也可能大相徑庭�����。所以�����,人類很難舉一反三地使用一種治療劑針對(duì)多種病毒�����。雪上加霜的是�����,由于缺乏可靠的動(dòng)物模型和投資�����,抗病毒藥物的開發(fā)顯然面臨嚴(yán)峻挑戰(zhàn)�����。
為什么抗病毒藥物難以開發(fā)�����?ACS旗下的C&EN做出了分析:
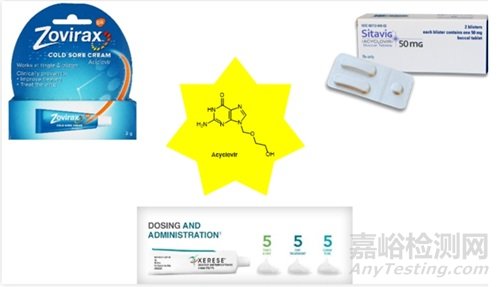
幾十年來(lái)�����,科學(xué)家們并不知道病毒是否有自己的酶�����。研究人員假設(shè)�����,被劫持的細(xì)胞只是利用細(xì)胞自身的酶和蛋白質(zhì)構(gòu)建了病毒的新副本。1967年�����,科學(xué)家發(fā)現(xiàn)了第一種病毒酶�����,一種痘病毒DNA-依賴型RNA聚合酶[1]�����。該酶采用病毒的DNA編碼基因組并將其轉(zhuǎn)錄為RNA�����,以開始生產(chǎn)新的病毒蛋白�����。在科學(xué)家確定了這些第一種病毒酶之后�����,他們就意識(shí)到他們可以設(shè)計(jì)針對(duì)病毒本身的藥物,但這個(gè)過(guò)程進(jìn)展得非常緩慢�����?����?共《舅幬锏拈_發(fā)一直落后于抗生素藥物的開發(fā)�����。除了針對(duì)疣和類似疾病的局部治療外�����,在acyclovir(阿昔洛韋�����,商品名:Sitavig, Xerese, Zovirax�����,如圖1)出現(xiàn)之前�����,抗病毒藥物的開發(fā)可謂舉步維艱�����。
圖1. Acylovir化學(xué)結(jié)構(gòu)
阿昔洛韋用于治療單純皰疹病毒感染�����、水痘和帶狀皰疹�����。該藥物于1974年獲得專利�����,并于80年代首次獲準(zhǔn)使用�����。
由于病毒胸苷激酶的作用�����,阿昔洛韋成為單磷酸阿昔洛韋。阿昔洛韋單磷酸通過(guò)鳥苷酸激酶轉(zhuǎn)化為二磷酸形式�����。隨后�����,阿昔洛韋二磷酸通過(guò)核苷二磷酸激酶等生化反應(yīng)�����,轉(zhuǎn)化為三磷酸阿昔洛韋[2]�����。三磷酸阿昔洛韋對(duì)病毒DNA聚合酶的親和力高于正常細(xì)胞的DNA聚合酶�����,并結(jié)合到DNA中�����,缺失的2'和3'碳會(huì)導(dǎo)致DNA鏈終止[3]�����。阿昔洛韋三磷酸與病毒DNA聚合酶的競(jìng)爭(zhēng)非常激烈�����,以至于其他堿基無(wú)法與該酶結(jié)合�����,從而使其失活�����。
與早期的抗病毒藥物不同�����,阿昔洛韋可以完全抑制病毒DNA聚合酶�����,而不會(huì)阻止細(xì)胞自身的酶�����,這意味著它幾乎不會(huì)引起主要副作用。從那以后�����,研究人員一直在嘗試采用類似的方法�����,直接靶向病毒蛋白�����。
宿主細(xì)胞感染和病毒復(fù)制的每個(gè)階段都給抗病毒藥物提供了機(jī)會(huì)�����。但是由于病毒僅編碼其自身的幾種蛋白質(zhì)�����,因此藥物可能只能靶向一種或兩種蛋白質(zhì)�����。這些病毒酶可能具有宿主細(xì)胞也具有的功能�����,因此靶向這些與人類蛋白相似的病毒酶�����,有良莠不分地?zé)o差別傷害健康人體細(xì)胞的可能性�����。這是抗病毒藥物開發(fā)的另一個(gè)難點(diǎn)�����。
盡管如此�����,多年來(lái)藥物開發(fā)人員已經(jīng)找到了安全靶向幾種關(guān)鍵病毒蛋白的方法�����,直接針對(duì)病毒蛋白�����,是面對(duì)新病毒威脅時(shí)的首選方案,尤其是那些負(fù)責(zé)DNA和RNA復(fù)制的聚合酶�����,因?yàn)檫@些病毒聚合酶在幾種病毒中通常很相似�����,這為開發(fā)廣譜抗病毒藥物提供了機(jī)會(huì)�����。
除了聚合酶之外�����,一些病毒用來(lái)將RNA轉(zhuǎn)化為DNA的逆轉(zhuǎn)錄酶(reverse transcriptases)一直是抗HIV的主要目標(biāo)�����。在細(xì)胞中負(fù)責(zé)切割病毒蛋白的蛋白酶(proteases)也一直是慢性感染(如HIV感染和丙型肝炎)和急性感染(如SARS-CoV-2)的靶標(biāo)�����。
廣譜抗病毒藥物開發(fā)之后�����,研究人員在大多數(shù)情況下只得讓藥物靶向特定病毒中的特定蛋白質(zhì)�����。但換個(gè)角度來(lái)看這個(gè)無(wú)奈之舉�����,靶向特定的病毒酶可以降低宿主酶受影響的風(fēng)險(xiǎn)�����,從而使藥物更安全�����。
與直接針對(duì)病毒開發(fā)抗病毒藥物形成正交策略的是�����,一些藥物開發(fā)商將他們的準(zhǔn)星瞄準(zhǔn)了宿主細(xì)胞,這種策略理論上可以產(chǎn)生對(duì)整個(gè)病毒家族有效的藥物�����。如果人們能夠影響宿主細(xì)胞�����,那么在某種程度上�����,病毒的身份和行為將變得不那么重要�����。這也算得上是“以我為主”的對(duì)敵策略了�����。這種方法使藥物更加靈活�����,而且病毒不太可能產(chǎn)生耐藥性�����。但是專注于宿主細(xì)胞同樣不可能萬(wàn)無(wú)一失�����,產(chǎn)生重大副作用的風(fēng)險(xiǎn)就更高�����。
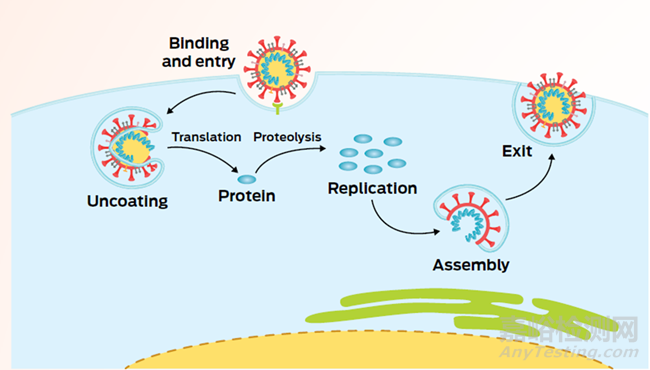
抗病毒藥物發(fā)現(xiàn)的挑戰(zhàn)不僅限于設(shè)計(jì)一種好的抑制劑�����。下一步是證明這種藥物有效�����,首先是在細(xì)胞中�����,然后是動(dòng)物�����,最后是人類。但是細(xì)胞和動(dòng)物模型與人體的差異�����,可能會(huì)給病毒研究創(chuàng)造新的障礙�����。例如�����,研究人員多年來(lái)一直在努力讓丙型肝炎在實(shí)驗(yàn)室的細(xì)胞中復(fù)制�����,這使他們能夠研究破壞單個(gè)蛋白質(zhì)如何影響病毒的生命周期�����。一旦藥物在培養(yǎng)皿中的細(xì)胞阻止了病毒�����,科學(xué)家們就需要在可靠的動(dòng)物模型中對(duì)其進(jìn)行測(cè)試�����,以提供生理相關(guān)的結(jié)果�����。藥物可以設(shè)計(jì)成在病毒進(jìn)入和離開細(xì)胞之間的許多時(shí)間點(diǎn)�����,中斷病毒的生命周期(圖2)�����。
圖2. 病毒感染宿主細(xì)胞以及復(fù)制的生命周期�����,來(lái)源:Nat. Rev. Microbiol.
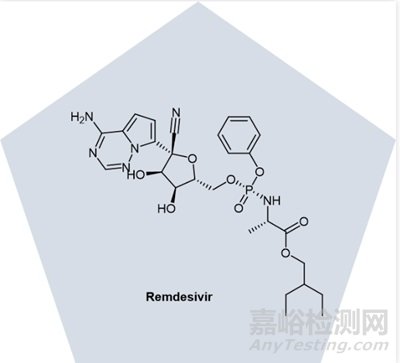
每種病毒都使用細(xì)胞蛋白并影響下游的細(xì)胞過(guò)程�����,這種復(fù)雜性并不總是能在動(dòng)物中模仿�����。例如,Gilead Sciences的瑞德西韋 (remdesivir�����,圖3) 在小動(dòng)物模型和非人類靈長(zhǎng)類動(dòng)物中對(duì)埃博拉病毒效果很好�����,但它在人類身上效果不佳[4]�����。
圖3. Remdesivir化學(xué)結(jié)構(gòu)
缺乏好的模型也是抗病毒藥物開發(fā)的絆腳石�����。例如�����,RSV(呼吸道合胞病毒)的小鼠和大鼠模型的預(yù)測(cè)性不強(qiáng)�����。被輝瑞收購(gòu)的ReViral�����,在人類挑戰(zhàn)模型中測(cè)試了他們的化合物。在該模型中�����,健康人被故意感染RSV�����。這是一種人為的情況�����,但它很好地驗(yàn)證了藥物在臨床上的作用�����。很顯然�����,這種策略并不能推而廣之地用于所有病毒研究�����。
盡管生物學(xué)本身制造的問(wèn)題�����,使抗病毒藥物的開發(fā)變得棘手�����,但過(guò)去50年的研究表明�����,正確的激勵(lì)措施可以推動(dòng)創(chuàng)新�����。例如�����,數(shù)十年來(lái)在理解和開發(fā)HIV和AIDS藥物方面的投資�����,極大地推動(dòng)了抗病毒藥物領(lǐng)域的發(fā)展�����。同樣,篳路藍(lán)縷的開發(fā)道路改變了丙型肝炎患者的治療前景�����,過(guò)去治療丙型肝炎需要近一年的藥物治療�����,而且副作用很大?����,F(xiàn)在相對(duì)較短療程的藥片就可以治愈它�����。
但是我們要知道�����,艾滋病和丙型肝炎都是慢性疾病�����,在全球范圍內(nèi)影響著大量人群�����。這些因素為能夠開發(fā)新的更優(yōu)治療方法的制藥公司�����,創(chuàng)造了一個(gè)巨大的市場(chǎng)�����。天下熙熙�����,皆為利來(lái)�����。利益的趨勢(shì)�����,可以激發(fā)企業(yè)開發(fā)這些熱門病毒疾病的相應(yīng)藥物。然而對(duì)于急性病毒感染�����,需要在被感染后立即服用抗病毒藥物�����。這個(gè)狹窄的治療窗口可能會(huì)縮小藥物市場(chǎng)�����,因?yàn)椴《究赡埽ū厝唬?huì)影響世界上可能沒(méi)有足夠資金支付昂貴藥物的落后地區(qū)�����。雖然公共資金可以幫助填補(bǔ)空白�����,但許多投資者的興趣也譬如朝露�����。
Covid-19的大流行�����,讓全世界都在考慮如何以不同的方式進(jìn)行抗病毒藥物的開發(fā)�����。由于缺乏針對(duì)Covid-19的治療選擇�����,人們意識(shí)到需要新的抗病毒藥物�����。在度過(guò)了這場(chǎng)危機(jī)之后�����,科學(xué)界以及產(chǎn)業(yè)界有可能會(huì)迎來(lái)一個(gè)對(duì)于抗病毒藥物開發(fā)的突破局面�����。去日苦多�����,來(lái)日方長(zhǎng)。緊隨人類的每一次苦難�����,都應(yīng)該是人類的又一次進(jìn)步�����。
參考資料:
[1] Kates, J. R. et al. Poxvirus DNA-dependent RNA polymerase. PNAS. 1967, 58, 134-141.
[2] Miller, W. H. et al. Phosphorylation of acyclovir diphosphate by cellular enzymes. Biochem Pharmacol. 1982, 31, 3879-3884.
[3] King, D. H. History, pharmacokinetics, and pharmacology of acyclovir. J Am Acad Dermatol. 1988, 18, 176-179.
[4]Warren, T. K. et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys. Nature. 2016, 531, 381–385.
[General] Howes, L. Why are antivirals so hard to develop? C&EN. Discovery Report. Q3, 2021.