傳統(tǒng)化療藥物治療癌癥通常是通過阻斷細(xì)胞增殖的關(guān)鍵過程實(shí)現(xiàn)的�����。但化療藥物不能選擇性在腫瘤部位富集是其使用受限的重要原因��。因此,通過偶聯(lián)靶向腫瘤抗原的抗體為這一問題的解決提供了方案,即大家所熟知的ADC產(chǎn)品(Antibody-drug conjugates)。ADC是抗體與一種細(xì)胞毒分子通過合適的連接子連接起來組成的分子。
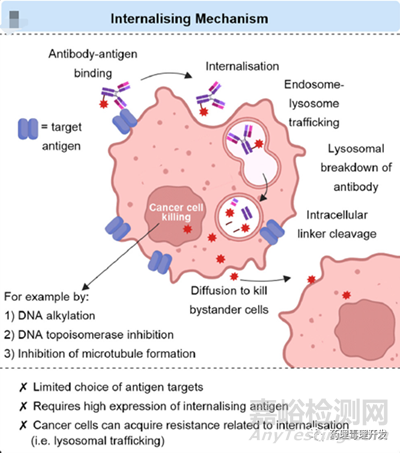
ADC的主流認(rèn)識是抗體部分直接結(jié)合腫瘤細(xì)胞表面的抗原���,之后被內(nèi)吞,細(xì)胞毒類藥物在細(xì)胞內(nèi)釋放�����,繼而發(fā)揮抗腫瘤作用。但其實(shí)抗體內(nèi)吞效率在不同靶點(diǎn)間的差別很大���,很少能達(dá)到100%內(nèi)吞程度,也就是有一部分ADC并不是在胞內(nèi)發(fā)揮的作用,而是在細(xì)胞外的毒素釋放發(fā)揮的作用。而內(nèi)吞和非內(nèi)吞之間,胞內(nèi)和胞外毒素之間�,在抗腫瘤作用中的貢獻(xiàn),很難通過體內(nèi)實(shí)驗(yàn)研究清楚����。這也就提出了一個疑問,ADC一定要內(nèi)吞才能發(fā)揮作用嗎�����?ADC的藥效主要是內(nèi)吞后的毒素發(fā)揮的作用嗎��?非內(nèi)吞型的ADC有開發(fā)價(jià)值嗎�?
非內(nèi)吞ADC產(chǎn)品作用機(jī)制
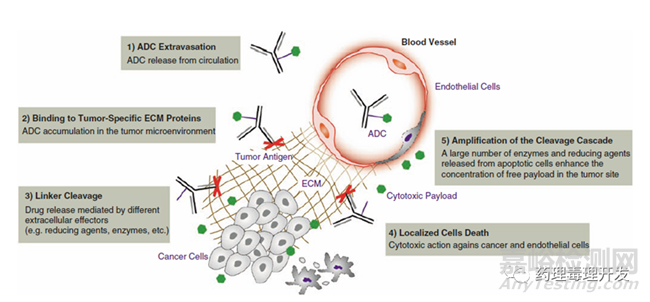
ADC通常被設(shè)計(jì)為通過內(nèi)吞發(fā)揮作用�,抗體首先結(jié)合到腫瘤細(xì)胞表面的抗原,之后被內(nèi)吞至細(xì)胞內(nèi),并在溶酶體內(nèi)完成蛋白降解����,釋放出偶聯(lián)的毒素,殺死所在細(xì)胞。而且�����,毒素在胞內(nèi)釋放殺死靶細(xì)胞后����,尚未失活的毒素可以被動擴(kuò)散到旁邊的腫瘤細(xì)胞,持續(xù)發(fā)揮殺傷作用����,即旁觀者效應(yīng)��。旁觀者效應(yīng)不只能消滅腫瘤細(xì)胞�,對腫瘤基質(zhì)細(xì)胞����、粒細(xì)胞����、腫瘤血管也有殺傷作用�。另外�,旁觀者效應(yīng)沒有太多選擇性�,無論細(xì)胞是否表達(dá)目標(biāo)靶點(diǎn)���,只要毒素的擴(kuò)散能力、透膜能力比較強(qiáng)����,所及之處皆帶殺傷�����。內(nèi)吞型ADC產(chǎn)品的作用機(jī)制如下圖所示���。目前已批準(zhǔn)上市的ADC產(chǎn)品基本都是內(nèi)吞型的��。但這類產(chǎn)品也有一定局限性,包括符合內(nèi)吞且過表達(dá)雙重要求的抗原有限��、抗體的腫瘤穿透能力弱�����、腫瘤細(xì)胞可以通過調(diào)節(jié)內(nèi)吞過程中的各個節(jié)點(diǎn)實(shí)現(xiàn)耐藥。
旁觀者效應(yīng)并不是抗體介導(dǎo)的直接內(nèi)吞導(dǎo)致的,理論上毒素到達(dá)腫瘤微環(huán)境就有發(fā)揮作用的可能�����。所以�����,這就出現(xiàn)一種新的策略�,采用直接靶向腫瘤特異性細(xì)胞外膜抗原��、腫瘤基質(zhì)成分或非內(nèi)吞/少內(nèi)吞的膜抗原的抗體���,偶聯(lián)毒素�����,也有抗腫瘤的潛力。當(dāng)然���,內(nèi)吞和非內(nèi)吞抗體在連接子方面還是有區(qū)別的��,前者可切割或不可切割的連接子都可以����,后者只能用可切割的連接子,而且最好是在腫瘤部位選擇性切割���。如果連接子不穩(wěn)定�����,在外周血切割,一是會出現(xiàn)嚴(yán)重的毒性����,二是到達(dá)腫瘤部位的有效藥物濃度會降低�����。作用機(jī)制如下圖所示。
靶向膜蛋白的非內(nèi)吞型ADC
其實(shí)���,非內(nèi)吞ADC(或內(nèi)吞比例非常低的ADC)已經(jīng)有多個靶點(diǎn)在研,比如CD20�、CD21�、CAIX和FAP。此外�,作用于細(xì)胞外基質(zhì)組分的ADC靶點(diǎn)也有在研�����,包括fibronectin、tenascin-C����、fibrin和collagen IV等����。通常非霍奇金淋巴瘤通過化療和抗體藥物聯(lián)合治療后效果挺不錯的�����,但復(fù)發(fā)后的腫瘤是需要新型治療方式的,ADC是很有潛力的一類產(chǎn)品�。尤其對于B細(xì)胞來源的非霍奇金淋巴瘤,細(xì)胞表面會特異性高表達(dá)各種抗原�����,如CD20��、CD21�、CD19����、CD22���。前兩個抗原是非內(nèi)吞型的�,后兩個則是內(nèi)吞型抗原。Polson團(tuán)隊(duì)采用CD19�、CD20、CD21�����、CD22��、CD72、CD79b��、CD180等抗原的抗體,采用可切割��、不可切割兩種連接子,偶聯(lián)抗微管蛋白毒素分子��,在小鼠中考察了抗腫瘤藥效�����。結(jié)果顯示����,所有采用可切割連接子偶聯(lián)的藥物�,無論靶點(diǎn)內(nèi)吞與否�����,均產(chǎn)生了明顯的抗腫瘤作用。采用不可切割連接子的藥物���,僅內(nèi)吞型靶點(diǎn)���,產(chǎn)生了藥效。結(jié)論很明顯�,可切割連接子在胞外(非胞內(nèi))被切割后,釋放毒素����,通過擴(kuò)散穿過細(xì)胞膜�,發(fā)揮抗腫瘤作用����。
碳酸酐酶是一類金屬酶,催化二氧化碳水合生成碳酸氫鹽���。碳酸酐酶Ⅹ(CAIⅩ)是一類跨膜同源二聚酶����,在90%以上的腎透明細(xì)胞癌中過表達(dá)�����。另外,大部分腫瘤內(nèi)部是一個缺氧的環(huán)境,CAIⅩ是缺氧最好的標(biāo)記物之一���。同時�,CAIⅩ在正常器官中的表達(dá)又是非常受限的�。這就使CAIⅩ成為很有吸引力的ADC靶點(diǎn)之一�。起初很長時間,CAIⅩ被視為內(nèi)吞型抗原�。最近已經(jīng)研究清楚,CAIⅩ是個幾乎沒有內(nèi)吞的靶點(diǎn)��。Petrul通過將CAIⅩ抗體采用可切割的Val-Cit連接子偶聯(lián)了MMAE毒素����,制備得到ADC分子BAY 79-4620�����。臨床前研究顯示�,BAY 79-4620在體外可選擇殺傷CAIⅩ陽性腫瘤細(xì)胞,體內(nèi)5和10mg/kg劑量下對結(jié)腸癌����、宮頸癌等腫瘤模型也顯示出不錯的藥效。2014年�����,這個分子進(jìn)入Ⅰ期臨床劑量爬升階段����,劑量為0.3-4.6 mg/kg。但是�,12例患者無PR或CR出現(xiàn),且高劑量出現(xiàn)心臟驟停和胰腺炎導(dǎo)致的患者死亡���。當(dāng)然�����,這個分子也就停止推進(jìn)了�����。這一悲劇進(jìn)一步提示����,抗原表達(dá)分布情況對無論內(nèi)吞型還是非內(nèi)吞型ADC產(chǎn)品來講,都是影響成藥的關(guān)鍵因素�。
錨定在腫瘤微環(huán)境中的抗原或在基質(zhì)細(xì)胞表面的抗原也是非內(nèi)吞ADC開發(fā)的候選靶點(diǎn)。在人體多個實(shí)體瘤中發(fā)現(xiàn)一個共同現(xiàn)象-纖維蛋白(fibrin)的血管外沉積���。動物中也有同樣發(fā)現(xiàn)�,小鼠接種腫瘤后�,纖維蛋白沉積往往是最早的形態(tài)學(xué)變化之一?����;诖?��,Yasunaga團(tuán)隊(duì)開發(fā)了靶向纖維蛋白的ADC���,偶聯(lián)伊立替康活性代謝產(chǎn)物SN38,DAR值高達(dá)24��。動物藥效試驗(yàn)結(jié)果顯示���,13.3mg/kg���,每周給藥1次,可明顯抑制腫瘤生長�����,反觀伊立替康每天給藥組則未見明顯藥效�。毒理學(xué)研究未見該產(chǎn)品對肝臟、骨髓���、腎臟功能的影響����,動物耐受性良好��。
成纖維細(xì)胞作為重要的基質(zhì)細(xì)胞,在腫瘤轉(zhuǎn)移��、侵襲過程中發(fā)揮重要作用�。成纖維細(xì)胞激活蛋白α是成纖維細(xì)胞分泌的一種絲氨酸蛋白酶,參與組織重塑和傷口愈合���。Sibrotuzumab是一株FAPα抗體�����,給藥后可24-48h可見在腫瘤部位的選擇性分布�����。但是��,單獨(dú)的Sibrotuzumab沒有抗腫瘤活性�����。Ostermann團(tuán)隊(duì)通過將FAPα抗體偶聯(lián)美登素�����,在胰腺癌���、非小細(xì)胞肺癌��、頭頸鱗癌和結(jié)腸癌中觀察到明顯的抗腫瘤作用����。
成纖維細(xì)胞上還有一個抗原靶點(diǎn)-LRRC15(leucine rich repeat containing 15)�����,在正常組織低表達(dá)�,多種實(shí)體瘤如乳腺癌�、骨肉瘤、前列腺癌中高表達(dá)�。基于此�,Abbvie開發(fā)了一款LRRC15的ADC產(chǎn)品-ABBV-085,通過ValCit偶聯(lián)MMAE��,已經(jīng)完成了臨床I期研究�,27例肉瘤患者中,4例部分緩解�����,ORR為7.4%,8例疾病穩(wěn)定��?;颊吣褪苄粤己谩?/span>
PD-L1這個靶點(diǎn)比較熟知的是開發(fā)成抗體藥物��,如Merck的avelumab�����、Roche的atezolizumab���、AstraZeneca的duralumab�����,均已經(jīng)在多個腫瘤適應(yīng)癥中獲批上市���。PD-L1這個靶點(diǎn)內(nèi)吞與否與抗體結(jié)合的表位有關(guān),avelumab在MDA-MB-231細(xì)胞中只有不到20%被內(nèi)吞�,atezolizumab內(nèi)吞則達(dá)40%,但整體內(nèi)吞效率都不算高�����。PD-L1可以作為非內(nèi)吞ADC潛在靶點(diǎn)之一。
癌胚抗原細(xì)胞粘附分子5(CEACAM5)是許多腫瘤的生物標(biāo)記物之一�����,同樣具備不內(nèi)吞的特點(diǎn)����。Goldenberg開發(fā)的CEACAM5抗體ADC,采用的是對酸不穩(wěn)定的連接子�,毒素是SN-38。在人結(jié)腸癌��、胰腺癌和淋巴瘤中看到了不錯的藥效�����。研究人員認(rèn)為不穩(wěn)定可切割連接子在酸性條件下使ADC緩慢釋放SN-38����,導(dǎo)致腫瘤局部游離藥物蓄積的非內(nèi)吞機(jī)制是發(fā)揮抗腫瘤作用的關(guān)鍵�。
靶向腫瘤中經(jīng)修飾的細(xì)胞外基質(zhì)
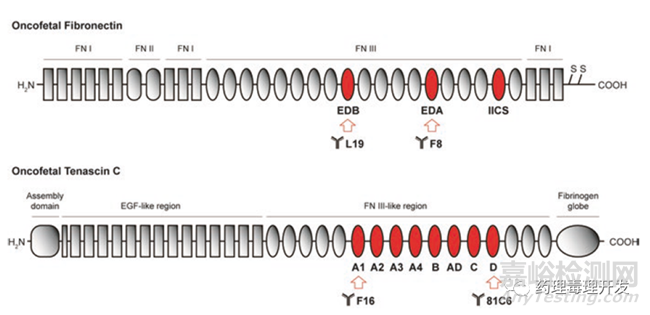
除了膜抗原靶點(diǎn),細(xì)胞外基質(zhì)也是一類潛在可發(fā)成ADC產(chǎn)品的靶點(diǎn)�。腫瘤細(xì)胞生長迅速,血管不規(guī)則���,導(dǎo)致氧氣供應(yīng)和利用的不充分���,形成缺氧微環(huán)境�。腫瘤細(xì)胞在厭氧條件下會產(chǎn)生諸如CO2���,H+-lactate等呼吸終產(chǎn)物���,后者是導(dǎo)致腫瘤間質(zhì)出現(xiàn)酸性環(huán)境的重要原因之一(pH從6.5-7變?yōu)?左右)。異常的pH值環(huán)境會誘導(dǎo)細(xì)胞外基質(zhì)組分產(chǎn)生剪接異變體���,如纖連蛋白和tenascin C����。纖連蛋白是糖蛋白��,是細(xì)胞與基質(zhì)組分之間的橋梁���,涉及細(xì)胞粘附��、遷移���、歸巢���、傷口愈合等功能。纖連蛋白中的EDB和EDA片段選擇性在腫瘤中表達(dá)���,正常組織中的纖連蛋白不含這一片段��。Tenascin C是另外一個參與細(xì)胞結(jié)合的寡聚體糖蛋白�����,與纖連蛋白類似���,也存在腫瘤特異表達(dá)的不同剪接體形式。纖連蛋白和tenascin C的結(jié)構(gòu)如下�,箭頭所示為開發(fā)成抗體的區(qū)域��。
L19����、F8、F16�、81C6分別是針對纖連蛋白EDB、EDA����、tanescin C蛋白A1和D表位的抗體�����。放射性藥物131I-L19和131I-F16已經(jīng)被用于霍奇金淋巴瘤和頭頸癌的臨床療效評估�。臨床試驗(yàn)中���,也有用L19或F16融合細(xì)胞因子IL-2或TNF用于黑色素瘤�、軟組織肉瘤��、B細(xì)胞淋巴瘤等的治療�。以上兩個應(yīng)用,核心還是利用了纖連蛋白和tenascin C的腫瘤特異性���,通過抗體的腫瘤靶向遞送能力���,將核素、細(xì)胞因子直接運(yùn)送到靶部位���。
既然能攜帶核素�、細(xì)胞因子,自然也能開發(fā)成我們今天的主角-ADC�����。當(dāng)然�,這些抗原的位置在可溶性蛋白中,自然就不涉及內(nèi)吞一說了�����。有研究用EDA抗體F8偶聯(lián)一種微管蛋白抑制劑cemadotin�,采用的是C端半胱氨酸定點(diǎn)偶聯(lián),DAR值為2��,小鼠中半衰期約為48h���。體內(nèi)抗腫瘤藥效也很明顯����。但是���,在劑量高達(dá)43mg/kg時,未見動物出現(xiàn)腫瘤消退情況�。推測原因或許跟毒素有關(guān),應(yīng)該偶聯(lián)活性更強(qiáng)的毒素,比如DM1��。采用F8-SS-DM1 ADC產(chǎn)品給予接種F9畸胎瘤的小鼠�,7mg/kg的劑量,給藥3次�����,60%的動物出現(xiàn)腫瘤消退���。也有團(tuán)隊(duì)用F16抗體偶聯(lián)MMAE�,采用蛋白酶敏感型連接子Val-Cit��。F16-Val-Cit-MMAE在A431�、U87人腫瘤中可引起腫瘤的完全消退。目前進(jìn)展比較快的是針對EDB的非內(nèi)吞ADC候選分子PYX-201����,已經(jīng)進(jìn)入臨床Ⅰ期研究階段,并于2023年5月獲得FDA孤兒藥認(rèn)定�,用于治療胰腺癌。
Galectin-3-binding protein(Gal-3-BP)在大多數(shù)腫瘤中均可發(fā)現(xiàn)大量且持續(xù)的分泌�����。Iacobelli團(tuán)隊(duì)制備了針對該靶點(diǎn)的ADC,在異源移植瘤動物模型中觀測到不錯的抗腫瘤藥效���,多只動物腫瘤完全消退����。
LRG1是在腫瘤微環(huán)境中大量存在的糖蛋白之一�����。Chudasama團(tuán)隊(duì)開發(fā)了該靶點(diǎn)的ADC�,采用了Val-Cit這一被cathepsin切割的連接子,毒素用的是MMAE���。體外在LRG1陽性B16F10黑色素瘤細(xì)胞中�,在cathepsin存在的情況下���,顯示出很強(qiáng)的腫瘤細(xì)胞殺傷作用���。進(jìn)一步體內(nèi)研究同樣顯示出明顯抑制腫瘤生長的能力,給出了與體外一致的結(jié)論����。
除了以上靶點(diǎn)外,基質(zhì)金屬蛋白酶9(MMP9)�����、膠原蛋白����、纖維蛋白也是不錯的非內(nèi)吞ADC開發(fā)靶點(diǎn),并有臨床前體內(nèi)外藥效學(xué)數(shù)據(jù)支持���,不再一一贅述�。
改善非內(nèi)吞ADC產(chǎn)品的活性和選擇性
組成ADC的三個組分���,抗體�����、連接子和毒素����,對產(chǎn)品的活性和選擇性都有影響���。對于非內(nèi)吞型ADC�,由于連接子是可切割的,而且是在胞外完成切割�,掉落的毒素也是在細(xì)胞外,但是毒素需要進(jìn)入胞內(nèi)才能發(fā)揮作用����,故更容易擴(kuò)散透膜的脂溶性強(qiáng)的毒素是首選。另外�����,隨著ADC連接子結(jié)構(gòu)研究的深入���,多聚連接子可以將DAR值提高到10以上�,活性自然也隨之增強(qiáng)�����,但帶來的是潛在的免疫原性風(fēng)險(xiǎn)��。當(dāng)然�����,對于如何保障連接子在外周相對穩(wěn)定�����,在腫瘤微環(huán)境選擇性釋放毒素是一項(xiàng)需要持續(xù)優(yōu)化的工作。
最后
一直以來����,對于一個靶點(diǎn)能不能開發(fā)成ADC����,除了考量靶點(diǎn)在腫瘤組織中表達(dá)的特異性和豐度外,能否內(nèi)吞也是核心指標(biāo)之一�。內(nèi)吞型ADC一直是關(guān)注和研究的重點(diǎn)。但從過往數(shù)據(jù)看���,非內(nèi)吞型ADC在臨床前的數(shù)據(jù)其實(shí)也已經(jīng)得到充分驗(yàn)證�����。尤其纖連蛋白����、tenascin-C這兩個蛋白����,其剪接體在腫瘤中大量存在���,豐度很高,而且非常穩(wěn)定���,在大部分正常組織中幾乎不表達(dá)����,是藥物遞送的理想靶標(biāo)��。相對于研究火熱的內(nèi)吞型ADC�����,非內(nèi)吞ADC的研究還比較少����,但并不代表此路不通,只是因?yàn)閮?nèi)吞型ADC已有前路登頂���,腳步可循�����,風(fēng)險(xiǎn)相對可控��。隨著研究數(shù)據(jù)的積累�����,非內(nèi)吞型ADC或許也會迎來突破����,打破內(nèi)吞型ADC的壟斷�,也在某種程度上顛覆大家對ADC的一些認(rèn)知。目前已經(jīng)有非內(nèi)吞型ADC推進(jìn)到臨床階段�����,期待帶來好的數(shù)據(jù)�����。