今日頭條
和譽CSF-1R抑制劑Ib期臨床結(jié)果積極����。和譽醫(yī)藥新一代CSF-1R抑制劑pimicotinib(ABSK021)在CTOS2023年會上公布治療腱鞘巨細胞瘤(TGCT)的Ib期臨床一年隨訪數(shù)據(jù)。結(jié)果顯示����,在50mg QD隊列和25mg QD隊列中,經(jīng)IRC評估的客觀緩解率(ORR)分別達到87.5%和66.7%�,療效數(shù)據(jù)得到持續(xù)改善,且中位緩解持續(xù)時間(DOR)均未達到����。藥物總體安全性良好,未出現(xiàn)其他明顯的不良事件�����。
國內(nèi)藥訊
1.康方PD-1/CTLA-4雙抗胃癌III期臨床積極��。康方生物自主研發(fā)PD-1/CTLA-4雙抗卡度尼利單抗(開坦尼�,AK104)聯(lián)合XELOX化療方案(奧沙利鉑和卡培他濱)一線治療局部晚期或轉(zhuǎn)移性胃或胃食管結(jié)合部(GC/GEJC)腺癌的III期臨床(AK104-302)達到主要終點。獨立數(shù)據(jù)監(jiān)察委員會(IDMC)期中分析顯示����,與安慰劑聯(lián)合化療相比���,AK104聯(lián)合化療顯著延長患者總生存期(OS);安全性數(shù)據(jù)與既往研究一致���。詳細結(jié)果將在國際學術(shù)會議上公布。
2.AZ/第一三共HER2-ADC擬納入優(yōu)先審評���。第一三共與阿斯利康開發(fā)的HER2靶向ADC德曲妥珠單抗(Enhertu�����,T-DXd)新適應(yīng)癥上市申請獲CDE擬納入優(yōu)先審評���,單藥用于三線或以上治療局部晚期或轉(zhuǎn)移性HER2陽性成人胃或胃食管結(jié)合部(GEJ)腺癌患者。在DESTINY-Gastric01研究中�,T-DXd治療較化療降低患者死亡風險41%(p=0.0097),兩組患者12個月OS率分別為52.1%和28.9%��。
3.阿斯利康FRα靶向ADC中國獲批臨床�����。阿斯利康靶向FRα的ADC藥物AZD5335獲國家藥監(jiān)局臨床許可�,擬開發(fā)用于治療晚期實體瘤�。AZD5335由靶向FRα抗體與TOP1i有效載荷(AZ14170132)偶聯(lián)而成�,旨在將TOP1i有效載荷送入表達FRα的癌細胞,導(dǎo)致DNA損傷和細胞凋亡����。目前,該新藥正在Ⅰ/Ⅱ期臨床中評估用于單藥和聯(lián)合抗癌藥物治療實體瘤患者的安全性與有效性��。
4.華奧泰CD73-ADC獲批實體瘤臨床����。華海藥業(yè)旗下華奧泰生物開發(fā)的靶向CD73抗原的抗體偶聯(lián)藥物 (ADC)注射用HB0052獲FDA批準新藥臨床試驗,擬開發(fā)用于晚期實體瘤的治療����。HB0052通過抗體阻斷CD73的酶活可解除CD73的免疫抑制功能,增強抗腫瘤效果��。在臨床前研究中��,HB0052已顯示出較好的CMC特性和良好的抗腫瘤作用��,有望為腫瘤患者�、以及PD-1/PD-L1抑制劑治療耐受或無效的患者帶來獲益。
5.普米斯PD-L1/VEGF雙抗授權(quán)BioNTech。BioNTech公司與普米斯公司就后者臨床期PD-L1/VEGF雙抗PM8002達成合作許可協(xié)議��,獲得PM8002在全球(大中華區(qū)除外)的開發(fā)���、生產(chǎn)和商業(yè)化權(quán)利��。公布于ESMO2023年會上的Ⅱ期臨床顯示�����,PM8002聯(lián)合紫杉醇二線治療小細胞肺癌(SCLC)已顯示抗腫瘤活性和可接受的毒性。根據(jù)協(xié)議��,普米斯將獲得5500萬美元的首付款��,和超10億美元的開發(fā)���、注冊和商業(yè)里程碑等潛在付款�。
國際藥訊
1.安斯泰來C5抑制劑眼科Ⅲ期臨床積極��。安斯泰來補體C5抑制劑avacincaptad pegol(Izervay)玻璃體內(nèi)注射液治療年齡相關(guān)性黃斑變性(AMD)引起的地圖狀萎縮(GA)的Ⅲ期臨床結(jié)果積極���。與假對照組相比��,Izervay治療組患者兩年后的GA病變平均生長速率顯著降低14%(p=0.0165)���;此外����,Izervay在第一年每月給藥治療并在第二年每兩個月給藥一次����,患者第二年的GA病變平均生長速率較假對照組顯著降低19%(p=0.0015)。兩年期間��,藥物安全性良好�。
2.新型抗生素淋病感染Ⅲ期臨床積極。全球抗生素研發(fā)合作組織(GARDP)與Innoviva公司旗下子公司Innoviva Specialty開發(fā)的口服II型拓撲異構(gòu)酶抑制劑zoliflodacin��,在治療淋病感染的國際Ⅲ期臨床達到主要終點�。與標準治療相比,zoliflodacin用于泌尿生殖系統(tǒng)部位的微生物治愈率達到非劣效性標準(5.31%����, 95%CI:1.38%,8.65%)�����;藥物總體耐受性良好,試驗中沒有嚴重不良事件或死亡案例��。
3.FIC腎病新藥兩項Ⅲ期研究見刊����。Travere公司雙重內(nèi)皮素/血管緊張素受體拮抗劑sparsentan(Filspari)在《柳葉刀》和《新英格蘭醫(yī)學雜志》上發(fā)表兩項關(guān)鍵性研究(PROTECT和DUPLEX)補充數(shù)據(jù)。此前��,sparsentan已在治療IgA腎病的III期PROTECT研究未達到次要終點��,與厄貝沙坦組相比�,F(xiàn)ilspari未能顯著改善患者腎小球濾過率(eGFR)總斜率;在關(guān)鍵III期DUPLEX研究中���,sparsentan治療局灶節(jié)段性腎小球硬化(FSGS)與厄貝沙坦相比也未達到主要終點,患者在108周時的eGFR總斜率改善不具統(tǒng)計學意義����。Sparsentan是FDA批準針對IgA腎病的首個非免疫抑制療法。
4.IL17A/F納米三抗國際Ⅱ期臨床積極����。MoonLake公司靶向IL17A/F三特異性納米抗體sonelokimab治療活動性銀屑病關(guān)節(jié)炎(PsA)的國際Ⅱ期ARGO試驗結(jié)果積極。sonelokimab(120mg)治療患者在第12周時達到ACR50應(yīng)答的患者比例為47%��,與安慰劑相比具有顯著改善(P<0.01),達到主要終點和所有次要終點��。但60mg劑量(不含誘導(dǎo))sonelokimab治療組沒有達到ACR50主要終點����。安全性與之前報告的研究結(jié)果一致,沒有出現(xiàn)新的安全性信號�����。
5.輝瑞小分子GLP-1R激動劑進入Ⅰ期臨床��。輝瑞與Sosei Group Corporation公司合作開發(fā)的口服小分子GLP-1R激動劑PF-06954522已被輝瑞推進至Ⅰ期臨床試驗��。2015年11月��,兩家公司達成一項多靶點藥物研發(fā)合作���,針對輝瑞所選GPCR靶點開發(fā)潛在新藥����。目前�,雙方已有PF-06954522;PF-07054894和PF-07258669三款候選藥物進展至臨床開發(fā)�。
6.BMS以1.8億美元購進抗體偶聯(lián)創(chuàng)新降解劑��。百時美施貴寶與Orum Therapeutics就后者臨床早期����、靶向CD33的抗體偶聯(lián)GSPT1降解劑項目ORM-6151達成收購協(xié)議�����,以開發(fā)ORM-6151用以治療急性髓系白血病和高危骨髓增生異常綜合征��。根據(jù)協(xié)議����,Orum將獲得1億美元預(yù)付款、開發(fā)�、監(jiān)管和商業(yè)里程碑潛在付款,總交易金額可能達到1.8億美元����。
醫(yī)藥熱點
1.官方通報:販賣出生證涉事醫(yī)院停業(yè)整頓����。11月7日下午,湖北襄陽市衛(wèi)健委針對媒體反映“襄陽健橋醫(yī)院公開販賣出生證販賣嬰兒”問題作出的情況通報����。該通報稱�����,11月6日晚���,工作專班進駐涉事醫(yī)院,連夜詢問了相關(guān)人員���,并封存了相關(guān)資料作進一步核查��。目前�����,涉事醫(yī)院婦產(chǎn)科已停業(yè)整頓�,相關(guān)責任人已被控制�,醫(yī)院院長已被采取刑事強制措施并接受調(diào)查。工作專班已約見舉報者獲取了相關(guān)材料�。相關(guān)問題正在進一步調(diào)查核實中。
2.上海市兒童醫(yī)院調(diào)整診前化驗項目��。為盡可能縮短患兒及家屬的就診時間�����,上海市兒童醫(yī)院近期在原有診前化驗項目中,加入了肺炎支原體抗體和甲流��、乙流抗原檢測���,持續(xù)優(yōu)化患者就醫(yī)體驗��。來院就診的患兒經(jīng)過門急診預(yù)檢嚴格把關(guān)��,自愿接受此項便民服務(wù)者即可直接在預(yù)檢處或分診臺開診前檢驗單��,候診的同時到檢驗窗口完成化驗�,就診時可直接將化驗結(jié)果提供給醫(yī)生���。
3.第九批國采擬中選藥品平均降價58%���。11月6日,第九批國家藥品集采在上海開標���。本批國采共涉及42種藥品,共有262家企業(yè)參與投標�。根據(jù)擬中選結(jié)果����,此次集采有41種藥品采購成功����,205家企業(yè)的266個產(chǎn)品獲得擬中選資格,其中包括200家國內(nèi)藥企的260個產(chǎn)品�,5家國際藥企的6個產(chǎn)品(包括1個原研藥和5個進口仿制藥)。擬中選藥品平均降價58%�����,預(yù)計每年可節(jié)約藥費182億元����。
評審動態(tài)
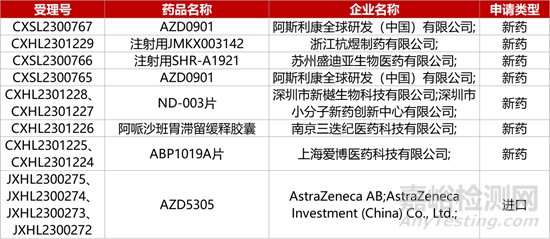
1. CDE新藥受理情況(11月07日)
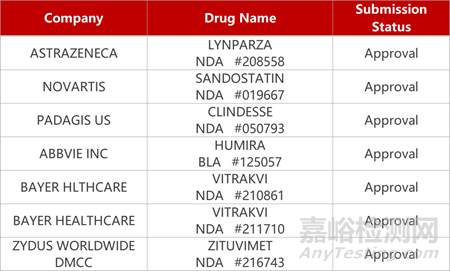
2. FDA新藥獲批情況(北美11月06日)