由于生物類似藥和一般化學(xué)仿制藥存在多方面的差異�����,生物類似藥的立項(xiàng)除遵循一般化學(xué)仿制藥立項(xiàng)需考慮的要素和原則外�����,還需要關(guān)注生物類似藥的產(chǎn)品復(fù)雜性�����、監(jiān)管不確定性以及研發(fā)周期長(zhǎng)�����、成本高等要素和特點(diǎn)�����。
1�����、產(chǎn)品定位策略
目前�����,歐美成熟市場(chǎng)與新興市場(chǎng)中生物類似藥領(lǐng)域的競(jìng)爭(zhēng)日趨激烈�����,研發(fā)熱點(diǎn)已經(jīng)從結(jié)構(gòu)簡(jiǎn)單的重組蛋白藥物轉(zhuǎn)向了單抗�����、融合蛋白�����、胰島素類似物等結(jié)構(gòu)復(fù)雜的生物藥�����,尤其是阿達(dá)木單抗 (adalimumab)曲妥珠單抗 (trastuzumab)�����、利妥昔單抗 (rituximab)�����、英夫利昔單抗 (inliximab) 等單抗類重磅產(chǎn)品在國(guó)內(nèi),針對(duì)TNF-a�����、ECFR�����、VEGF、HER2 等熱門點(diǎn)的單抗或融合蛋白類生物類似藥品種出現(xiàn)了扎堆申報(bào)現(xiàn)象,這可能會(huì)導(dǎo)致后續(xù)的同質(zhì)化和過(guò)度競(jìng)爭(zhēng)的問(wèn)題�����,使進(jìn)度落后的企業(yè)的投資回報(bào)達(dá)不到預(yù)期。因此�����,不同企業(yè)要根據(jù)自身的優(yōu)勢(shì)聚焦有市場(chǎng)優(yōu)勢(shì)的疾病領(lǐng)域�����,避免選擇過(guò)度熱門的靶點(diǎn)�����。另外�����,在研發(fā)立項(xiàng)之初�����,制定面向全球目標(biāo)市場(chǎng)的開(kāi)發(fā)策略尤為重要�����。例如�����,國(guó)內(nèi)也有企業(yè)的貝伐珠單抗生物類似藥已在中國(guó)和美國(guó)同時(shí)開(kāi)展臨床試驗(yàn)�����,采用了在當(dāng)前中國(guó)為數(shù)不多的“中美雙報(bào)”注冊(cè)策略�����。
2、市場(chǎng)競(jìng)爭(zhēng)
生物類似藥除與原研廠商爭(zhēng)奪市場(chǎng)外�����,同時(shí)面臨著同品種多個(gè)廠家的扎堆研制和競(jìng)爭(zhēng)�����。另外�����,還需要考慮以下其他兩類品種的競(jìng)爭(zhēng)�����。
一類是在歷史時(shí)期未按照生物類似藥監(jiān)管途徑與原研產(chǎn)品進(jìn)行質(zhì)量�����、安全性�����、有效性的嚴(yán)格比對(duì)試驗(yàn)�����,或未能驗(yàn)證與原研產(chǎn)品具有高度生物相似性�����,在質(zhì)量和成分上有差異�����,不能互相替代的仿制產(chǎn)品(Imitator)�����。2015 年國(guó)家食品藥品監(jiān)督管理總局 (CFDA)《生物類似藥研發(fā)與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》出臺(tái)之前�����,國(guó)內(nèi)有不少此類按新藥途徑申報(bào)的仿制產(chǎn)品�����,如依那西 (etanercept) 的國(guó)內(nèi)仿制產(chǎn)品益賽普 (三生國(guó)健)�����、強(qiáng)克 (上海賽金) 和安百諾(海正藥業(yè))。
另一類是改良型創(chuàng)新生物藥 (bio -better)�����,是對(duì)已上市的原研生物藥進(jìn)行長(zhǎng)效化�����、靶向性�����、多能性(多靶點(diǎn))�����、給藥途徑改良等方面的升級(jí)�����,與原研生物藥及生物類似藥相比具有更佳的安全性有效性或患者依從性等臨床優(yōu)勢(shì)�����。原研廠商通過(guò)對(duì)原研藥做進(jìn)一步的改良�����,在原研藥專利截止之際,
推出改良型的生物新藥�����,以維持其產(chǎn)品在市場(chǎng)中的領(lǐng)先地位�����,如羅氏的抗體偶聯(lián)藥物 (amtibody -drugconjugate�����,ADC)曲妥珠單抗-美坦新 (trastuzumab emtansine�����,Kadcyla)�����、皮下注射劑型利妥昔單抗/透明質(zhì)酸酶(rituximab/hyaluronidase�����,Rituxan Hycela)�����、皮下注射劑型曲妥珠單抗/透明質(zhì)酸酶 (trastuzumab/hyaluronidase -oysk�����,Herceptin Hylecta)�����。在國(guó)外�����,皮下注射劑可縮短注射時(shí)間�����、降低病床占有率�����,同時(shí)減少對(duì)醫(yī)護(hù)人員的使用,進(jìn)而降低醫(yī)療費(fèi)用�����,因而對(duì)同一藥品的靜脈注射劑型類似藥帶來(lái)明顯挑戰(zhàn)
另外�����,原研藥廠商還會(huì)采用授權(quán)品牌生物類似藥的方式�����,以應(yīng)對(duì)生物類似藥的沖擊�����。例如�����,羅氏為應(yīng)對(duì) DrReddy制藥公司的利妥昔單抗 (rituximab) 生物類似藥 Reditux 上市對(duì)其原研藥 Rituxan的沖擊�����,與印度本土藥企Emcure Pharmaceuticals 合作�����,在當(dāng)?shù)厣a(chǎn)第二個(gè)Rituxan 品牌生物藥�����,以低價(jià)與生物類似藥Reditux競(jìng)爭(zhēng)�����。
3�����、監(jiān)管政策
監(jiān)管機(jī)構(gòu)對(duì)生物類似藥的監(jiān)管政策仍處于發(fā)展變化階段�����,部分市場(chǎng)缺乏一致和清晰的注冊(cè)�����、監(jiān)管路徑�����。歐盟 EMA 最早開(kāi)始建立生物類似藥監(jiān)管體系 (2001年),并逐漸形成了目前最為系統(tǒng)和完備的法規(guī)和監(jiān)管體系�����。美國(guó)FDA 于2012 年發(fā)布了生物類似藥指導(dǎo)原則�����,且已批準(zhǔn)了一些生物類似藥品種目前�����,相應(yīng)的法規(guī)�����、指南和注冊(cè)審批體系還在完善之中�����。中國(guó)藥品監(jiān)管部門于 2015 年頒布了《生物類似藥研發(fā)與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》�����,標(biāo)志著中國(guó)生物類似藥產(chǎn)業(yè)的啟動(dòng)�����,之后�����,相關(guān)品種的開(kāi)發(fā)指南也陸續(xù)發(fā)布:其他相關(guān)的法規(guī)指南正在完善中�����,這將逐漸減少研發(fā)監(jiān)管的不確定性�����。
另外�����,在中國(guó)�����,其他行政制度也影響著生物類似藥的研發(fā)�����。例如,醫(yī)?����?刭M(fèi)壓力增加將鼓勵(lì)生物類似藥研發(fā)�����,以提高藥品的可及性;國(guó)內(nèi)上市許可人 (Marketing Authorization Holder�����,MAH) 制度的實(shí)施也擴(kuò)大了生物類似藥的合同生產(chǎn)外包 (Contract Manufacture 0rganization�����,CMO)市場(chǎng)�����,推動(dòng)了藥品的研發(fā)�����。
各國(guó)和地區(qū)政府對(duì)于生物類似藥可互換性要求的不一致性也是立項(xiàng)過(guò)程中需要認(rèn)真考慮的問(wèn)題�����。生物類似藥具有大分子結(jié)構(gòu)�����,這決定了其難以做到與參照藥完全一致進(jìn)而實(shí)現(xiàn)臨床使用的完全互換�����。許多國(guó)家通過(guò)立法�����,明確了生物類似藥使用和互換的要求�����。目前�����,只有美國(guó)確定了生物類似藥可互換產(chǎn)品的定義�����,并對(duì)其提出了額外的技術(shù)要求,要求提供可以證明生物類似藥與參照藥轉(zhuǎn)換使用沒(méi)有臨床意義差異的額外臨床數(shù)據(jù)�����。歐盟的“可互換”概念是由醫(yī)生決定是否用某種具有相同治療目的的藥物替代另一種藥物�����,即轉(zhuǎn)換(switching)�����。醫(yī)生通過(guò)對(duì)生物類似藥的了解并結(jié)合患者的疾病發(fā)生發(fā)展情況�����,給予其合適的生物類似藥�����。我國(guó)尚未建立可互換生物類似藥的定義和額外的技術(shù)標(biāo)準(zhǔn)�����,目前主要由臨床醫(yī)生根據(jù)患者和生物類似藥的特點(diǎn)開(kāi)具處方�����。理論上�����,對(duì)原研生物藥產(chǎn)生積極反應(yīng)的患者可以接受相應(yīng)的生物類似藥�����,從而降低治療成本�����。經(jīng)過(guò)多年使用�����,主要監(jiān)管機(jī)構(gòu)對(duì)于生物類似藥可互換性的有效性和安全性(主要是免疫原性和治療活性)的擔(dān)心已經(jīng)大大減少�����,盡管如此�����,各監(jiān)管機(jī)構(gòu)的立場(chǎng)尚未達(dá)到一致。這就要求在項(xiàng)目立項(xiàng)時(shí)�����,應(yīng)根據(jù)不同監(jiān)管機(jī)構(gòu)對(duì)于可互換性的要求確定研究策略�����。
4�����、產(chǎn)品特性
生物類似藥具有分子量大�����、結(jié)構(gòu)高度復(fù)雜的特點(diǎn)�����,因此�����,其開(kāi)發(fā)涉及多個(gè)層次的復(fù)雜過(guò)程,包括需高度受控的制造工藝開(kāi)發(fā)�����、臨床前結(jié)構(gòu)與功能和生物學(xué)活性評(píng)估�����、臨床療效和安全性(包括免疫原性)分析等�����。為確保與參照藥的高度相似性�����,應(yīng)在生物類似藥開(kāi)發(fā)的每一步開(kāi)展與參照藥的頭對(duì)頭比對(duì)試驗(yàn)�����,以證明其在質(zhì)量�����、安全性和療效方面與參照藥沒(méi)有臨床意義上的差異�����。
生物類似藥開(kāi)發(fā)的總體思路是以證明其與參照藥具有相似性的比對(duì)試驗(yàn)為基礎(chǔ)�����,支持生物類似藥的安全�����、有效和質(zhì)量可控�����。應(yīng)采用逐步遞進(jìn)的順序�����,分階段開(kāi)展藥學(xué)�����、非臨床和臨床比對(duì)試驗(yàn)�����。監(jiān)管機(jī)構(gòu)正是基于這一全面、逐步遞進(jìn)的比較相似性研究的綜合證據(jù) (totality o evidence) 來(lái)決定是否批準(zhǔn)生物類似藥的上市許可�����,
與化藥仿制藥相比�����,生物類似藥的開(kāi)發(fā)難度更高�����、生產(chǎn)工藝更為復(fù)雜�����、研發(fā)周期更長(zhǎng)�����,因此研發(fā)成本也更高�����。此外�����,在市場(chǎng)推廣方面�����,生物類似藥需要更專業(yè)的醫(yī)生和患者教育以及更高的市場(chǎng)準(zhǔn)入門檻�����。二者的主要特點(diǎn)對(duì)比見(jiàn)表 2 -1�����。
下面將以抗體藥物的研發(fā)為例�����,從工藝�����、質(zhì)量評(píng)價(jià)�����、臨床等幾個(gè)方面來(lái)說(shuō)明產(chǎn)品復(fù)雜性對(duì)于生物類似藥立項(xiàng)考量的影響。
4.1復(fù)雜性
生物類似藥的制備工藝同創(chuàng)新生物藥�����、原研生物藥(參照藥) 一樣�����,涉及獨(dú)特�����、昂貴且耗時(shí)的操作�����。生物類似藥是利用生物合成的大分子藥物�����,使用在良好控制條件下培養(yǎng)的活細(xì)胞系 (工程細(xì)胞株)進(jìn)行表達(dá)制備�����。因此�����,生物類似藥工藝開(kāi)發(fā)的第一步是開(kāi)發(fā)含有目的蛋白基因的工程細(xì)胞株�����,保證目的基因能夠高效率表達(dá)目的蛋白且具有所需的翻譯后修飾�����。在獲得工程細(xì)胞株之后�����,常規(guī)的生物類似藥生產(chǎn)工藝包括3 個(gè)方面:①細(xì)胞擴(kuò)增和蛋白表達(dá)�����;②蛋白分離和純化�����;③制劑和包裝�����。為增加產(chǎn)量、提高生產(chǎn)效率�����、降低風(fēng)險(xiǎn)�����、保證產(chǎn)品質(zhì)量和安全性�����,一次性生物工藝�����、連續(xù)流生產(chǎn)工藝以及模塊化工廠等新型工藝技術(shù)和設(shè)施得到應(yīng)用�����,使生物類似藥生產(chǎn)工藝具有更強(qiáng)的可行性 (圖2-2)�����。
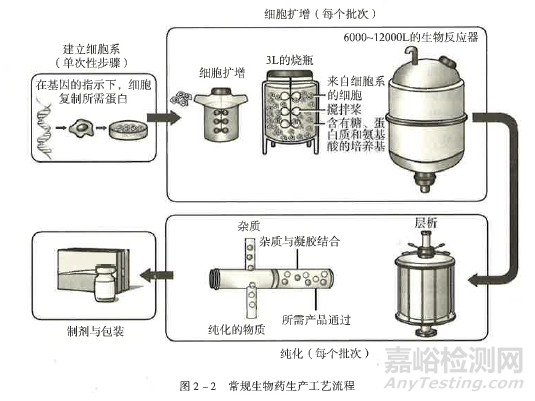
生物類似藥生產(chǎn)工藝的復(fù)雜性�����,決定了整個(gè)生產(chǎn)工藝需嚴(yán)格受控�����,因?yàn)楣に囘^(guò)程中的微小變化可能會(huì)導(dǎo)致最終產(chǎn)品的臨床有效性�����、安全性 (包括免疫原性) 發(fā)生改變�����。另外�����,如果產(chǎn)品生產(chǎn)過(guò)程或儲(chǔ)存過(guò)程引起糖基化�����、脫胺�����、異構(gòu)化、氧化或產(chǎn)生聚集體等產(chǎn)品相關(guān)蛋白或雜質(zhì)的變化�����,也可能會(huì)影響單抗的結(jié)構(gòu)和抗原結(jié)合特性�����。因此�����,需對(duì)生物類似藥生產(chǎn)工藝過(guò)程進(jìn)行嚴(yán)格控制和監(jiān)測(cè)�����,以保證產(chǎn)品的全部質(zhì)量屬性(包括一級(jí)結(jié)構(gòu)�����、高級(jí)結(jié)構(gòu)或構(gòu)象以及翻譯后修飾等特性) 的批間一致性�����。同時(shí)對(duì)參照藥及其制備工藝的深刻理解有助于實(shí)現(xiàn)生物類似藥與其在物質(zhì)基礎(chǔ)上的藥學(xué)相似性�����。質(zhì)量源于設(shè)計(jì) (QbD) 的理念和原則逐漸被業(yè)界應(yīng)用于生物類似藥的開(kāi)發(fā)�����,以一種科學(xué)的�����、基于風(fēng)險(xiǎn)的�����、主動(dòng)的�����、系統(tǒng)的藥物開(kāi)發(fā)方法�����,促進(jìn)對(duì)產(chǎn)品及其生產(chǎn)過(guò)程的理解�����,從而使設(shè)計(jì)出的生物類似藥能夠滿足預(yù)期的臨床性能,并且能夠生產(chǎn)出一致的�����、持續(xù)滿足臨床所需質(zhì)量屬性的產(chǎn)品�����。
生物類似藥本身是一種生物制劑�����,因此�����,所有與批準(zhǔn)生物制劑有關(guān)的 CMC 方面的要求都適用于生物類似藥�����,除此之外�����,還有一個(gè)更為重要的要求一一與參照藥的相似性要求�����。也就是說(shuō)�����,生物類似藥開(kāi)發(fā)商不僅需要通過(guò)最相關(guān)的�����、最先進(jìn)的方法證明其產(chǎn)品本身能夠保持一致的質(zhì)量�����,而且必須證明其與參照藥足夠相似�����。由于不可能完全重現(xiàn)參照藥的生產(chǎn)工藝�����,可能會(huì)引起產(chǎn)品的糖基化和其他翻譯后修飾�����,造成產(chǎn)品異質(zhì)性(包括C 末端均一性、產(chǎn)品相關(guān)蛋白或雜質(zhì)的不同等)�����,生物類似藥開(kāi)發(fā)商還需證明這些不同不會(huì)使生物類似藥與其參照藥在安全性和有效性方面有臨床意義上的差別�����。
4.2產(chǎn)品質(zhì)量評(píng)價(jià)
生物類似藥開(kāi)發(fā)的第一步是建立生物類似藥的目標(biāo)質(zhì)量屬性 (target quality attribute�����,TQA)�����。顯然�����,TOA 是由參照藥的特性定義的�����,而生物類似藥開(kāi)發(fā)的目標(biāo)是使其質(zhì)量屬性盡量與 TOA 高度相似因此,使用最先進(jìn)的正交分析工具對(duì)參照藥進(jìn)行詳細(xì)的表征 (包括識(shí)別批間變異性和雜質(zhì)),是進(jìn)行生物類似藥開(kāi)發(fā)的先決條件�����。為確定參照藥的變異范圍�����,需對(duì)參照藥多批次產(chǎn)品進(jìn)行測(cè)試�����。確定生物類似藥TOA 的主要考慮因素包括:了解哪些質(zhì)量屬性對(duì)其生物學(xué)活性和臨床療效是重要的�����,如單抗的質(zhì)量屬性包括但不限于氨基酸序列�����、純度�����、聚合體�����、電荷異質(zhì)性�����、高級(jí)結(jié)構(gòu)�����、翻譯后修飾(包括糖譜)和生物學(xué)活性�����。@如果參照藥存在多種作用機(jī)制 (mechanism o ation�����,MOA) 和適應(yīng)癥�����,則應(yīng)了解具體適應(yīng)癥的 MOA 和每個(gè) MOA 的目標(biāo)質(zhì)量屬性。
如前所述�����,生物類似藥開(kāi)發(fā)的成功與否取決于一個(gè)逐步遞進(jìn)的過(guò)程�����。在這個(gè)逐步遞進(jìn)的開(kāi)發(fā)過(guò)程中�����,產(chǎn)品質(zhì)量分析數(shù)據(jù)(包括理化特性、生物學(xué)活性�����、純度和雜質(zhì)�����、免疫學(xué)特性等) 所顯示的相似性水平會(huì)影響臨床前和臨床部分的開(kāi)發(fā)。在產(chǎn)品質(zhì)量特征(物質(zhì)基礎(chǔ)) 上盡可能與參照藥保持一致�����,可能會(huì)減少監(jiān)管上對(duì)臨床數(shù)據(jù)的要求。因此�����,在廣泛的產(chǎn)品質(zhì)量分析特征基礎(chǔ)上展示出高水平的相似性是生物類似藥非臨床和臨床研究的基礎(chǔ),并可決定后續(xù)非臨床和臨床研究的內(nèi)容是否可以簡(jiǎn)化。
產(chǎn)品質(zhì)量特性的改變�����,如序列變異�����、分子結(jié)構(gòu)的細(xì)微變化�����、產(chǎn)品相關(guān)雜質(zhì) (氧化、脫氨基�����、聚集體、降解產(chǎn)物)�����、工藝相關(guān)雜質(zhì)(如宿主細(xì)胞蛋白、其他工藝污染物 等,均有可能引起產(chǎn)品免疫原性變化�����,進(jìn)而影響其藥動(dòng)�����、藥代性質(zhì)�����,并進(jìn)一步影響生物類似藥的療效和安全性�����。尤為重要的是�����,生物類似藥給藥后機(jī)體產(chǎn)生的抗藥抗體 (anti- drug atbody,ADA)可能會(huì)中和藥物的活性�����,影響藥物的清除�����、血漿半衰期和組織分布�����,變其藥效動(dòng)力學(xué) (PD) 特征。因此,應(yīng)采用與參照藥一致的技術(shù)和方法來(lái)開(kāi)展非臨床和臨床的免疫原性比對(duì)試驗(yàn)研究。
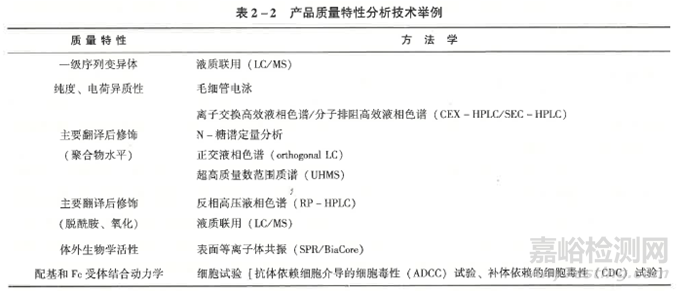
在產(chǎn)品質(zhì)量特性分析比對(duì)試驗(yàn)研究中�����,應(yīng)對(duì)樣品質(zhì)量的批間差異進(jìn)行分析,選擇有代表性的批次進(jìn)行試驗(yàn)�����。研究中,應(yīng)盡可能使用敏感的�����、先進(jìn)的分析技術(shù)和方法檢測(cè)候選藥(生物類似藥) 與參照藥之間可能存在的差異�����。還應(yīng)根據(jù)參照藥的信息�����,評(píng)估每一個(gè)質(zhì)量特性與臨床效果的相關(guān)性�����,并設(shè)立判定相似性的限度范圍�����。對(duì)特性分析的比對(duì)試驗(yàn)研究結(jié)果進(jìn)行綜合評(píng)判時(shí)�����,應(yīng)根據(jù)各質(zhì)量特性與臨床效果的相關(guān)程度評(píng)判相似性的權(quán)重,并設(shè)定標(biāo)準(zhǔn)�����。產(chǎn)品質(zhì)量特性分析比對(duì)試驗(yàn)包括(但不限于) 以下蛋白結(jié)構(gòu)特性及翻譯后修飾特性的比較研究:①一級(jí)結(jié)構(gòu),即氨基酸序列�����;②高級(jí)結(jié)構(gòu),包括二級(jí)三級(jí)�����、四級(jí)結(jié)構(gòu)(適用時(shí));③翻譯后修飾�����,如糖基化�����、磷酸化等 (適用時(shí))�����;④產(chǎn)品相關(guān)物質(zhì),如蛋白脫胺化�����、氧化等(表2-2)�����。
4.3臨床試驗(yàn)及適應(yīng)癥外推
臨床試驗(yàn)作為生物類似藥相似度評(píng)估的最后一步�����,其目的是確認(rèn)生物類似藥在臨床安全性和有效性方面與參照藥是否高度相似并解決任何殘留不確定性 (residual uncertainties)問(wèn)題�����。一旦生物類似藥展示出與參照藥在產(chǎn)品質(zhì)量特征分析中的相似性,生物類似藥開(kāi)發(fā)商就可以部分依賴于參照藥的質(zhì)量安全性和有效性的臨床數(shù)據(jù)�����,而不必從頭開(kāi)展證明安全性和有效性的確證性臨床。由于生物類似藥的使用劑量和給藥方案與參照藥相同�����,生物類似藥開(kāi)發(fā)商也無(wú)須開(kāi)展劑量探索的前期臨床試驗(yàn)�����。Schneider 等人將生物類似藥臨床試驗(yàn)的基本原則總結(jié)如下�����。①第一步必須包括 PK 和 PD 的頭對(duì)頭比較�����。②至少采用一項(xiàng)充分的�����、隨機(jī)的�����、平行對(duì)照的臨床試驗(yàn),最好是雙盲設(shè)計(jì)�����,用以比較生物類似藥和參照藥的有效性和安全性。③采用參照藥建議的劑量�����,以展示生物類似藥臨床療效的等效性 (既不是非劣效也不是非優(yōu)效)。④以確認(rèn)相似性為目標(biāo)�����,應(yīng)選擇對(duì)于檢測(cè)相關(guān)產(chǎn)品質(zhì)量差異 (如果存在的話)最敏感的人群進(jìn)行臨床試驗(yàn)。⑤臨床方案的設(shè)計(jì)應(yīng)與各研究階段支持可比性的逐步遞進(jìn)的比對(duì)試驗(yàn)中獲得的證據(jù)水平相適應(yīng)�����。
生物類似藥與參照藥的等效性比對(duì)試驗(yàn)研究�����,由于比較、確認(rèn)的特性,其通常所需病例數(shù)小于原研創(chuàng)新藥的I期臨床研究(確證性臨床) 的病例數(shù)�����。
在生物類似藥臨床療效比較研究中,需要合理選擇比值或差值作為主要終點(diǎn)指標(biāo)的效應(yīng)量。等效性界值一般基于參照藥療效的置信區(qū)間進(jìn)行估算,并結(jié)合臨床意義進(jìn)行確定�����。參照藥的療效通常依據(jù)參照藥與標(biāo)準(zhǔn)治療(或安慰劑)隨機(jī)對(duì)照優(yōu)效性研究的 Meta 分析結(jié)果來(lái)確定。納入 Meta 分析文獻(xiàn)的選擇�����、分析結(jié)果的利用等�����,需要綜合考慮目標(biāo)適應(yīng)癥的國(guó)內(nèi)外臨床實(shí)踐�����、種族差異、樣本量可行性等因素�����。
對(duì)于經(jīng)過(guò)等效性比對(duì)試驗(yàn)研究證實(shí)臨床相似的生物類似藥�����,可以考慮外推至參照藥的其他適應(yīng)癥該外推的適應(yīng)癥�����,應(yīng)當(dāng)是臨床相關(guān)的病理機(jī)制和(或)有關(guān)受體相同�����,且作用機(jī)理、靶點(diǎn)是相同的�����。另外,臨床比對(duì)試驗(yàn)應(yīng)選擇合適的適應(yīng)癥�����,并確保對(duì)外推適應(yīng)癥的安全性和免疫原性進(jìn)行了充分的評(píng)估�����。盡管如此,也有專家擔(dān)心一種生物類似物對(duì)一種適應(yīng)癥有效的臨床證據(jù)并不一定意味著這種藥物對(duì)另一種適應(yīng)癥有效�����。雖然這些爭(zhēng)議的聲音正在減弱,但還是需要在項(xiàng)目立項(xiàng)時(shí)進(jìn)行充分評(píng)估�����。