摘 要 / Abstract
目的:評價(jià)國內(nèi)不同使用環(huán)節(jié)的人乳頭瘤病毒核酸檢測試劑盒(PCR-熒光探針法)的質(zhì)量現(xiàn)狀����。方法:依據(jù)企業(yè)產(chǎn)品技術(shù)要求�����,對準(zhǔn)確性��、特異性����、檢測限�����、精密度4個項(xiàng)目進(jìn)行檢驗(yàn)��。同時(shí),以國家參考品和細(xì)胞質(zhì)控品為樣品����,進(jìn)行探索性研究。結(jié)果:本次國家監(jiān)督抽檢共抽檢15批次產(chǎn)品��,其中13批次的準(zhǔn)確性����、特異性、檢測限和精密度檢測結(jié)果均符合要求����,2批次結(jié)果因質(zhì)量控制不符合要求判定為不合格,抽檢合格率為87%��。探索性研究結(jié)果顯示��,以國家參考品為樣品進(jìn)行評價(jià)��,6批次試劑盒未能滿足檢測限要求����;以9種不同型別的高、低濃度細(xì)胞質(zhì)控品為樣品進(jìn)行評價(jià),各試劑檢測高濃度樣品符合率較高��,檢測低濃度樣品符合率較低�����。結(jié)論:企業(yè)需進(jìn)一步規(guī)范和完善產(chǎn)品技術(shù)要求��,改進(jìn)和完善企業(yè)參考品和產(chǎn)品的設(shè)計(jì)����,建議采用國家參考品優(yōu)化檢測限標(biāo)準(zhǔn)。
Objective: To evaluate the quality of human papilloma virus nucleic acid detection kits(PCR fluorescence probe method) used in different application stages in China. Methods: According to enterprises' product technical requirements,we conduct tests on accuracy, specificity, limit of detection, and precision. In addition, an exploratory study is performed by evaluating the national reference standards and cell quality control products. Results: A total of 15 batches of kits are examined in the national supervision and sampling inspection. Among them, 13 batches meet the requirements for accuracy,specificity, limit of detection, and precision. The results of 2 batches are deemed unqualified due to non-compliance with quality control standards, resulting in an 87% pass rate. The results of the exploratory study show that 6 batches of kits fail to meet the detection limit requirements when evaluated against national reference standards. When assessing with 9 different types of high and low concentration cell line quality control samples, the coincidence rate of each reagent for detecting high concentration samples is higher, while the coincidence rate for detecting low concentration samples is lower. Conclusion:Enterprises should standardize and improve the technical requirements of products, improve the design of enterprise reference materials and products, and adopts the standards of national reference materials to optimize limit of detection performance.
關(guān) 鍵 詞 / Key words
人乳頭瘤病毒�����;核酸檢測試劑盒�����;國家監(jiān)督抽檢����;質(zhì)量分析
human papilloma virus; nucleic acid detection kit; national supervision and sampling inspection; quality analysis
宮頸癌是全球女性第四大常見癌癥�����。根據(jù)世界衛(wèi)生組織(World Health Organization,WHO)數(shù)據(jù)統(tǒng)計(jì),2020年全球約有60.4萬例宮頸癌新發(fā)病例和34.2萬例死亡病例,其中約90%的新發(fā)病例和死亡病例發(fā)生在低、中等收入國家[1]��。高危型人乳頭瘤病毒(human papilloma virus,HPV)的持續(xù)感染是引發(fā)宮頸癌的主要原因��。由于HPV核酸檢測試劑盒具有較高的靈敏度,逐漸替代細(xì)胞學(xué)或與細(xì)胞學(xué)聯(lián)合檢測用于宮頸癌的篩查[2]����。2021年,WHO更新了《宮頸癌癌前病變篩查和治療指南》,推薦HPV核酸檢測作為宮頸癌初篩的首選方法[3]。目前,HPV核酸(分型)檢測試劑盒眾多,涉及的方法學(xué)較多,包括常見的PCR熒光法和PCR反向雜交法,以及其他方法,如基因芯片法����、酶切信號放大法、雜交捕獲法��、測序法��、飛行時(shí)間質(zhì)譜法等[4-5]�����。PCR熒光法是檢測HPV核酸應(yīng)用最廣的一種方法,通過設(shè)計(jì)針對擴(kuò)增靶區(qū)的引物和標(biāo)記不同熒光信號的特異性探針,對PCR產(chǎn)物進(jìn)行檢測�����。由于PCR熒光法不需要特殊的儀器設(shè)備,操作簡單,醫(yī)院及科研機(jī)構(gòu)等單位廣泛使用該類試劑盒。截至2023年8月,在國家藥品監(jiān)督管理局官網(wǎng)(https://www.nmpa.gov.cn/)上輸入“人乳頭瘤病毒,PCR熒光法”進(jìn)行檢索,統(tǒng)計(jì)檢出13種高危型HPV核酸檢測試劑盒,現(xiàn)有國產(chǎn)及進(jìn)口注冊證共46個,涉及生產(chǎn)企業(yè)34家,分別來自北京�����、上海�����、廣州��、杭州����、廈門等多個城市。HPV核酸檢測試劑盒為第三類醫(yī)療器械產(chǎn)品,其審評審批�����、生產(chǎn)監(jiān)管及市場監(jiān)管均按照我國第三類醫(yī)療器械產(chǎn)品的相關(guān)規(guī)定進(jìn)行管理����。目前,上市產(chǎn)品參照YY/T 1226—2022《人乳頭瘤病毒核酸(分型)檢測試劑盒》行業(yè)標(biāo)準(zhǔn)制定各自的產(chǎn)品技術(shù)要求[6]����。由于產(chǎn)品檢測范圍不同,各企業(yè)的產(chǎn)品標(biāo)準(zhǔn)亦不相同。為加強(qiáng)HPV核酸檢測試劑盒的監(jiān)管,評價(jià)該類產(chǎn)品的質(zhì)量現(xiàn)狀,確保產(chǎn)品在臨床使用中安全有效和質(zhì)量可控,2022年2月,國家藥品監(jiān)督管理局組織開展了HPV核酸檢測試劑盒抽檢工作[7]。本文將對2022年度HPV核酸檢測試劑盒抽檢情況匯總?cè)缦隆?/span>
1����、材料與儀器
1.1 樣品
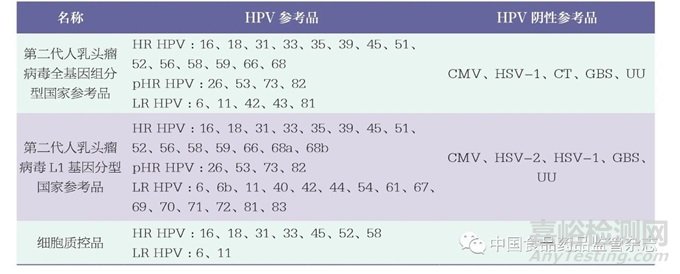
抽檢相關(guān)產(chǎn)品的企業(yè)參考品和相關(guān)信息,由各生產(chǎn)企業(yè)提供。探索性研究評價(jià)用的國家參考品為第二代人乳頭瘤病毒全基因組分型國家參考品(370060-201901)和第二代人乳頭瘤病毒L1基因分型國家參考品(370110-202201),由中國食品藥品檢定研究院提供����;細(xì)胞質(zhì)控品為凍干樣品,由廣東凱普生物科技有限公司提供。國家參考品和細(xì)胞質(zhì)控品的具體組成詳見表1��。其中,國家參考品覆蓋試劑盒檢測范圍內(nèi)的所有型別,細(xì)胞質(zhì)控品覆蓋試劑盒檢測范圍內(nèi)的部分型別����。
表1 國家參考品和細(xì)胞質(zhì)控品的組成
注:HR HPV :高危型HPV ;pHR HPV :潛在高危型HPV ��;LR HPV :低危型HPV ��;CMV :巨細(xì)胞病毒��;HSV :單純皰疹病毒�����;CT :沙眼衣原體��;GBS :B 族鏈球菌;UU :解脲支原體��。
1.2 試劑
人乳頭瘤病毒核酸檢測試劑盒(PCR-熒光探針法)來自北京�����、上海�����、浙江��、河南��、江蘇�����、廣東����、福建的不同企業(yè)及醫(yī)療機(jī)構(gòu),共15批次產(chǎn)品。其中,國產(chǎn)13批次����、進(jìn)口2批次。部分試劑盒為HPV16和HPV18分型,部分試劑盒為全分型,可分2~24種型別����。其中,核酸提取或純化試劑以及其他配套試劑均由企業(yè)及醫(yī)療機(jī)構(gòu)自行提供。
1.3 儀器
ABI7500熒光定量PCR儀(美國賽默飛世爾科技公司)����;SLAN-96S全自動熒光定量PCR儀(上海宏石醫(yī)療科技有限公司);Gene Light 9820全自動醫(yī)用PCR分析系統(tǒng)(廈門安普利生物工程有限公司)����;cobas x480全自動核酸分離純化儀(瑞士羅氏診斷公司)。
2��、方法與結(jié)果
2.1 有效樣本分布統(tǒng)計(jì)
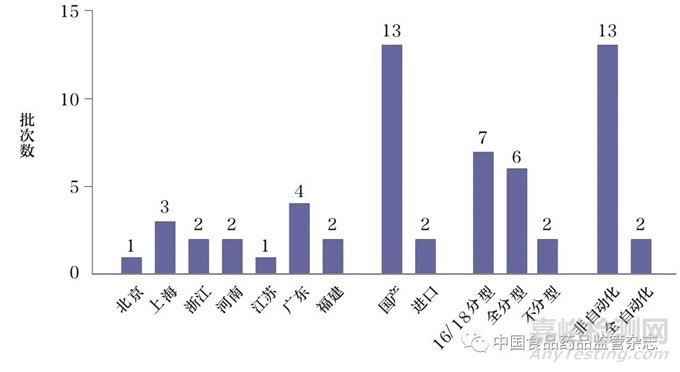
本次抽檢的15批次HPV核酸檢測試劑盒(PCR-熒光探針法)來自北京����、上海、浙江����、河南、江蘇����、廣東和福建(圖1)�����。涉及注冊證共13張,占HPV核酸檢測試劑盒注冊證總數(shù)的28%��。其中,國產(chǎn)注冊證12張,進(jìn)口注冊證1張�����。涉及生產(chǎn)企業(yè)共12家,占HPV核酸檢測試劑盒生產(chǎn)企業(yè)總數(shù)的35%�����。其中,國內(nèi)生產(chǎn)企業(yè)11家(產(chǎn)品13批次),國外生產(chǎn)企業(yè)1家(產(chǎn)品2批次)�����。15批次試劑中8批次來自使用環(huán)節(jié),7批次來自生產(chǎn)環(huán)節(jié)����。上述結(jié)果顯示,抽檢覆蓋率較低��。抽檢的試劑盒大多數(shù)可分型,為HPV16/HPV18分型和全分型��。檢測操作的自動化程度上,大多數(shù)試劑盒自動化程度較低����。
圖1 15批次HPV核酸檢測試劑盒基本信息
2.2 性能檢驗(yàn)
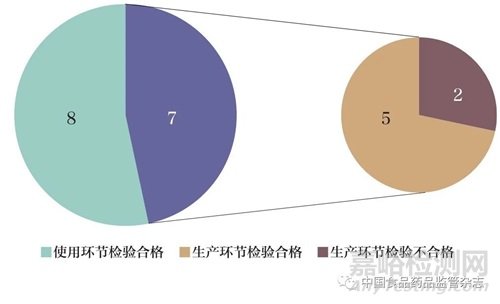
本次檢驗(yàn)項(xiàng)目選擇準(zhǔn)確性����、特異性����、檢測限和精密度4個關(guān)鍵性能指標(biāo)評價(jià),具體內(nèi)容見表2����。按照各生產(chǎn)企業(yè)的產(chǎn)品技術(shù)要求進(jìn)行檢測,其中12批次使用企業(yè)參考品檢測,3批次使用國家參考品檢測。結(jié)果合格產(chǎn)品數(shù)量為13批次,占比為87%��;不合格產(chǎn)品數(shù)量為2批次,占比為13%,均來自生產(chǎn)環(huán)節(jié)(圖2)�����。13批次試劑盒檢測上述性能指標(biāo)均符合相應(yīng)標(biāo)準(zhǔn),不同型別之間無交叉反應(yīng)����。2批次試劑盒檢測結(jié)果不合格,其中1批次試劑盒的陰性對照不成立,檢測內(nèi)標(biāo)通道無循環(huán)數(shù)閾值(cycle threshold,Ct值)或Ct值大于32,不符合試劑盒聲稱的質(zhì)量控制要求;另1批次試劑盒的陽性對照不成立,PCR反應(yīng)液E孔檢測HPV39�����、HPV45和HPV68通道無Ct值或Ct值大于26,不符合試劑盒聲稱的質(zhì)量控制要求。由于質(zhì)控體系不符合要求,造成實(shí)驗(yàn)無效,從而無法判定參考品的檢測結(jié)果�����。推測可能的原因?yàn)樯a(chǎn)環(huán)節(jié)中陰性��、陽性對照的配制或者出廠檢驗(yàn)結(jié)果判定存在問題�����。
表2 檢驗(yàn)項(xiàng)目及性能要求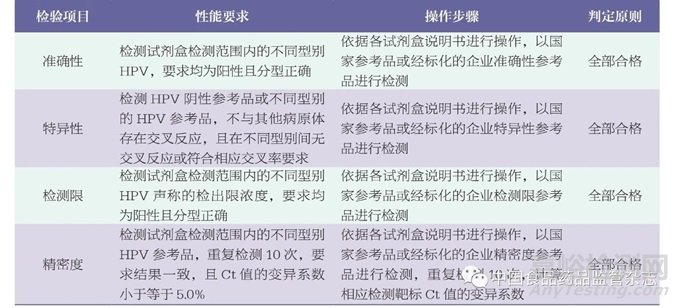
注:檢測結(jié)果首先應(yīng)滿足試劑盒說明書中的質(zhì)量控制要求��,再進(jìn)行結(jié)果判定����;表中任意項(xiàng)判定不合格,本次抽檢綜合結(jié)論為不合格����。
圖2 15批次HPV核酸檢測試劑盒檢測結(jié)果
2.3 探索性研究
2.3.1 檢測限評價(jià)
為了有效評估不同試劑盒檢測新一代國家參考品的檢出能力,使用11批次試劑盒檢測稀釋至最低檢測限的國家參考品。結(jié)果顯示,2批次試劑盒無法檢出HPV68a或HPV68b(表3),提示企業(yè)需要補(bǔ)充完善企業(yè)參考品,并進(jìn)一步評估其準(zhǔn)確性性能�����。4批次試劑盒不符合產(chǎn)品技術(shù)要求聲稱的檢測限,其余試劑盒符合相應(yīng)要求。通過比較企業(yè)參考品和國家參考品的檢測結(jié)果(Ct值)發(fā)現(xiàn),企業(yè)參考品的定量偏差較大,提示企業(yè)需要進(jìn)一步對最低檢測限作詳細(xì)評估��。
表3 HPV核酸檢測試劑盒檢測結(jié)果統(tǒng)計(jì)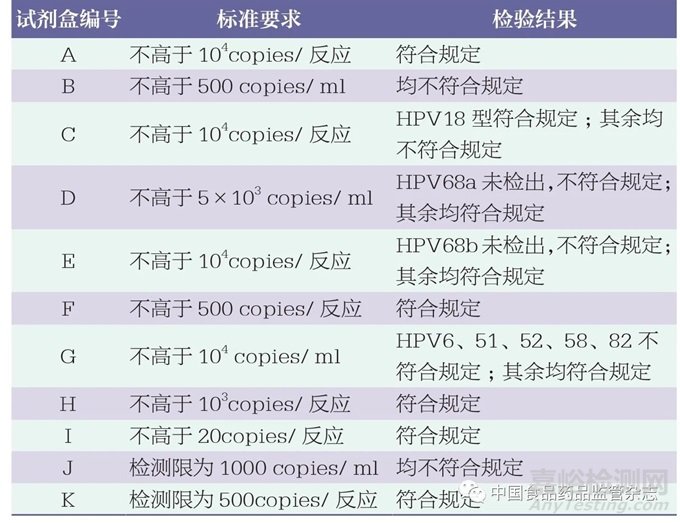
2.3.2 細(xì)胞質(zhì)控品評價(jià)
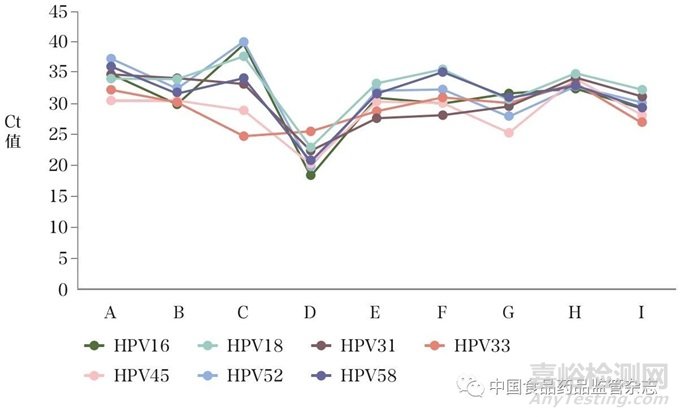
為了有效評估細(xì)胞質(zhì)控品的準(zhǔn)確性和有效性,使用11批次試劑盒檢測高濃度(106copies/ml)和低濃度(104copies/ml)的細(xì)胞質(zhì)控品����。結(jié)果顯示,9批次試劑盒均可以檢出不同型別的高濃度細(xì)胞質(zhì)控品(符合率為11/11),1批次試劑盒無法檢出HPV16、HPV18和HPV52型質(zhì)控品,另外1批次試劑盒無法檢出HPV6型(表4)��。分析檢測不同型別符合率為11/11的9批次試劑盒的Ct值結(jié)果,發(fā)現(xiàn)同一型別HPV細(xì)胞質(zhì)控品的Ct值差異較大,提示檢測結(jié)果的強(qiáng)弱不同(圖3),這可能與各試劑盒配套的核酸純化試劑的提取效率不同有關(guān)��。對于低濃度細(xì)胞質(zhì)控品,11批次試劑盒的檢出能力差異較大,且檢測不同型別的符合率較低,造成這種差異的原因可能與不同檢測試劑盒的分析靈敏度有關(guān)��。
表4 不同型別細(xì)胞質(zhì)控品檢測結(jié)果符合率匯總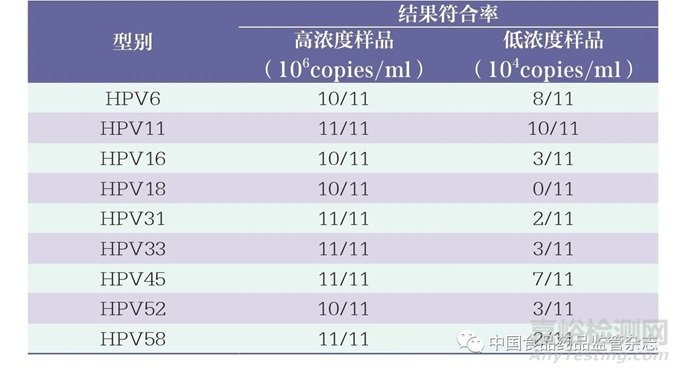
圖3 9批次試劑盒檢測不同型別HPV細(xì)胞質(zhì)控品的Ct值匯總
3�����、討 論
HPV核酸檢測試劑盒因其具有較高的靈敏度和陰性預(yù)測值,在臨床上應(yīng)用較廣����。其檢測結(jié)果的準(zhǔn)確性對于宮頸病變及宮頸癌的篩查具有重要臨床意義[8]��。由于該類試劑盒種類較多,涉及多種方法學(xué),試劑盒的質(zhì)量參差不齊����。行業(yè)標(biāo)準(zhǔn)(YY/T 1226—2014)自2015年7月1日實(shí)施以來,提升了該類試劑盒的質(zhì)量,但依然存在一些問題。2013年和2015年國家藥品監(jiān)管部門開展了HPV檢測試劑盒抽檢工作,發(fā)現(xiàn)存在HPV型別交叉反應(yīng)現(xiàn)象及部分試劑盒缺少內(nèi)控的現(xiàn)象[9-11]。2022年,國家藥品監(jiān)督管理局再次開展該類試劑盒的抽檢工作,評價(jià)其質(zhì)量現(xiàn)狀[7]�����。然而,本次抽檢工作可能受疫情影響,整體覆蓋率不高��。共抽檢15批次產(chǎn)品,2批次產(chǎn)品不合格,不合格檢出率為13%,抽檢產(chǎn)品的總體質(zhì)量一般����。
本次抽檢的檢驗(yàn)依據(jù)為企業(yè)各自的產(chǎn)品技術(shù)要求,考察項(xiàng)目為準(zhǔn)確性、特異性����、檢測限和精密度4個項(xiàng)目。通過資料審核����、檢驗(yàn)檢測和探索性研究,發(fā)現(xiàn)了以下問題及可能存在的風(fēng)險(xiǎn)點(diǎn):①試劑盒的質(zhì)量控制不符合要求,包括陰陽性對照不成立、未設(shè)置內(nèi)對照或陰性對照未參與樣品處理和檢測全過程�����。由于實(shí)驗(yàn)操作中質(zhì)量控制對監(jiān)測整個檢測體系至關(guān)重要,質(zhì)控體系的無效直接影響臨床檢驗(yàn)中檢測結(jié)果的準(zhǔn)確性和可靠性[12]�����。②試劑盒未能檢出檢測范圍內(nèi)的亞型型別,如HPV68a或HPV68b型。這可能與企業(yè)參考品的設(shè)置不夠完善有關(guān)�����。分析各企業(yè)的產(chǎn)品技術(shù)要求,發(fā)現(xiàn)用于出廠或型式檢驗(yàn)的企業(yè)參考盤中準(zhǔn)確性參考品和最低檢測限參考品未覆蓋檢測范圍內(nèi)的所有型別,無法全面評估試劑盒的檢測準(zhǔn)確性和靈敏度�����。性能評估的局限會影響該類試劑盒的質(zhì)量,在臨床應(yīng)用中可能會造成漏檢����。③用于評估試劑盒靈敏度的檢測限參考品量值準(zhǔn)確性差異較大。由于各企業(yè)參考品的定量標(biāo)準(zhǔn)不一,且上一代國家參考品量值的局限性,造成不同企業(yè)最低檢測限的可比性較差����。在臨床應(yīng)用時(shí),造成不同醫(yī)療機(jī)構(gòu)使用不同試劑盒或在同一機(jī)構(gòu)使用不同試劑盒,檢測結(jié)果的一致性較差[13]�����。④參考品亟需更新?lián)Q代?����,F(xiàn)有國家參考品均為質(zhì)粒樣品,無法評估核酸提取環(huán)節(jié)����。在本次抽檢中,使用細(xì)胞質(zhì)控品進(jìn)行評估��。結(jié)果發(fā)現(xiàn),細(xì)胞質(zhì)控品可以有效評估試劑盒的檢測能力,可作為下一代HPV國家參考品的候選樣品����。然而,對于如何有效評估試劑盒核酸提取效率對試劑盒性能的影響及細(xì)胞質(zhì)控品的定量準(zhǔn)確性,需要進(jìn)一步研究��。
為了提升HPV核酸檢測試劑盒的質(zhì)量,確保臨床檢測結(jié)果的準(zhǔn)確可靠,針對本次抽檢作出以下建議:①加大抽檢力度,完善和優(yōu)化抽樣模式,保證抽檢的覆蓋面廣,更加合理評估試劑盒的現(xiàn)狀��。②督促各企業(yè)針對存在的問題進(jìn)行深入分析,促使企業(yè)進(jìn)行改進(jìn)或者變更,以達(dá)到提高產(chǎn)品質(zhì)量這一目的����。③建議標(biāo)準(zhǔn)管理部門加強(qiáng)行業(yè)標(biāo)準(zhǔn)宣貫,企業(yè)及時(shí)關(guān)注行業(yè)標(biāo)準(zhǔn)更新動態(tài),并根據(jù)行業(yè)標(biāo)準(zhǔn)及時(shí)完善產(chǎn)品技術(shù)要求。④不斷優(yōu)化更新國家參考品,更加科學(xué)合理地評價(jià)各試劑盒的檢測性能�����?���?傊?本次抽檢工作為HPV核酸檢測試劑盒的科學(xué)監(jiān)管提供數(shù)據(jù)支撐。積極解決抽檢工作中的問題,在一定程度上有助于提高HPV核酸檢測試劑盒的質(zhì)量,使其更好地服務(wù)于臨床應(yīng)用����。
引用本文
田亞賓,沈舒,劉東來,趙蘭青,石大偉,許四宏*.人乳頭瘤病毒核酸檢測試劑盒國家監(jiān)督抽檢質(zhì)量分析[J].中國食品藥品監(jiān)管,2023(8):58-63.