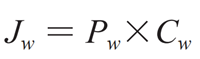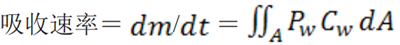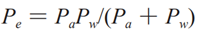人體生物等效性試驗豁免(以下簡稱為“生物豁免”) 是指申請人向藥品監(jiān)管機構(gòu)提供所申請注冊的藥品或已上市藥品的上市后變更����,不適宜進行人體生物等效性試驗或者生物等效體外替代試驗的相關(guān)證明性文件和數(shù)據(jù), 從而免予證明該藥品在體內(nèi)的生物利用度和生物等效的可能性����。
2017 年 11 月����,原國家食品藥品監(jiān)督管理總局仿制藥質(zhì)量與療效一致性評價辦公室經(jīng)組織人員對 289 種基本藥物目錄內(nèi)的品種進行梳理和調(diào)研,并報仿制藥質(zhì)量和療效一致性評價專家委員會審議通過����,擬定了首批擬推薦或簡化生物等效性試驗的品種名單并向社會公開征求意見����。
該名單中共包括可采用藥學(xué)方法評價一致性����、 推薦生物豁免的品種 20 種;
可采用藥學(xué)方法評價一致性����, 但企業(yè)須自證為生物藥劑學(xué)分類系統(tǒng)(biopharmaceutics classification system,BCS)分類 1 或 3 類藥物����,并根據(jù)《人 體生物等效性試驗豁免指導(dǎo)原則》提交溶解度、滲透性����、 溶出度等相關(guān)研究資料的品種 20 種 ;
可采用藥學(xué)方法評價一致性����、以藥代動力學(xué)比較方法評價安全性的品種 4 種;
可僅進行餐后生物等效性研究的品種 1 種����;
可僅進行空腹生物等效性研究的品種 12 種����。
此為各國藥品監(jiān)管機構(gòu)中首次公開發(fā)布擬生物豁免品種名單����。
基于科學(xué)的生物豁免可減少不必要的健康人群對藥物的暴露、節(jié)約一致性評價或仿制藥研發(fā)的研究成本和時間����。
生物豁免在制藥行業(yè)中的呼聲甚高,但對 其科學(xué)性的系統(tǒng)理論研究卻不多����。本文從生物豁免的理論出發(fā),概要闡述可能造成生物不等效的風(fēng)險因素以及生物豁免的風(fēng)險評估與管理����,供制藥企業(yè)和監(jiān)管機構(gòu)在進行生物豁免決策時參考。
一����、生物豁免的適用情況
1 胃腸道局部作用藥物
對作用機制明確����、不良反應(yīng)較明確����、體內(nèi)吸收甚低或不吸收����、不適合進行以藥代動力學(xué)參數(shù)為終點評價指標的人體生物等效性試驗的胃腸道局部作用藥物,可申請生物豁免����。
如:保護胃黏膜、促進胃黏膜修復(fù)作用的鉍劑����;吸附消化道內(nèi)病毒、病菌及它們產(chǎn)生的毒素����,緩解腹瀉的蒙脫石散 ;增加大腸內(nèi)糞便含水量����、緩解成人和 8 歲以上兒童便秘癥狀的聚乙二醇 4000 散;中和胃酸的碳酸氫鈉片等����。
2 溶液制劑
外用溶液劑����、口服溶液劑����、氣霧劑、噴霧劑����、滴鼻劑等溶液制劑,藥品的活性成分呈完全釋出狀態(tài)����,當供試品與參比制劑具有相同的處方,且處方中不含任何對藥品的活性成分吸收有影響的輔料時����,可申請生物豁免。
如果仿制藥采用了不同的輔料且可能會影響藥品的生物等效時����,則不批準其生物豁免申請。
比如����,山梨(糖)醇、 甘露醇和木糖醇均為藥品中常用的輔料����,這些輔料在胃腸道中的吸收較差,會增加腸道的滲透壓����,影響胃腸道中水分的輸送和腸道的運藥時間,還可能影響藥物跨腸壁吸收的速率����,從而影響藥物的吸收 ;
具有滲透影響作用的成分對藥品在上腸道的停留時間影響較小����,而對在下腸道的停留時間影響顯著。
3 同一藥品的不同劑量規(guī)格
對處方相同����、活性成分與輔料比例相似且在不同 pH 溶出介質(zhì)中的體外溶出曲線相似的不同劑量規(guī)格的同種藥品,通常高劑量規(guī)格已做過生物等效性試驗的����,低劑量規(guī)格可申請生物豁免����。
有些品種由于安全性或其他原因����,可選擇較低劑量規(guī)格進行體內(nèi)生物等效性試驗。
4 經(jīng)長期臨床有效性驗證或具有細胞毒性的藥品
對某些藥品����,如果已經(jīng)過長期的臨床有效性驗證或具有細胞毒性,沒有必要進行生物等效性試驗或因可能對健康人體產(chǎn)生不可逆的損傷����,經(jīng)風(fēng)險收益比分析,對可通過與參比制劑比較體外溶出曲線的方法來替代生物等效性試驗����、從而考察仿制藥與參比制劑質(zhì)量和療效一 致性的,可申請生物豁免����。
如美國 FDA 啟動的“藥物有效性執(zhí)行方案”(Drug Efficacy Study Implementation)中 的某些品種,包括異煙肼片����、潑尼松片����、制霉素混懸液等����。
5 基于 BCS 分類的豁免
BCS 是基于藥物本身的溶解性和滲透性進行藥物分類的一種科學(xué)系統(tǒng)����,由 Amidon 等 于 1995 年提出,用于分析普通口服制劑采用體外試驗得出體內(nèi)生物等效的可行性����。
基于 BCS 分類的生物豁免理念自推出以來,已陸續(xù)得到美國����、WHO 和歐盟等藥品監(jiān)管機構(gòu)的認可, 并陸續(xù)出臺了相應(yīng)的法律法規(guī)����、指導(dǎo)原則和豁免條件標準 。
我國原國家食品藥品監(jiān)督管理總局也于 2016 年 5 月發(fā)布了我國基于 BCS 分類的《人體生物等效性試驗豁免指導(dǎo)原則》����。
二����、BCS
Amidon 等認為����,當涉及到口服固體常釋制劑中的活性藥物成分在體內(nèi)的吸收速率和程度時,BCS 主要考慮以下 3 個關(guān)鍵因素����,即藥物溶解性(solubility)、腸道滲透性(intestinal permeability)和制劑溶出度(dissolution)����。
根據(jù)菲克第一定律,在單位時間內(nèi)通過垂直于擴散方向的單位截面積的擴散物質(zhì)流量(擴散通量����,diffusion flux,用 J 表示)與該截面積處的濃度梯度(concentration gradient����,用 C 表示)成正比,也就是說 C 越大����、J 越大����。
將此定律用于藥物在體內(nèi)的吸收即可知����,藥物通過胃腸膜表面的濃度越大,其在胃腸道被吸收的就越多����。
公式(1)
式中 Jw(x, y, z, t)為在任何時間和位點通過胃腸壁的藥物通量(質(zhì)量 / 面積 / 時間)����,Pw(x, y, z, t)為胃腸膜滲透系數(shù),Cw(x, y, z, t)為胃腸膜表面的藥物濃度����。
公式(1)是以藥物在復(fù)雜的胃腸道處符合漏槽條件(即溶出介質(zhì)體積大于藥物溶解所需體積的 3 倍以上)和 Pw 是有效滲透系數(shù)為前提的。
任何時間點的藥物吸收速率即藥物從胃腸道減少的速率為:
公式(2)
吸收過程發(fā)生于整個胃腸道表面����。
在 t 時間點的總吸收質(zhì)量 M 為:
公式(3)
Pw 隨時間不同而不同、吸收位點不同而不同����,如十二指腸����、空腸����、回腸和結(jié)腸的表面形態(tài)具有隨意性, 又如介質(zhì)環(huán)境不同����、藥物在不同腸壁的轉(zhuǎn)運方式不同等,這些都可能影響藥物的滲透性����。
基于以上公式,生物利用度可敘述為:如果 2 種不同的藥品含有相同的活性成分且在胃腸壁表面具有相同的濃度 - 時間曲線����,則它們具有相同的吸收速率和程度。
生物利用度還可進一步敘述為:如果 2 種不同的藥品在所有的胃腸腔條件下均具有相同的溶出曲線����,則它們具有相同的吸收速率和程度。
這些敘述是以藥品處方中不含有可能會影響藥物滲透性和(或)腸道轉(zhuǎn)運的其他成 分為前提的����。
藥品的體內(nèi)溶出與其在胃腸壁濃度的關(guān)系比較復(fù)雜����,受胃腸道復(fù)雜的水動力學(xué)和內(nèi)容物的影響����。
公式(4)
式中 Pe 為有效滲透系數(shù),Pw 為此上討論的胃腸壁滲透系數(shù)����,Pa 為表觀滲透系數(shù)。
根據(jù) BCS����,藥物被分為以下 4 類:
1 類:高溶解性����、高滲透性的藥物;
2 類:低溶解性����、高滲透性的藥物;
3 類:高溶解性����、低滲透性的藥物����;
4 類:低溶解性����、低滲透性的藥物。
三����、生物豁免的風(fēng)險分析與管理
生物豁免可減少人體試驗、縮短研發(fā)周期����、減少研發(fā)投入,但生物豁免后的生物不等效風(fēng)險則可能對藥品的安全性或療效產(chǎn)生不良影響����。
在制藥企業(yè)制定研發(fā)策略時,在監(jiān)管機構(gòu)審評審批生物豁免申請時����,宜綜合分析生物等效性的影響因素,對(擬)申請生物豁免的品種進行定量或定性的風(fēng)險評估����,對潛在風(fēng)險進行預(yù)判和應(yīng)對����,從而對是否申請或批準生物豁免進行科學(xué)的決策����,以減少生物豁免風(fēng)險事件的發(fā)生或減少風(fēng)險事件帶來的不利影響。
1 生物不等效風(fēng)險分析
1)生物不等效風(fēng)險低的情況包括:
(1)BCS 分類 1 類藥物����。國際藥學(xué)聯(lián)合會出版的生物豁免專刊中提及����,BCS 分類 1 類的藥物中有多種藥物的口服常釋制劑可以予以生物豁免,如阿司匹林����、鹽酸 多西環(huán)素����、鹽酸普萘洛爾、硫酸伯氨喹����、司他夫定����、潑尼松����、潑尼松龍、左氧氟沙星����、甲硝唑、鹽酸阿米替林����、 鹽酸維拉帕米和氯喹。
但硫酸奎尼丁和硫酸奎寧由于治療指數(shù)窄����,它們的口服常釋制劑不能予于生物豁免。
(2)部分 BCS 分類 3 類藥物����。根據(jù)國際藥學(xué)聯(lián)合會出版的生物豁免專刊����,BCS 分類 3 類藥物中口服常釋制劑可以予于生物豁免的藥物包括對乙酰氨基酚����、阿昔洛韋����、阿替洛爾、西咪替丁����、乙胺丁醇、異煙肼����、拉米夫定、 甲氧氯普胺����、吡嗪酰胺和雷尼替丁。
以鹽酸二甲雙胍片為例����。文獻記載����,鹽酸二甲雙胍片如在 1 h 內(nèi)溶出達到 100%����,則其可與口服鹽酸二甲雙胍溶液達到相同的生物利用度����。
研究顯示,鹽酸二甲雙胍片是生物不等效風(fēng)險低的品種����,在單點溶出度符合要求的情況下,即使仿制藥與原研藥的體外溶出曲線差別較大����,人體生物等效性試驗結(jié)果也具有生物等效性。
該例子表明����,體外溶出曲線存在差異并不意味著在體內(nèi)一定生物不等效。
2)生物不等效風(fēng)險高的情況包括:
(1)大部分 BCS 分類 2 類藥物����。根據(jù)國際藥學(xué)聯(lián)合會出版的生物豁免專刊����,僅有 3 種 BCS 分類 2 類藥物的口服常釋制劑可以予于生物豁免����,這 3 種藥物均為非甾體抗炎藥����,即雙氯芬酸鈉 / 鉀����、布洛芬和酮洛芬,它們均為弱酸性藥物����,在酸性條件下溶解度低,但在 pH 6.8 的小腸環(huán)境中溶解度高����。
一項對 500 項生物等效性試驗的薈萃分析表明,BCS 分類 2 類藥物出現(xiàn)生物不等效的 風(fēng)險較分類 1 和 3 類藥物高 4 倍����。
(2)BCS 分類 4 類藥物。此類藥物由于溶解性和滲透性均低,不能予于生物豁免����,屬生物不等效風(fēng)險高的藥物����。
(3)口服緩 / 控釋和定位釋放制劑。與普通口服常釋制劑相比����,口服緩 / 控釋和定位釋放制劑的處方、工藝更復(fù)雜����,影響藥物溶出或釋放的因素更多,進入人體消化道后在不同部位的溶出或釋放特點不同����,在體內(nèi)的吸收過程也更復(fù)雜,一般也屬生物不等效風(fēng)險高的藥品����。
對于此類藥品����,應(yīng)研究和尋找與體內(nèi)吸收行為有相關(guān)性的體外溶出或釋放的試驗方法����,只有采用具有體內(nèi)體外相關(guān)性的溶出或釋放評價方法才能預(yù)測其體內(nèi)吸收行為����。
仿制藥與參比制劑的多條溶出曲線接近有利于、但不能保證它們體內(nèi)的吸收速率和程度相似����,關(guān)鍵是要有與體內(nèi)吸收行為具有相關(guān)性的體外溶出或釋放試驗的方法及結(jié)果。
(4)其他高風(fēng)險因素����。如治療窗狹窄且臨床使用中不監(jiān)測血藥濃度的藥品;用于特殊人群如老人����、兒童、孕婦的藥品����,或?qū)俑呶!⒓本人幤返?���;處方中輔料影響吸收的藥品 ����;質(zhì)量標準不能良好地反映藥品質(zhì)量的藥品����;高變異性藥品����;藥代動力學(xué)性質(zhì)呈非線性的藥品等。
2 生物豁免的風(fēng)險分析
從廣義上來說����,生物豁免風(fēng)險主要包括:
(1)藥學(xué)等效、但生物不等效����,由此對藥品的療效與安全性產(chǎn)生不良后果。
(2)不同國家的藥品監(jiān)管機構(gòu)對生物豁免的接受程度不同����。比如,目前美國和歐盟已接受基于 BCS 分類的生物豁免����,但日本尚無批準先例����。
(3)生物豁免常需提前申請����,可能會在一定程度上延長藥品的申報注冊時間。
此外����,雖然目前多個國家或組織的藥品監(jiān)管機構(gòu)已發(fā)布了生物豁免相關(guān)的指導(dǎo)原則,但還均尚屬綱領(lǐng)性指導(dǎo)原則����,可操作性不強,申報單位在進行相關(guān)研究及申報注冊時可能面臨不知從何入手的問題����,不同的審評審批人員在審評審批時也可能具有不同的見解與判斷標準,從而作出不同的審批結(jié)論����。
3 生物豁免的風(fēng)險管理
風(fēng)險管理是指識別出風(fēng)險點之后把風(fēng)險可能造成的不良影響減至最低的管理過程。針對以上生物豁免的風(fēng)險����,申報單位或監(jiān)管機構(gòu)可采取以下風(fēng)險管理措施:
(1)如前分析����,可能造成生物不等效的影響因素眾多����,包括藥品的藥學(xué)性質(zhì)、制劑性質(zhì)����、藥代動力學(xué)性質(zhì)等����, 且不同影響因素對生物不等效的風(fēng)險及對藥品的安全性和療效的影響程度也不同。應(yīng)用科學(xué)的定性和(或)定量方法對生物豁免后生物不等效的風(fēng)險進行評估可為選擇進行生物等效性試驗還是申請生物豁免提供重要的決策依據(jù)����。
另外,采用通過監(jiān)測治療窗狹窄藥品用藥后的血藥濃度����、處方上與原研藥保持一致、不采用可能影響藥物吸收的輔料等方法也可降低藥品的生物不等效風(fēng)險����。
(2)綜合分析不同藥品監(jiān)管機構(gòu)的藥品審評審批理念與標準����,制定綜合性的藥品研發(fā)與注冊策略����。
(3)對擬申請生物豁免的品種,宜綜合分析生物豁免的可行性����,充分準備生物豁免相關(guān)的研究資料,并盡量在研發(fā)過程中提前與審評審批機構(gòu)就研究方法等技術(shù)問題進行溝通����,溝通方法參見原國家食品藥品監(jiān)督管理總局發(fā)布的《藥物研發(fā)與技術(shù)審評溝通交流管理辦法(試 行)》。
結(jié)語
隨著人們對口服制劑的性質(zhì)和藥物體內(nèi)吸收的動力學(xué)性質(zhì)的了解越來越多����,加之已有更科學(xué)、合理的體外試驗方法用于預(yù)測藥物的體內(nèi)吸收過程����,生物豁免的界定范圍將會得到科學(xué)的擴大,從而使更多的藥品獲準生物豁免����。
這不僅能為眾多的制藥公司節(jié)約大量資金投入����,也能減少健康人體對藥物的暴露����、縮短仿制藥的研發(fā)周期及費用,最終對廣大患者也是有利的����。
文章來源:《上海醫(yī)藥》2018年第39卷第3期
原標題:《仿制藥一致性評價中人體生物等效性試驗豁免的風(fēng)險分析與管理》
作者:廖萍 張景辰 李帥 龔前飛 陳桂良