導(dǎo)語:本篇內(nèi)容為學(xué)習(xí)總結(jié),源自審評三部劉文博老師關(guān)于《醫(yī)療器械生物學(xué)評價的技術(shù)審評考量》在器審中心學(xué)習(xí)云課程的講座�����。內(nèi)容主要涵蓋四個方面:生物相容性風(fēng)險�����、現(xiàn)行法規(guī)標(biāo)準(zhǔn)�、生物學(xué)評價技術(shù)審評基本要求及常見問題分析�。首先���,介紹了生物學(xué)相容性相關(guān)概念及其潛在風(fēng)險,并對現(xiàn)行法規(guī)標(biāo)準(zhǔn)(GB/T16886)進(jìn)行了概述�。重點講解了生物學(xué)評價的三大路徑�,同時強(qiáng)調(diào)生物學(xué)評價并非僅在注冊階段進(jìn)行���,而是在產(chǎn)品設(shè)計開發(fā)階段需結(jié)合風(fēng)險管理開展���。詳細(xì)解析了生物學(xué)評價技術(shù)審評的基本要求(即 121 文件的具體要求)�。最后���,作者根據(jù)列舉的生物學(xué)評價常見問題進(jìn)行了歸納和總結(jié)�,為大家提供一些參考���。
第一部分:生物相容性風(fēng)險
首先生物相容性概念���,按照我國新版標(biāo)準(zhǔn) GB/T 16886.1-2022���,生物相容性是指醫(yī)療器械或材料在特定應(yīng)用中具有適宜宿主反應(yīng)的能力���。
當(dāng)醫(yī)療器械植入到人體以后,它的作用是相互的���,一方面是材料或者是器械對于人體組織會產(chǎn)生一些反應(yīng)(分為組織反應(yīng)�、血液反應(yīng)以及免疫反應(yīng))�;同時器械植入人體以后,本身也會發(fā)生一些變化(比如:那個髖關(guān)節(jié)假體磨損�,還有植物的表面形態(tài)影響和變化,還有一些像可吸收材料可吸收縫線等材料降解���,金屬材料腐蝕�����,還有像心臟瓣膜等會有一些鈣化的現(xiàn)象)�。
那我們要從兩個方面進(jìn)行評價,一方面是對人體對材料的影響�,另外方面就是評價一下它和組織相容性。
劉老師通過兩個案例�,法國 PIP 公司乳房植入體案例(2010法國P IP公司使用了工業(yè)級的硅膠生產(chǎn)乳房植入物,導(dǎo)致不良反應(yīng)最后產(chǎn)品召回公司破產(chǎn))和天津眼用全氟丙烷氣體案例(2015年天津一家公司生產(chǎn)的眼用全氟丙烷氣體因生產(chǎn)中含有雜質(zhì)導(dǎo)致“含量”不符合產(chǎn)品標(biāo)準(zhǔn)要求引起的群體性不良事件)���,闡述了生物相容性問題可能帶來的風(fēng)險�。
通過這兩個案例我們得知當(dāng)醫(yī)療器械存在生物相容性的問題���,可能產(chǎn)生危害�����。最后劉老師�,強(qiáng)調(diào)了生物學(xué)評價的定位:生物學(xué)評價它是在風(fēng)險管理過程范疇中的活動�����,它是作為醫(yī)療器械總體評價和開發(fā)過程組成的部分���。
在醫(yī)療器械制備初期���,生物學(xué)評價至關(guān)重要���,而不僅僅在注冊申報前才予以考慮。在選擇材料時���,需確保其對人體無毒�,生產(chǎn)工藝設(shè)定時也要考慮去除雜質(zhì)�����,并對去除工藝進(jìn)行驗證���。此外,在臨床實驗前���,醫(yī)療機(jī)構(gòu)的倫理委員會會對醫(yī)療器械的生物學(xué)評價進(jìn)行審查�����。
第二部分:生物學(xué)評價的規(guī)章���、標(biāo)準(zhǔn)和技術(shù)指南
該部分主要介紹了醫(yī)療器械相關(guān)的規(guī)章���、技術(shù)文件以及生物學(xué)評價的要求。整體介紹了注冊資料中生物學(xué)評價的撰寫要求解析�����,以及生物學(xué)評價路徑進(jìn)行了詳細(xì)介紹���。
首先���,NMPA發(fā)布的《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告》(2021年第121號)(以下簡稱121 號文,微信公眾號回復(fù) 注冊申報 即可獲得)詳細(xì)闡述了醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式�����,其中包括生物學(xué)特性研究及評價的資料�。其次,GB/T 16886 系列標(biāo)準(zhǔn)(由ISO 10993系列標(biāo)準(zhǔn)基本上是等同轉(zhuǎn)化的���,共19個)針對醫(yī)療器械生物學(xué)評價�,同時還有一些行業(yè)標(biāo)準(zhǔn)作為參考(YY/T 0870遺傳毒性和YY/T 1292生殖和發(fā)育毒性系列標(biāo)準(zhǔn))。此外�����,《醫(yī)療器械已知可瀝濾物測定方法驗證及確認(rèn)的注冊技術(shù)審查指導(dǎo)原則》等技術(shù)審評指南文件也對生物學(xué)評價進(jìn)行了規(guī)定���。在具體類別的醫(yī)療器械技術(shù)審評指南中���,也有生物學(xué)評價的相關(guān)內(nèi)容。121 號文件的附件 5 進(jìn)一步解析了生物學(xué)評價的基本要求�。
除GB/T 16886 及行業(yè)標(biāo)準(zhǔn)外,劉老師也介紹了目前正在制定的一些文件���,包括:
醫(yī)療器械未知可瀝濾物評價方法建立及表征技術(shù)審查指導(dǎo)原則(征求意見稿)》制定中
《醫(yī)療器械生物學(xué)評價指導(dǎo)原則第1部分:總則(征求意見稿) 》制定中
《醫(yī)療器械生物學(xué)評價 第2部分:生物學(xué)試驗 技術(shù)審評要點》制定中
《醫(yī)療器械生物學(xué)評價 第3部分:物理及化學(xué)表征 技術(shù)審評要點》制定中
第三部分:生物學(xué)評價技術(shù)審評基本要求解析
隨后劉老師重點圍繞121號附件5內(nèi)容關(guān)于生物學(xué)特性研究的6條內(nèi)容分別展開了詳細(xì)的介紹�����。
1. 描述產(chǎn)品所用材料及與人體接觸性質(zhì),設(shè)計和生產(chǎn)過程中可能引入的污染物和殘留物�,設(shè)計和生產(chǎn)過程中可能產(chǎn)生的析出物(包括濾瀝物和/或蒸發(fā)物)、降解產(chǎn)物�����、加工殘留物,與醫(yī)療器械直接接觸的包裝材料等相關(guān)信息
該部分主要介紹了醫(yī)療器械生物學(xué)評價中關(guān)于產(chǎn)品材料與人體接觸性質(zhì)�����、接觸方式�����、接觸時間和接觸組織的分類���。根據(jù)接觸時間�,醫(yī)療器械可分為短期(<24h)�����、長期(24h-30d)和持久接觸(>30d)器械�����。按照接觸方式和接觸組織分類一般分為:不接觸人體�����、表面器械(完好表面�����、損傷表面、黏膜)���、外部接入器械(組織/骨/牙本質(zhì)�����、血路�����,間接�����、循環(huán)血液)和植入器械(骨�、組織�、血液)。同時���,內(nèi)容還提到了生物學(xué)評價中需要注意的產(chǎn)品使用方式(比如說是否像隱形眼鏡一樣,它會有一個頻繁更換累積使用的情況)�、材料信息獲取、供應(yīng)商溝通等方面。
關(guān)于材料信息的獲取方式�,劉老師列舉了如下幾種方式:
材料化學(xué)名稱和結(jié)構(gòu)式 (IUPAC、CAS�����、 USAN名稱及編號)
材料供應(yīng)南提供的信息(材料組成成分配方���、技術(shù)規(guī)范���、可能引入的污染物和殘留物、己有定性定量研究)
醫(yī)療器械的加工方�����、組件制造商提供的信息(加工助劑的使用情況及定性定量研究)
生物材料相關(guān)的國家�、行業(yè)、國際標(biāo)準(zhǔn)
材料主文檔(管理部門或第三方機(jī)構(gòu)建立的材料控制文件Master File 及材料數(shù)據(jù)庫)
器械制造商提供的信息(加工助劑殘留物�、可能 l入的污染物、可能產(chǎn)生的析出物及降解產(chǎn)物等)
初包裝供應(yīng)商提供的相關(guān)信息(包裝生物學(xué)評價資料�、安全性支持資料等)
因為某些材料可能是共混物或共聚物,雖然牌號可能固定�,但成分仍相當(dāng)多樣。此時�,我們可以請供應(yīng)商提供具體信息和技術(shù)規(guī)范�����。此外�,有些原材料供應(yīng)商會對原材料進(jìn)行生物學(xué)評價和實驗���,以評估其在生產(chǎn)過程中可能產(chǎn)生的污染物或殘留物�����。他們是否進(jìn)行了前期定性定量研究�?如果供應(yīng)商委托第三方進(jìn)行醫(yī)療器械加工或某個程序的中間架構(gòu)�����,可以由加工方提供的加工助劑使用情況和定量分析研究�。
另外,如果器械使用的是生物材料�����,應(yīng)明確相應(yīng)的國家���、行業(yè)或國際標(biāo)準(zhǔn)���,并提供符合這些標(biāo)準(zhǔn)的證明文件。如果由于保密原因���,原材料供應(yīng)商不愿向醫(yī)療器械制造商透露技術(shù)秘密���,可以由供應(yīng)商向國家藥監(jiān)局登記原材料主文檔,以便我們在審查醫(yī)療器械產(chǎn)品時獲取原材料的更多信息�����。
此外�,醫(yī)療器械制造商應(yīng)對其生產(chǎn)產(chǎn)品的使用情況和助劑使用情況有深入了解,并在資料中如實反饋�����。對于液體類產(chǎn)品�,我們主要關(guān)注初包裝的生物相容性和安全性信息,這部分可以由包裝供應(yīng)商提供相關(guān)資料�����。
2 描述申報產(chǎn)品的物理和/或化學(xué)信息并考慮材料表征(如適用)���,如器械的物理作用可能產(chǎn)生生物學(xué)風(fēng)險���,應(yīng)當(dāng)進(jìn)行評價
主要涉及醫(yī)療器械申報產(chǎn)品物理和化學(xué)信息的描述�,以及材料表征的考慮�����。對于可能產(chǎn)生生物學(xué)風(fēng)險的器械物理作用�,需進(jìn)行評價。
以下六種情況需要深入開展化學(xué)表征研究:
缺乏長期臨床使用史的材料:提供更多化學(xué)信息研究數(shù)據(jù)���。
成熟材料出現(xiàn)非預(yù)期結(jié)果:如碳金屬制備植入器械在細(xì)胞毒性實驗中出現(xiàn)陽性結(jié)果���,需進(jìn)行化學(xué)表征,找出原因�。
器械材料在人體內(nèi)發(fā)生變化:如骨水泥等,需考慮聚合和降解過程�����,提供相關(guān)研究資料�。
已知毒性材料醫(yī)療器械:預(yù)期設(shè)計需使用已知有毒性材料,需進(jìn)行深入表征研究�����。
新材料制備的醫(yī)療器械:在生產(chǎn)過程中使用新物質(zhì),需開展化學(xué)標(biāo)準(zhǔn)數(shù)據(jù)評價�。
物理特性:如多孔材料�����、顆粒大小�、形狀和表面形態(tài)等,對生物相容性產(chǎn)生影響�,尤其是局部植入反應(yīng)、血栓形成和免疫刺激等�。
案例方面,劉老師舉例介紹了乳房植入相關(guān)的大細(xì)胞淋巴瘤���,由于某特殊表面毛面假體發(fā)生率較高�,與表面粗糙度有關(guān)�����。不同粗糙程度的乳房植入體表現(xiàn)出不同程度的慢性長期免疫反應(yīng)�����。因此,在評估醫(yī)療器械生物學(xué)風(fēng)險時�,需關(guān)注物理和化學(xué)特性以及相關(guān)表征研究。
3.生物學(xué)評價的策略�、依據(jù)和方法
任何預(yù)期用于人體的材料和器械,其評價都應(yīng)遵循 YY/T 0316 標(biāo)準(zhǔn)���,以確保在整個風(fēng)險管理過程中對生物學(xué)評價的全面考慮�。
具體的評價過程可以參考GB/T 16886.1 附錄 B 中詳細(xì)的評價過程和要求�����。同時���,評價程序應(yīng)按照 GB/T 16886.1 的評價流程圖進(jìn)行�,以確保評價的準(zhǔn)確性�。需要注意的是,器械具有其特殊性���,即使是同一企業(yè)的潛在產(chǎn)品�,或者是新企業(yè)首次研發(fā)的產(chǎn)品�,其評價過程也會有所不同。因此,評價應(yīng)根據(jù)實際情況進(jìn)行�,并在注冊申報時明確所參考的路線,并進(jìn)行詳細(xì)說明���。對于各個具體終點的評價方法���,可以參考相關(guān)系列標(biāo)準(zhǔn)的具體方法,以確保評價的全面和準(zhǔn)確性�����。在注冊申報時�����,需明確參考的評價路線并詳細(xì)說明�。針對具體評價方法���,可參考相關(guān)系列標(biāo)準(zhǔn)�����。GB/T 16886.1 的圖 1 展示了風(fēng)險管理組成部分的醫(yī)療器械評價系統(tǒng)方法框圖�。
4.已有數(shù)據(jù)和結(jié)果的評價
121 號文和 2007 年的 345 號文件(《醫(yī)療器械生物學(xué)評價和審查指南》 微信公眾號內(nèi)回復(fù) 生物學(xué)指南 即可獲得)要求提供已有數(shù)據(jù)和結(jié)果的評價,包括:
(1)國內(nèi)外相關(guān)文獻(xiàn)檢索和評審:為生物學(xué)評價提供支撐性材料�,如材料表征方法、毒理學(xué)評估等�����。
如:醫(yī)療器械材料表征數(shù)據(jù)及評估(科學(xué)及公認(rèn)的表征方法有哪些���? 毒理學(xué)閾值是多少�����?)�、己經(jīng)開展過的生物學(xué)試驗(己有的該類產(chǎn)品或材料的生物學(xué)試驗結(jié)果提示哪些潛在風(fēng)險�����?)和臨床使用信息(是否存在該類產(chǎn)品或材料生物相容性相關(guān)的不良事件情況�����?)
(2)醫(yī)療器械材料的表征數(shù)據(jù)和評估:關(guān)注產(chǎn)品中可萃取物質(zhì)的系統(tǒng)分析�,參考 GB/T 16886.18 中列舉的化學(xué)表征方法(對于聚合物金屬陶瓷還有天然大分子,它都列舉了常見化學(xué)表征的方法�����,有數(shù)10種之多)。
這里劉老師采用茶包泡茶舉了一個特別好理解的例子���,我們評價的不單單是茶包�,還要更要關(guān)注從茶包里邊萃取出來的這些物質(zhì)���,就要對這些可萃取的物質(zhì)來進(jìn)行系統(tǒng)分析���。
(3)已有生物學(xué)實驗報告:
要求國內(nèi)實驗室具備 CMA 標(biāo)識,國外實驗室需符合 GLP 要求���,并提供質(zhì)量保證文件。實驗過程中需參考生物學(xué)評價標(biāo)準(zhǔn)和臨床使用信息���。
(4)器械的臨床使用信息和/或臨床研究結(jié)論總結(jié)評價
考慮生物體內(nèi)實驗結(jié)果的差異���,收集相關(guān)醫(yī)療器械臨床數(shù)據(jù);關(guān)注可能導(dǎo)致的不良反應(yīng)�����,獲取充足的臨床信息。
鑒于材料在動物體內(nèi)出現(xiàn)組織反應(yīng)時���,在人體內(nèi)不一定出現(xiàn)同樣的反應(yīng)�����,且對于通過生物學(xué)試驗己證實是最好的材料�����,由于人體間的差異�����,也會在某些人身上產(chǎn)生不良反應(yīng)���。因此,在醫(yī)療器械己經(jīng)有臨床評價數(shù)據(jù)的情況下�����,應(yīng)當(dāng)充分利用己獲取的臨床信息進(jìn)行評價���。醫(yī)療器械臨床數(shù)據(jù)主要來自于:
國內(nèi)外相關(guān)該醫(yī)療器械/材料的臨床研究報道���;
該醫(yī)療器械在上市前開展的醫(yī)療器械臨床研究;
該醫(yī)療器械上市后從臨床中獲取的數(shù)據(jù),包括醫(yī)療器械不良事件的報道和報告���。
這些已有數(shù)據(jù)對醫(yī)療器械的生物學(xué)評價至關(guān)重要�����,有助于預(yù)測和預(yù)防潛在風(fēng)險�。在評價過程中�����,需遵循相關(guān)標(biāo)準(zhǔn)和規(guī)定�����,確保評價的準(zhǔn)確性和全面性�����。
5.選擇或豁免生物學(xué)試驗的理由和論證
通過審查以下三個方面形成的文件�����,我們可以評估是否可以免除生物學(xué)實驗:
第一方面涉及材料���、化學(xué)�����、物理等同性以及毒理學(xué)等相關(guān)驗證資料�。對這些方面的評估有助于確保產(chǎn)品符合相關(guān)標(biāo)準(zhǔn)���。
第二方面包括證明該類產(chǎn)品具有可論證的安全使用臨床歷史的相關(guān)文獻(xiàn)資料�����。這些資料有助于證實產(chǎn)品在臨床使用中的安全性���。
第三方面關(guān)注申報產(chǎn)品與已上市產(chǎn)品在接觸方式、制造和滅菌工藝方面是否具有等同性�。對于存在差異的部分,需分析其是否會影響生物相容性�,并提交相關(guān)分析證據(jù)�。
通過對這三個方面的綜合評估,我們可以明確是否豁免生物學(xué)實驗�,并確保產(chǎn)品符合醫(yī)療器械相關(guān)法規(guī)要求。
6.完成生物學(xué)評價所需的其他數(shù)據(jù)
該內(nèi)容主要講述了醫(yī)療器械生物學(xué)評價的相關(guān)規(guī)定和流程�����。其中�����,121 號文件提到了關(guān)于釋放顆粒進(jìn)入患者和使用者體內(nèi)的影響�����,以及納米材料納米顆粒對人體影響的問題。在生物學(xué)評價過程中�����,需要關(guān)注材料的化學(xué)組成���、比例�、物理特性�、工藝滅菌方法等方面�。
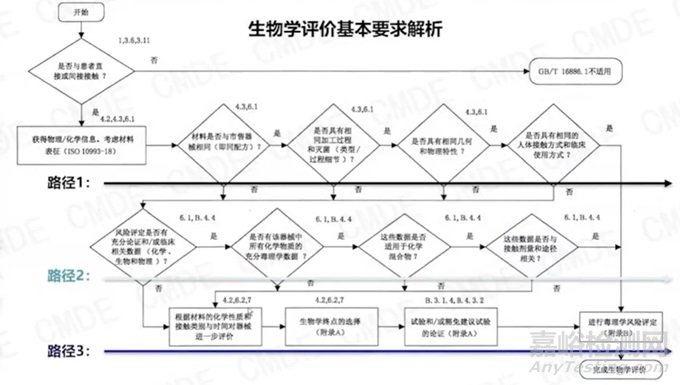
評價流程可分為三個路徑(由于整體內(nèi)容較多,后續(xù)專門整理發(fā)文):
路徑一為通過與國內(nèi)市售器械毒理學(xué)等同性進(jìn)行評價(一般是自家生產(chǎn)的上市產(chǎn)品對比�,往往比其他家上市產(chǎn)品更具有可操作性和可實現(xiàn)性):中國已上市產(chǎn)品,材料(配方)包括組成成分及可瀝濾物���、加工過程和滅菌(考慮加工工藝引入物質(zhì)及對終產(chǎn)品的影響)���、幾何和物理特性(表面形態(tài)、多孔結(jié)構(gòu)���、縱橫比�����、厚度�、納米顆粒���、親疏水���、溶脹、耐磨性等)���、臨床使用方式(如連續(xù)佩戴�����、使用前溶解等)等�����。
路徑二為通過可瀝濾物化學(xué)表征及毒理學(xué)分析進(jìn)行評價�����,關(guān)注化學(xué)物質(zhì)毒理數(shù)據(jù)來源和適用性���。
路徑三為通過生物學(xué)試驗進(jìn)行評價�����,需關(guān)注實驗項目與器械總體設(shè)計相適應(yīng)���,預(yù)期接觸人體的方式和時間,以及實驗?zāi)P偷倪x擇等�����。具體可參考嘔心瀝血篇 | 淺談醫(yī)療器械生物相容性評價�����。
第四部分:生物學(xué)評價的常見問題分析
劉老師詳細(xì)介紹了生物學(xué)評價資料整體技術(shù)申評關(guān)注點���,這里總結(jié)如下:
符合法規(guī)要求:是否符合121號文件以及相應(yīng)的公告通知中對于生物學(xué)試驗機(jī)構(gòu)資質(zhì)的要求。
符合GB/T 16886系列標(biāo)準(zhǔn):評價流程是否按照GB/T 16886系列標(biāo)準(zhǔn)的要求進(jìn)行�,包括評價路徑、理由等�。
結(jié)合產(chǎn)品預(yù)期用途:生物學(xué)評價是否與產(chǎn)品的預(yù)期用途相結(jié)合,特別是在適用范圍�����、預(yù)期人群(如兒童)�、預(yù)期使用方式以及可能存在的累積接觸等方面。
綜合已有信息:生物學(xué)評價是否綜合了已有的文獻(xiàn)�、以前生物學(xué)評價的經(jīng)驗以及其他臨床前研究方面的信息,如化學(xué)表征�、物理表面特性等。
評價報告完整性:生物學(xué)評價報告是否匯總了所有的數(shù)據(jù)和實驗結(jié)果�����,以及是否考慮了潛在的毒性風(fēng)險,并在開展研究時采取了一些其他措施�,如降低浸提比例或進(jìn)行稀釋處理。
利用已有臨床數(shù)據(jù):在生物學(xué)評價過程中�,是否充分利用了已有的臨床評價數(shù)據(jù)來提高評價的質(zhì)量。
在開展材料表征和毒理學(xué)分析時���,需要特別關(guān)注那些可能存在潛在毒性的數(shù)據(jù)�����,以確保評價的準(zhǔn)確性和完整性���。
此外,劉老師特別強(qiáng)調(diào)了關(guān)于材料表征及毒理學(xué)分析評審關(guān)注要點���,總結(jié)如下:
(1)材料表征的全面性:材料表征是否涵蓋了主要材料成分以及提取出來的成分�,確保能捕捉到器械中釋放的所有化學(xué)物質(zhì)�����。對新成分是否進(jìn)行了必要的定性定量檢測�。
(2)化學(xué)表征的充分性:針對各類材料,在現(xiàn)有技術(shù)手段下�����,是否對所有目標(biāo)化學(xué)物質(zhì)進(jìn)行了有針對性的測試,確?��;瘜W(xué)表征的充分性�。
(3)檢測方法的靈敏度:檢測方法是否足夠靈敏���,以便捕捉到可能存在的潛在毒性。
(4)在進(jìn)行等同性比較時���,我們需要遵循毒理學(xué)等同性原則。當(dāng)采用路徑二���,利用相關(guān)化學(xué)物質(zhì)的毒理數(shù)據(jù)進(jìn)行評估時,需要確保毒理數(shù)據(jù)的來源充分合理,并對每一種潛在毒性的化學(xué)物質(zhì)都有充足的毒理學(xué)數(shù)據(jù)�,以驗證其在人體可接受的安全范圍內(nèi)。
(5)在排除顆粒物化學(xué)物質(zhì)的存在或按照YY/T 0316 標(biāo)準(zhǔn)對化學(xué)成分進(jìn)行安全使用評價并評估風(fēng)險后,若得出可接受風(fēng)險的結(jié)論,則可能無需再進(jìn)行其他實驗���。
在采用路徑三生物學(xué)試驗進(jìn)行生物學(xué)評價時,劉老師也介紹了生物學(xué)試驗評審關(guān)注點�����,作者總結(jié)如下:
與產(chǎn)品設(shè)計相適應(yīng):生物學(xué)實驗應(yīng)與產(chǎn)品的總體設(shè)計和最終用途相匹配�����。在選擇實驗項目和終點時�����,要考慮產(chǎn)品的最終用途以及其在人體內(nèi)的狀態(tài)���。例如���,戊二醛保存的牛心包瓣膜在使用前需要清洗�����,因此在進(jìn)行生物學(xué)實驗時���,要確保實驗條件與實際使用情況一致。
預(yù)期接觸方式和時間:根據(jù)產(chǎn)品預(yù)期與人體接觸的方式和時間�,選擇相應(yīng)的生物學(xué)評價終點。
實驗項目的選擇:并非表 A.1 中推薦的實驗項目都要進(jìn)行�����,要根據(jù)產(chǎn)品具體情況來選擇���。同時,有些表 A.1 未列出的實驗項目(如輔助生殖用液���、鼠培實驗等)可能也需要進(jìn)行���。
實驗條件應(yīng)合理:實驗?zāi)P汀φ者x擇�����、觀察時間、樣本量�����、制備浸提方式等條件都應(yīng)科學(xué)合理�。如有國家或國際標(biāo)準(zhǔn),應(yīng)優(yōu)先參考�����。若不適宜�,需提供理由并可選替代方法,并提供相關(guān)驗證資料�����。
使用代表性樣品:在無菌最終產(chǎn)品或取自最終產(chǎn)品的代表性樣品上進(jìn)行實驗�����。若無法使用終產(chǎn)品(如體積過大)�����,需提供理由,并確保所用樣品經(jīng)過相同加工和滅菌方式�。
考慮動物福利:在保證實驗數(shù)據(jù)充足的前提下,盡量減少實驗動物數(shù)量�����,以兼顧人類安全和動物福利���。
多個組件及不同接觸方式的評價:針對多個組件或不同接觸方式�����,分別進(jìn)行評價�。實驗報告應(yīng)詳細(xì)���、完整,包括制樣方法�、實驗細(xì)節(jié)、結(jié)果分析等�。
生物學(xué)報告的完整性:可參考 GB/T 16886 系列標(biāo)準(zhǔn)及其他國家或行業(yè)標(biāo)準(zhǔn),確保生物學(xué)報告的內(nèi)容完整性���。
通過以上關(guān)注點�����,確保生物學(xué)評價的準(zhǔn)確性和合規(guī)性�����。
最后���,劉老師介紹了9個常見的問題�。這里不在一一列舉具體的問題了���,結(jié)合問題的類型和形式作者總結(jié)概括如下:
(1)前代產(chǎn)品生物學(xué)報告的利用:若前代產(chǎn)品為國內(nèi)市售同類產(chǎn)品���,且已證明等同性,則無需提供原有產(chǎn)品的生物學(xué)實驗報告�。但若前代產(chǎn)品未上市或存在不同之處,需提供相關(guān)生物學(xué)實驗報告�����。
(2)生物學(xué)相容性影響因素:影響因素
產(chǎn)品材料化學(xué)組成���、各組成材料比例���、產(chǎn)品物理結(jié)構(gòu)���、表面特性、原材料供應(yīng)商及技術(shù)規(guī)范�、生產(chǎn)工藝、滅菌方法���、內(nèi)包裝材料(如適用�,主要涉及液體類產(chǎn)品���、濕態(tài)保存產(chǎn)品)�����。在申報產(chǎn)品與本企業(yè)同類產(chǎn)品存在差異時�,需考慮這些因素���,并結(jié)合相關(guān)驗證資料進(jìn)行評價。
(3)不同生物學(xué)評價路徑的選擇:根據(jù)產(chǎn)品具體情況�,選擇合適的評價路徑。有些項目可通過濾濾物表征和毒理學(xué)分析充分評價,而有些項目需要考慮表面形態(tài)等因素���。
(4)重新進(jìn)行生物學(xué)評價的情況:如原材料來源改變�,需重新進(jìn)行生物學(xué)評價�。但并非所有情況下都需要全套重新做實驗,而是要根據(jù)變化引起的潛在風(fēng)險來判斷�����。(微信公眾號內(nèi) 回復(fù)材料變化�,可獲得詳細(xì)的指南性文件)。
(5)細(xì)胞毒性異常問題:對于含藥器械�����、生物活性材料器械和含銅工業(yè)節(jié)育器等產(chǎn)品�����,需關(guān)注其細(xì)胞毒性���。如有陽性結(jié)果�,需結(jié)合已有文獻(xiàn)和研究來確定導(dǎo)致細(xì)胞毒性的成分���,并進(jìn)一步評價�。
(6)毒理學(xué)分析數(shù)據(jù)涵蓋性:無可觀察到不良反應(yīng)水平劑量(NOAEL)和最低可觀察到不良反應(yīng)水平劑量(LOAEL)數(shù)據(jù)應(yīng)源于與所研究終點相關(guān)的研究。例如�,源手全身毒性研究的NOAEL和LOAEL通常可用于豁免進(jìn)行急性���、亞慢性或長期全身毒性試驗���,但是可能與遺傳毒性,局部和全身致癌性�����、致致敏.刺激或生殖毒性評價無關(guān)(如果在選擇用于確立NOAEL或
LOAEL的研究中未對這些終點進(jìn)行評價)�����;對于局部植入反應(yīng)�、血栓形成等生物學(xué)評價項目,器械的物理結(jié)構(gòu)���、表面特性等對結(jié)果影響較大���,無法完全依靠可瀝濾物毒理學(xué)分析方法完成評價。
(7)委托單生物學(xué)試驗機(jī)構(gòu)資質(zhì):目前要求市國內(nèi)的實驗室CMA的標(biāo)識�,并且在其承檢范圍內(nèi)來開展相關(guān)的實驗;國外實驗室則需要GLP�。
最后劉老師強(qiáng)調(diào)生物學(xué)評價貫穿整個研發(fā)過程:在設(shè)計變更、原材料供應(yīng)商更改等情況下���,都需要重新進(jìn)行生物學(xué)評價���。同時也總結(jié)了在生物學(xué)評價中,企業(yè)面臨的挑戰(zhàn)包括:
風(fēng)險瓶理念未形成:部分企業(yè)僅關(guān)注實驗結(jié)果�����,而忽略生物學(xué)評價貫穿整個研發(fā)過程的重要性���。
生物學(xué)評價依賴實驗:實驗耗時耗力�,涉及動物處理倫理�����,且有些實驗條件較難實現(xiàn)�����。
新材料、新技術(shù)�、新工藝的涌現(xiàn):為生物相容性評價帶來新挑戰(zhàn)。
結(jié)束語:針對這些挑戰(zhàn)���,建議重視醫(yī)療器械的風(fēng)險受益綜合評價�����,減少對實驗的依賴���,充分利用已有的生物學(xué)評價資料。同時���,開展規(guī)范的文獻(xiàn)數(shù)據(jù)檢索篩選���,遵循檢索剔除循證研究相關(guān)規(guī)則,針對不同類型的材料進(jìn)行充分的物理化學(xué)表征�,以支持非生物學(xué)實驗方式的評價路徑。