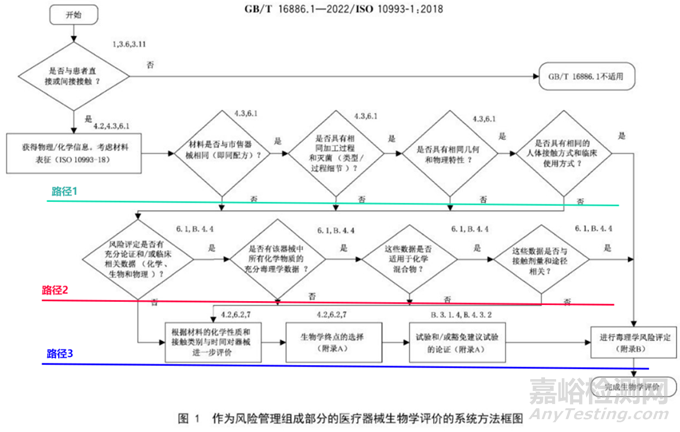
總體而言���,根據(jù)GB/T 16886.1-2022圖1 可以得知,醫(yī)療器械的生物學(xué)評價(jià)可通過以下三種路徑進(jìn)行評價(jià):
路徑1為通過與國內(nèi)市售器械毒理學(xué)等同性的方式進(jìn)行評價(jià)
路徑2為通過可瀝濾物化學(xué)表征及毒理學(xué)分析的方式進(jìn)行評價(jià)
路徑3為通過生物學(xué)試驗(yàn)的方式進(jìn)行評價(jià)
后續(xù)將分別根據(jù)劉老師介紹的內(nèi)容進(jìn)行歸納總結(jié)提煉���。
第一部分:路徑1-通過與國內(nèi)市售器械毒理學(xué)等同性的方式進(jìn)行評價(jià)
在開始進(jìn)行生物學(xué)評價(jià)之前需要確認(rèn)否接觸���,如果不接觸,則不適用���,無需進(jìn)行生物學(xué)評價(jià)���。如果接觸,則繼續(xù)往下一個(gè)邏輯框進(jìn)行���。首先���,獲取相應(yīng)的物理化學(xué)信息,然后對材料進(jìn)行表征���。接下來���,在獲取這些信息后,需要與市售的器械進(jìn)行等同性比較���。
需要說明的是:“市售器械”指的是中國已上市的器械���。國外的已上市器械不符合要求,如果說選擇一個(gè)國外的國內(nèi)都沒有上市的產(chǎn)品���,其實(shí)它到底是不是符合要求你不知道���,所以你選擇跟他建立等同性也是沒有必要的���。因此要證明等同性,需要與在國內(nèi)上市的器械建立等同性���。這個(gè)與臨床器械選擇對照品的原則是一樣的���。同時(shí)在對比中,需要按照邏輯框分別進(jìn)行���。
1.材料(配方)包括組成成分及可瀝濾物:
這里劉老師采用茶包泡茶舉了一個(gè)特別好理解的例子���,關(guān)于材料的配方組成,我們評價(jià)的不單單是茶包���,還要更要關(guān)注從茶包里邊萃取出來的這些物質(zhì)���,就要對這些可萃取的物質(zhì)來進(jìn)行系統(tǒng)分析。
2.加工過程和滅菌(考慮加工工藝引入物質(zhì)及對終產(chǎn)品的影響)
對于加工過程和滅菌方式���,因?yàn)檫@些往往會(huì)引入相關(guān)物質(zhì)���,并且對終產(chǎn)品的生物學(xué)風(fēng)險(xiǎn)造成一些影響���,所以這也是需要重點(diǎn)考慮的���。綜合上面幾點(diǎn)���,其實(shí)我們可以看出來,如果一個(gè)企業(yè)和自家生產(chǎn)的已上市的產(chǎn)品來進(jìn)行比較���,還是具更現(xiàn)實(shí)���,也具有可操作性。你往往不知道其他家的它生產(chǎn)加工過程���,就更別說里邊過程細(xì)節(jié)了���。
3.幾何和物理特性(表面形態(tài)、多孔結(jié)構(gòu)���、縱橫比���、厚度���、納米顆粒、親疏水���、溶脹���、耐磨性等)
那么路徑一后面的這兩個(gè)框,一個(gè)是是否具有相同的幾何和物理特性���?這幾何物理特性就是前面咱們也提到了���,它對于某些生物學(xué)終點(diǎn)還是有一個(gè)比較大的影響的,包括表面形態(tài)���、多孔結(jié)構(gòu)等等���。
4. 臨床使用方式(如連續(xù)佩戴、使用前溶解等)
根據(jù)接觸時(shí)間���,醫(yī)療器械可分為短期(<24h)���、長期(24h-30d)和持久接觸(>30d)器械���。按照接觸方式和接觸組織分類一般分為:不接觸人體、表面器械(完好表面���、損傷表面、黏膜)���、外部接入器械(組織/骨/牙本質(zhì)���、血路,間接���、循環(huán)血液)和植入器械(骨���、組織、血液)���。
Endolee���,公眾號:器械研發(fā)那些事
淺談醫(yī)療器械生物學(xué)評價(jià)的技術(shù)評審關(guān)注點(diǎn)
接觸方式前面也都列的比較清楚了,包括標(biāo)準(zhǔn)里面也都列了這種方式,是不是有連續(xù)使用佩戴���、累積接觸的情況���。還有有些產(chǎn)品它是進(jìn)入人體,它會(huì)經(jīng)過一些處理���,比如說那個(gè)要進(jìn)行一些溶解���,然后再進(jìn)行一個(gè)注射,這些使用方式進(jìn)入人體的方式是不一樣的���,這些都是要進(jìn)行等同性比較的���。
如淺談醫(yī)療器械生物學(xué)評價(jià)的技術(shù)評審關(guān)注點(diǎn)介紹所述,只有當(dāng)以下任何影響生物相容性的因素完全一致時(shí)���,基本認(rèn)定符合路徑1���。這些因素包括:
產(chǎn)品材料化學(xué)組成、各組成材料比例���、產(chǎn)品物理結(jié)構(gòu)���、表面特性���、原材料供應(yīng)商及技術(shù)規(guī)范、生產(chǎn)工藝���、滅菌方法���、內(nèi)包裝材料(如適用���,主要涉及液體類產(chǎn)品���、濕態(tài)保存產(chǎn)品)。在申報(bào)產(chǎn)品與本企業(yè)同類產(chǎn)品存在差異時(shí)���,需考慮這些因素���,并結(jié)合相關(guān)驗(yàn)證資料進(jìn)行評價(jià),需要說明的是我們在做生物學(xué)試驗(yàn)時(shí)選擇替代品的依據(jù)也是從以上方面一一對比���。
需要說明的是因?yàn)椴煌脑牧系墓?yīng)商���,它原材料���,不同的原材料,那種本身生物學(xué)風(fēng)險(xiǎn)就不一樣了���,包括像聚乳酸���,常見的這種可吸收的這種聚合物材料,它有多種不同的聚合方式���,那同樣料式聚合方式���,溶液聚合,它可能也會(huì)用到不同的引發(fā)劑���。對于液體類的���,還有一些濕態(tài)保存的料,要考慮它的內(nèi)包裝材料���,所以這些如果是完全一樣的話���,那可以基本認(rèn)定它是具有一個(gè)等同性的���。那么這時(shí)候如果是自己企業(yè)自己申報(bào)一個(gè)新的產(chǎn)品,它和它的潛在產(chǎn)品-已經(jīng)上市的產(chǎn)品來進(jìn)行比較的話���,那這時(shí)候基本上就是提供一些聲明以及證明性文件���,比如說供應(yīng)商一致,這些基本上就不需要再提供其他額外實(shí)驗(yàn)資料了���,基本上就可以認(rèn)定它等同性。
如果是和其他家產(chǎn)品對比:你要引起一個(gè)等同性判定���,這時(shí)候可能就需要開展化學(xué)表征數(shù)據(jù)���,進(jìn)行一些可濾瀝物的分析,通過這塊來判定它的毒理學(xué)具有一個(gè)等同性���。關(guān)鍵原則是:
擬用材料和生產(chǎn)過程引入物質(zhì)所具有的毒理學(xué)或生物相容性不低于同類臨床己確定材料(對照市售產(chǎn)品)���。
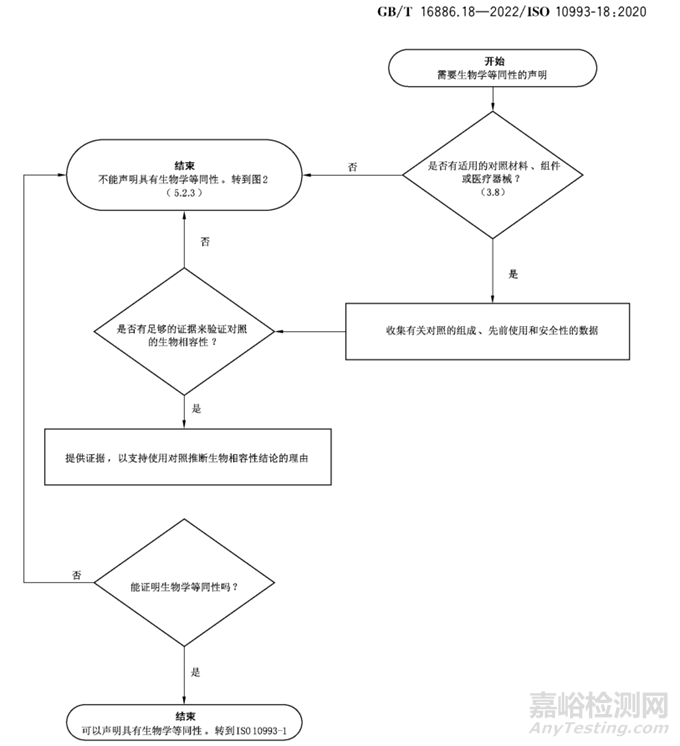
圖2 生物學(xué)等同性流程圖
然后GB/T16886.18的附錄c里面它給出來那么8條判定毒理學(xué)等同性原則���,包括進(jìn)行顆粒物分析,或者跟一上市產(chǎn)品才是等同的���。具體如下:
- 擬用材料的成分和可溶出物與臨床己確立材料等同���;
- 擬用材料與現(xiàn)行標(biāo)準(zhǔn)中規(guī)定的預(yù)期用途、接觸時(shí)間和侵入程度;
- 擬用材料己在比其擬用接觸方式侵入橫渡更高接觸中被確立���;
- 擬用材料的可瀝濾物限量不超過GB/T 16886.17 -ISO 10993.17規(guī)定的允許限量;
- 擬用材料中含有的化學(xué)物質(zhì)或殘留物比其所取代的臨床己確立材料更具毒理學(xué)安全性(假定接觸相同)���;
- 擬用材料中含有的化學(xué)物組分或殘留物比臨床已確立材料中所替代物具有更好的毒理學(xué)安全全性(假定接觸相同);
- 在可溶出物成分種類與總量不變的情況下���,批用材料 臨床已確立材料僅有的區(qū)別是前者中的添加劑/污染物/殘留物水平比后者有所降低或己經(jīng)排除���;
-在相對總量不變的情況下,擬用材料與臨床己確立材料僅有的區(qū)別是前者所使用的加工條件與后者相比產(chǎn)生的可溶出物水平有所降低���。
還有申報(bào)產(chǎn)品與現(xiàn)行標(biāo)準(zhǔn)中規(guī)定的預(yù)期的用途接觸方式侵入程度是相當(dāng)?shù)?��,然后相關(guān)的可濾瀝物限量比市售產(chǎn)品要高那么一點(diǎn)���,也沒有關(guān)系,那就評估一下這一種物質(zhì)高出來的程度是不是在人體可接受的安全閾值之內(nèi)���?如果說還是安全的���,那也可以基本上判定它毒理學(xué)的等同性。然后具體的這些大家可以下來來看看相應(yīng)標(biāo)準(zhǔn)���,在實(shí)際進(jìn)行毒理學(xué)等同性判的時(shí)候���,看一下實(shí)際的產(chǎn)品和市售產(chǎn)品相比,是不是能夠建立等同性���。
第二部分:路徑2-通過可瀝濾物化學(xué)表征及毒理學(xué)分析的方式進(jìn)行評價(jià)
如果說圖1綠色線以下有一條是否���,那么就得選擇路徑2進(jìn)行了���?��?傮w來說���,路徑2是通過可瀝濾物化學(xué)表征及毒理學(xué)分析的方式進(jìn)行評價(jià)。
路徑2的第一個(gè)框圖���,風(fēng)險(xiǎn)評定是否有充分論證和/或臨床相關(guān)數(shù)數(shù)據(jù)���,包括化學(xué)、生物���、物理方面數(shù)據(jù)���。第二個(gè)框圖是是否有該產(chǎn)品中所有化學(xué)物質(zhì)的充分毒理學(xué)的數(shù)據(jù),那這塊主要強(qiáng)調(diào)的是材料是不是已經(jīng)有了相同應(yīng)用或者說應(yīng)用程度���,接觸人體的水平更苛刻的一種臨床的安全使用史���,還有相關(guān)信息是不是能能夠獲得很好的展示。所以你說你用的牌號的材料���,某某企業(yè)它也用過���,怎么怎么證明呢���?是不是有注冊證書上有相應(yīng)體現(xiàn),還是說你是通過其他方式獲得的那信息需要提供���,需要明確���。然后這里邊提到的所有的化學(xué)的物質(zhì),就是包括材料和包括了可濾瀝物物質(zhì)的各類的這種材料���,盡可能去獲取這種所有的材料毒理學(xué)數(shù)據(jù)���,比較預(yù)期接觸劑量和安全劑量,比如說和耐受攝入值���,預(yù)期產(chǎn)品里邊和在人體當(dāng)中植入量是多少���?按表面積算也好,按重量算也好���,植入量和安全劑量���,Ti是不是低于 Ti,還有一些成分確實(shí)是缺乏相應(yīng)毒理學(xué)數(shù)值���,但是成分是比較恒量的特別少���,也可以考慮用提取一些毒理或閾值的方法,這些相關(guān)的 GB/T16886系列標(biāo)準(zhǔn)都有具體的介紹���。
路徑2里邊后邊的兩個(gè)框圖:我們需要關(guān)注數(shù)據(jù)是否適用于化學(xué)混合物���,即材料方面。醫(yī)療器械所使用的材料種類繁多���,機(jī)械用材料亦然���。此外,在提取這些材料的過程中���,以及材料在降解過程中產(chǎn)生的降解產(chǎn)物和衍生物,都可能發(fā)生相互作用,導(dǎo)致毒性相較于單一物質(zhì)時(shí)更高或更低���。其次���,原位聚合的化學(xué)反應(yīng)可能會(huì)在人體內(nèi)產(chǎn)生新的物質(zhì),這意味著我們需要開展新的毒理學(xué)研究以評估相關(guān)風(fēng)險(xiǎn)���。最后���,關(guān)于化學(xué)物質(zhì)的實(shí)用性���,我們可以一方面查閱文獻(xiàn)���,另一方面參考類似物質(zhì)進(jìn)行分析,以便進(jìn)行全面評估���?��?傊卺t(yī)療器械領(lǐng)域���,毒理學(xué)研究至關(guān)重要���,以確保產(chǎn)品安全可靠���。
另一個(gè)框圖探討了這些數(shù)據(jù)是否與接觸劑量和途徑相關(guān)���。在毒理學(xué)評價(jià)中,我們制定了人體可接受的閾值���。這些閾值是基于致畸性或全身毒性實(shí)驗(yàn)得出的���。對于通過不同途徑(如經(jīng)血液注射、吸入呼吸或經(jīng)口)獲得的毒理學(xué)數(shù)據(jù)���,需要謹(jǐn)慎外推,并提供充分的依據(jù)���。如果非要外推���,需要確?��;瘜W(xué)物質(zhì)的安全閾值不會(huì)被超出。
對于路徑2���,GB/T16886.18有相應(yīng)的化學(xué)表征流程圖���。其中關(guān)鍵原則是確定所有定量組分,采用浸提法估計(jì)臨床接觸的量���,確保每種化學(xué)物質(zhì)的量都不超過毒理學(xué)的安全閾值。
這部分內(nèi)容涉及允許限量建立過程���、毒理學(xué)值 Ti 的確定以及相關(guān)因子的應(yīng)用���。當(dāng)路徑2的框圖出現(xiàn)否定情況時(shí),將進(jìn)入路徑3���。
第三部分:路徑3為通過生物學(xué)試驗(yàn)的方式進(jìn)行評價(jià)
關(guān)于路徑3通過生物學(xué)試驗(yàn)方式進(jìn)行評價(jià),前面撰寫過一篇詳細(xì)的攻略���,具體參見嘔心瀝血篇 | 淺談醫(yī)療器械生物相容性評價(jià)���。本文就不過多詳細(xì)的介紹了���。
路徑3的第一步是根據(jù)材料的化學(xué)性質(zhì)和接觸類型、時(shí)間對器械進(jìn)行進(jìn)一步評估���?��;瘜W(xué)性質(zhì)包括臨床使用歷史���,對于全新材料���,需要考慮慢性毒性、致癌性和毒代動(dòng)力學(xué)等方面���。如果接觸人體后會(huì)發(fā)生持續(xù)反應(yīng)���,可先在體內(nèi)和體外開展實(shí)驗(yàn)���,讓物質(zhì)發(fā)生反應(yīng)���,再進(jìn)行生物學(xué)實(shí)驗(yàn)���,這也是一種生物學(xué)評價(jià)方法。接觸類型和時(shí)間與生物學(xué)終點(diǎn)項(xiàng)目的選擇有關(guān)���。
針對器械的評價(jià)針對的是終產(chǎn)品���,而非原材料���。如確實(shí)需要選擇替代品���,需要說明具體的理由,并對產(chǎn)品材料化學(xué)組成���、各組成材料比例���、產(chǎn)品物理結(jié)構(gòu)、表面特性���、原材料供應(yīng)商及技術(shù)規(guī)范���、生產(chǎn)工藝、滅菌方法���、內(nèi)包裝材料一一進(jìn)行分析���,對比差異性,最好做到無差異性���。器械在生產(chǎn)加工過程中(包括滅菌過程)可能產(chǎn)生新物質(zhì)���。路徑3的后續(xù)框圖涉及生物學(xué)終點(diǎn)的選擇���、實(shí)驗(yàn)及豁免建議的論證���。這里提到了常用的表 A.1���,用于不同接觸類型實(shí)驗(yàn)終點(diǎn)選擇���。需要注意的是���,表 A.1 并非實(shí)驗(yàn)核查清單,并非所有產(chǎn)品都需要按照清單進(jìn)行實(shí)驗(yàn)選擇���。它僅作為評價(jià)終點(diǎn)���,即需要評估生物學(xué)終點(diǎn)。但如果已有充分?jǐn)?shù)據(jù)���,可能無需進(jìn)行額外生物學(xué)實(shí)驗(yàn)���。
對于特定器械���,可能需要額外考慮���。盡管這些器械在圖中未明確提及,但相關(guān)研究仍需開展���。例如���,非血管支架用于惡性腫瘤治療時(shí)���,無需進(jìn)行毒性研究,因?yàn)樗鼈冊诎┌Y患者生存期內(nèi)保留植入產(chǎn)品���。表 A.2 中有關(guān)終點(diǎn)的說明需基于風(fēng)險(xiǎn)考慮。相較于前一版本的 A.1���,表 A.1 涉及的終點(diǎn)顯著增多���,說明從風(fēng)險(xiǎn)角度出發(fā),需要考慮更多因素���。但并非所有風(fēng)險(xiǎn)都需要進(jìn)行實(shí)驗(yàn)���,A.1 提供了不同接觸性質(zhì)���、組織類型���、接觸時(shí)間的生物學(xué)評價(jià)終點(diǎn)。其中,物理和/或化學(xué)信息是必備的���。各個(gè)終點(diǎn)多數(shù)情況下需進(jìn)行評估���,但鼓勵(lì)利用現(xiàn)有數(shù)據(jù)進(jìn)行評估���。全身毒性可通過動(dòng)物實(shí)驗(yàn)研究獲得相關(guān)信息���,無需開展標(biāo)準(zhǔn)化實(shí)驗(yàn)。致癌性方面���,許多物質(zhì)可能通過人體某一部位接觸產(chǎn)生可浸提物���,進(jìn)入全身循環(huán),因此需考慮潛在致癌物質(zhì)���。此外���,要考慮生殖發(fā)育毒性���,尤其是針對新型材料���、已知毒性材料和特定人群的接觸生殖器官的器械���。最后,提供生物降解信息���。
無論哪個(gè)路徑���,最后都需要進(jìn)行毒理學(xué)風(fēng)險(xiǎn)評估,并參考附錄 B���。附錄 B 包括背景信息���、生物學(xué)評價(jià)風(fēng)險(xiǎn)管理行為實(shí)施、風(fēng)險(xiǎn)管理指南和特定領(lǐng)域評價(jià)指南���?��?梢愿鶕?jù)附錄 B 撰寫生物學(xué)評價(jià)報(bào)告���,從而完成生物學(xué)評價(jià)���。