質(zhì)量管理模塊作為GMP檢查六大體系(質(zhì)量�����、實驗室��、生產(chǎn)���、設(shè)施及設(shè)備、物料系統(tǒng)����、包裝和標(biāo)簽)的重要環(huán)節(jié)及核心內(nèi)容��,是支撐的藥品質(zhì)量體系的基石��。ICH Q10中描述藥物質(zhì)量體系主要包括四個要素,分別是工藝性能和產(chǎn)品質(zhì)量監(jiān)督體系、糾正和預(yù)防措施體系(CAPA)����、管理變更體系、工藝性能和產(chǎn)品質(zhì)量的管理審核體系����,CAPA是藥品質(zhì)量體系的重要組成部分。
CAPA于2006年首次由FDA正式引入制藥行業(yè)����。CAPA是指對存在的或潛在的不合格或不期望情況的原因進(jìn)行調(diào)查分析�����,采取措施以防止問題再發(fā)生或避免發(fā)生的全部活動。CAPA不僅是就事論事的對單個問題(偏差���、OOS)情況的處理�����,更是從根本上調(diào)查產(chǎn)生問題的原因,采取適當(dāng)和有效的糾正和/或預(yù)防措施以防止其再次發(fā)生�����。對于藥企來說��,涉及影響藥品質(zhì)量和安全的各方面活動都可能觸發(fā)CAPA程序�����。沒有CAPA��,質(zhì)量體系就無法正常、高效地運行��,藥企實施CAPA的目的在于對質(zhì)量體系不斷地完善和改進(jìn)����,從而提高企業(yè)質(zhì)量管理水平�����,是企業(yè)長期發(fā)展的必然要求���。
一��、CAPA概念與法規(guī)
根據(jù)FDA的描述�,CAPA的目的是收集信息��、分析信息��、識別和調(diào)查產(chǎn)品和質(zhì)量問題�����,并采取適當(dāng)和有效的糾正和/或預(yù)防措施以防止其再次發(fā)生�。驗證CAPA,與負(fù)責(zé)人溝通CAPA活動�����、為管理評審提供相關(guān)信息���,以及記錄這些活動�,對于有效處理產(chǎn)品和質(zhì)量問題、防止其再次發(fā)生以及預(yù)防或最大限度減少各類故障至關(guān)重要�����。
CAPA通常分為三種類型����,分別是糾正、糾正措施����、預(yù)防措施,定義分別如下(參考ISO 9000:2005(E)):
●糾正(Correction):“action to eliminate a detected nonconformity”.(為消除已發(fā)現(xiàn)的不符合項所采取的措施)��;
●糾正措施(Corrective action):“action to eliminate the cause of a detected nonconformity or other undesirable situation.”(為消除已發(fā)現(xiàn)的不合格或其他不期望情況的原因所采取的措施)��;
●預(yù)防措施(preventive action):“action to eliminate the cause of a potential nonconformity or other undesirable situation.”(為消除潛在不合格或其他潛在不期望情況的原因所采取的措施)��。
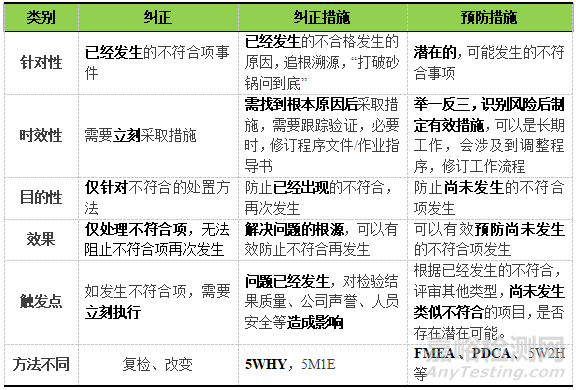
在實際管理過程中需要厘清概念的差異并嚴(yán)格區(qū)分���,針對上述三個概念,可從時效性��、目的��、效果�����、觸發(fā)點等方面加以對比區(qū)分�����,見表1���。
▲表1-CAPA三種類型的對比
1.2 CAPA相關(guān)法規(guī)
國內(nèi)CAPA沒有專門的法規(guī)和指南��,但在與制藥相關(guān)的眾多與質(zhì)量相關(guān)的法規(guī)指南中��,或多或少均涉及CAPA體系的相關(guān)內(nèi)容�����。以下是歸納了部分涉及與CAPA相關(guān)的法規(guī)���、指南或標(biāo)準(zhǔn)�����。
ISO 9001:2015質(zhì)量管理體系標(biāo)準(zhǔn):這是一個國際標(biāo)準(zhǔn),規(guī)定了組織應(yīng)建立和維護(hù)的質(zhì)量管理體系要求�。其中包括了CAPA的要求,包括問題識別���、根本原因分析��、糾正措施和預(yù)防措施的實施���、監(jiān)督和驗證等���。
FDA 21 CFR Part 820 – 質(zhì)量管理體系法規(guī)QMSR:這個法規(guī)適用于美國制造和分發(fā)醫(yī)療器械的企業(yè),要求建立和維護(hù)適當(dāng)?shù)馁|(zhì)量體系��,包括CAPA流程�����。
FDA 21 CFR Part 211 – 制劑藥品的cGMP:這個法規(guī)是美國版的GMP,適用于美國藥品制造業(yè)����,規(guī)定了質(zhì)量管理體系的要求��,包括CAPA的實施要求。
ICH Q10 制藥質(zhì)量體系:第3節(jié) 工藝性能與持續(xù)改進(jìn)(3.2 制藥質(zhì)量體系要素�����;3.2.2 糾正措施與預(yù)防措施體系)中描述“對于由調(diào)查研究投訴����,產(chǎn)品否決��,不合格�����,召回,偏差�,審計,官方檢查和發(fā)現(xiàn)��,及工藝性能趨勢和產(chǎn)品質(zhì)量監(jiān)控等而產(chǎn)生的糾正措施和預(yù)防措施�,制藥企業(yè)應(yīng)有體系來執(zhí)行這些措施�����。”并進(jìn)一步提出調(diào)查問題的要求和CAPA實施目標(biāo)����。
我國《藥品生產(chǎn)質(zhì)量管理規(guī)范》(2011版):第十章 質(zhì)量控制與質(zhì)量保證(第六節(jié) 糾正措施和預(yù)防措施���;第二百五十二條至第五十三條)�����,分別敘述了中國藥監(jiān)對制藥企業(yè)建立CAPA系統(tǒng)的總體要求和實施內(nèi)容��。
二��、CAPA來源��、管理范圍及其應(yīng)用
CAPA通過改進(jìn)和優(yōu)化質(zhì)量管理體系,采取風(fēng)險防控措施來防范潛在的安全風(fēng)險�。通過CAPA的全面應(yīng)用�,藥品制造企業(yè)可以保持質(zhì)量和安全的持續(xù)改進(jìn),更好地滿足監(jiān)管要求���,并為患者提供安全有效的藥品����。
2.1 CAPA來源
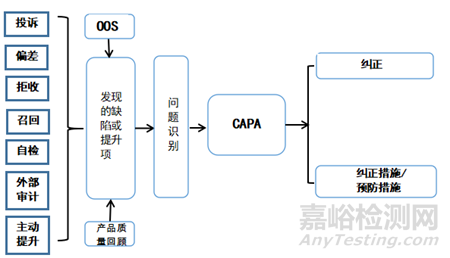
引發(fā)CAPA的問題可能源自質(zhì)量管理體系內(nèi)的各個方面。包括供應(yīng)鏈管理��、制造過程���、設(shè)備維護(hù)、人力資源和培訓(xùn)等���,羅列制藥企業(yè)CAPA的通常來源,見圖1.
▲圖1-制藥企業(yè)CAPA通常來源
無論出于何種原因或在何處啟動CAPA���,都應(yīng)始終從確定問題的那一刻開始立即采取糾正行動��,以穩(wěn)定局勢并防止其進(jìn)一步影響生產(chǎn)和產(chǎn)品質(zhì)量。
2.2 CAPA管理范圍及應(yīng)用
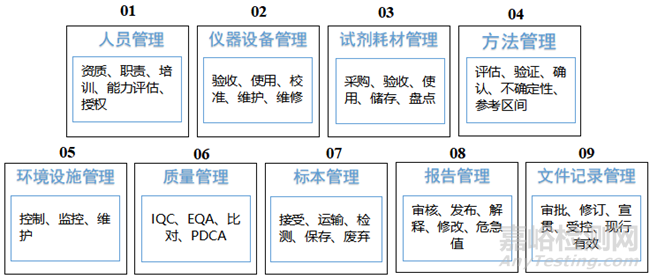
CAPA程序用于解決已經(jīng)發(fā)生的偏差或OOS��,并采取措施避免將來出現(xiàn)同樣的問題����。CAPA的管理范圍覆蓋了GMP的各個環(huán)節(jié)��,包括人員培訓(xùn)�、儀器設(shè)備管理����、耗材試劑管理�����、方法管理等�,詳見圖2。
▲圖2-CAPA管理范圍
ICH Q10描述藥品生命周期包括四個階段:藥品開發(fā)�����、技術(shù)轉(zhuǎn)移����、商業(yè)化生產(chǎn)���、產(chǎn)品終止,CAPA在藥品全生命周期管理中扮演著關(guān)鍵的角色���。通過糾正和預(yù)防措施來管理風(fēng)險�����、處理非合規(guī)事件、持續(xù)改進(jìn)質(zhì)量�����,并確保符合法規(guī)要求����,從而確保藥品的安全性����、有效性和合規(guī)性���。ICH Q10描述中進(jìn)一步歸納了CAPA在藥品生命周期中的應(yīng)用�����,見表2�����。
▲表2-CAPA系統(tǒng)在整個產(chǎn)品生命周期內(nèi)的應(yīng)用
三�、CAPA常規(guī)流程和實施
CAPA是制藥企業(yè)質(zhì)量管理中常用的工具��,能夠很好地解決問題并預(yù)防再次發(fā)生���。在實施CAPA時���,要確保流程規(guī)范化、員工參與和培訓(xùn)���、數(shù)據(jù)收集和分析的有效性����,并持續(xù)監(jiān)控和改進(jìn)�����。
3.1 CAPA常規(guī)流程
我國《藥品生產(chǎn)質(zhì)量管理規(guī)范》(2011版)第六節(jié):糾正措施和預(yù)防措施���,第二百五十三條企業(yè)應(yīng)建立實施糾正和預(yù)防措施的操作規(guī)程����,內(nèi)容包括:
1)對投訴�、召回�����、偏差���、自檢或外部檢查結(jié)果工藝性能和質(zhì)量監(jiān)測趨勢以及其它來源的質(zhì)量數(shù)據(jù)進(jìn)行分析�,確定已有和潛在的質(zhì)量問題���。必要時����,應(yīng)采用適當(dāng)?shù)慕y(tǒng)計學(xué)方法;
2)調(diào)查與產(chǎn)品��、工藝和質(zhì)量保證系統(tǒng)有關(guān)的原因�����;
3)確定所需采取的糾正和預(yù)防措施���,防止問題的再次發(fā)生��;
4)評估糾正和預(yù)防措施的合理性�、有效性和充分;
5)對實施糾正和預(yù)防措施過程中所有發(fā)生的變更應(yīng)予以記錄��;
6)確保相關(guān)信息已傳遞到質(zhì)量受權(quán)人和預(yù)防問題再次發(fā)生的直接負(fù)責(zé)人�;
7)確保相關(guān)信息及其糾正和預(yù)防措施已通過高層管理人員的評審。
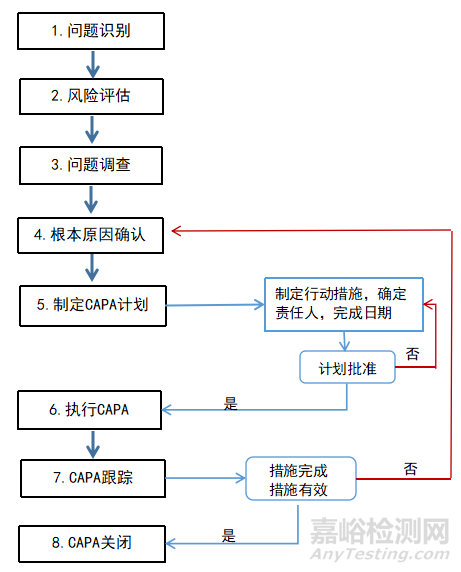
從上述文字可以看出我國GMP對藥企CAPA的執(zhí)行要求和內(nèi)容做出了框架式的總體規(guī)定���,執(zhí)行層面需要企業(yè)在遵守法規(guī)指南的基礎(chǔ)上�����,根據(jù)實際情況具體實施����。參考ISO 9001���、FDA 21 CFR Part 820等相關(guān)標(biāo)準(zhǔn)和法規(guī)����,結(jié)合個人的經(jīng)驗和理解��,繪制藥企CAPA系統(tǒng)常規(guī)流程���,見圖3。
▲圖3-CAPA常規(guī)實施流程
由上圖可看出����,制藥企業(yè)在實施CAPA時��,首先�����,要識別和評估問題����;其次�����,要通過問題調(diào)查��,確定其根本原因���;再次��,制定糾正措施來解決問題���,并實施預(yù)防措施以防止問題再次發(fā)生��。在實施CAPA過程中�����,還需要監(jiān)督和驗證措施的執(zhí)行���,并記錄所有的活動和結(jié)果,跟蹤并評價實施效果���,措施完成并且有效����,則CAPA關(guān)閉�;否則,返回流程繼續(xù)查找根本原因�,依次執(zhí)行后續(xù)流程。
3.2 CAPA實施
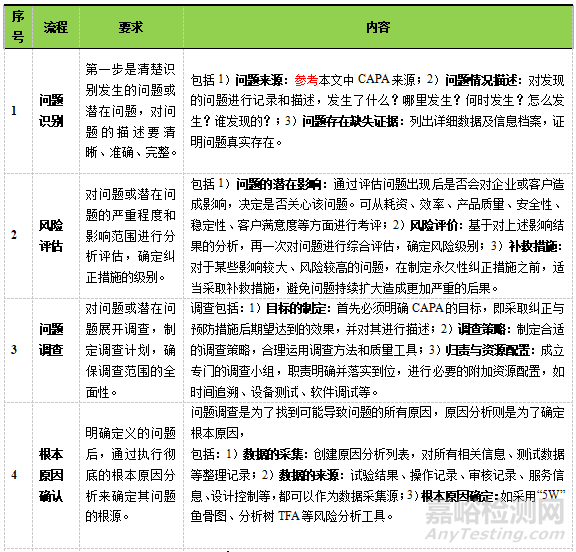
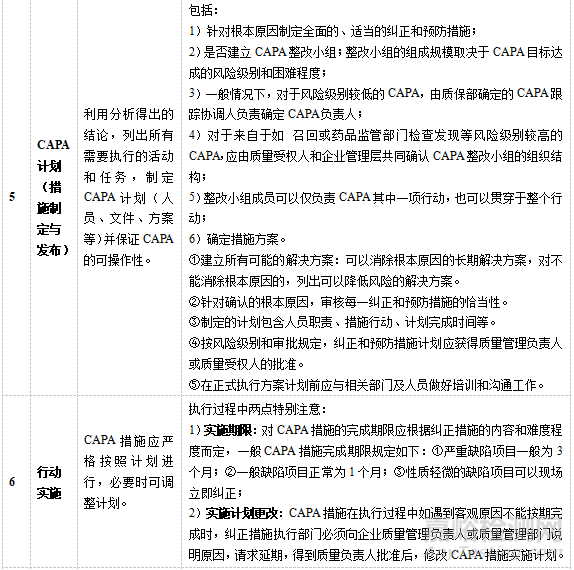
CAPA是質(zhì)量管理體系的重要組成部分��,無論從政府監(jiān)管的需要還是企業(yè)自身產(chǎn)品質(zhì)量控制以及客戶滿意度等方面來說���,CAPA的有效貫徹實施都是制藥企業(yè)質(zhì)量管理體系中不容忽視的內(nèi)容���。結(jié)合CAPA常規(guī)流程,進(jìn)一步分析和闡述流程具體實施的要求和內(nèi)容�����,見表3��。
▲表3-CAPA實施要求與內(nèi)容
四�����、總結(jié)
在GMP體系下�,CAPA實施流程和策略對于確保藥品的質(zhì)量和合規(guī)性至關(guān)重要。CAPA流程包括問題識別��、問題調(diào)查、糾正措施的實施���、預(yù)防措施的制定和驗證等步驟�����。為了有效實施CAPA�,必須制定一系列策略���,例如明確定義責(zé)任和角色����、建立合適的糾正和預(yù)防方法、建立持續(xù)改進(jìn)和監(jiān)督機制等��。此外�,合適的培訓(xùn)和溝通也是成功實施CAPA的關(guān)鍵因素。最終目標(biāo)是持續(xù)改進(jìn)和提高質(zhì)量�,確保藥品的安全性和有效性。通過嚴(yán)格遵循CAPA實施流程和策略�����,制藥企業(yè)能夠識別和解決問題,防止其再次發(fā)生�,并符合相關(guān)法規(guī)和標(biāo)準(zhǔn)的要求。只有致力于不斷改進(jìn)CAPA流程和策略�����,并將其納入企業(yè)的質(zhì)量體系中�,才能實現(xiàn)持續(xù)質(zhì)量提升的目標(biāo)���。
參考文獻(xiàn)
[1]ICH Q10制藥質(zhì)量體系(2008).
[2]《藥品生產(chǎn)質(zhì)量管理規(guī)范》(2011版).
[3]ISO 9001:2015質(zhì)量管理體系標(biāo)準(zhǔn).
[4]FDA 21 CFR Part 211 –制劑藥品的cGMP(2023).
[5]FDA 21 CFR Part 820 – 質(zhì)量管理體系法規(guī)QMSR(2023).
[6]丁曉玥,梁毅.制藥企業(yè)質(zhì)量管理體系中糾正與預(yù)防措施(CAPA)的實施[J].機電信息����,2011(5):5.