預(yù)測(cè)性穩(wěn)定性研究允許從短期穩(wěn)定性研究的結(jié)果外推�,對(duì)原料藥或藥品的長(zhǎng)期穩(wěn)定性特性進(jìn)行表征。這些研究通常持續(xù)一個(gè)月�。最常用的預(yù)測(cè)穩(wěn)定性研究類型是加速穩(wěn)定性評(píng)估程序(ASAP)研究���,該研究側(cè)重于通過降解產(chǎn)物的形成或藥物物質(zhì)的損失來(lái)監(jiān)測(cè)化學(xué)降解����。ASAP包括設(shè)計(jì)實(shí)驗(yàn)、確定研究����、存儲(chǔ)和分析樣品�,然后進(jìn)行數(shù)據(jù)審核和建模,最后進(jìn)行穩(wěn)定性預(yù)測(cè)�。本文將在這幾個(gè)方面向大家介紹�。
一���、ASAP簡(jiǎn)介
1.1 加速穩(wěn)定性研究的必要性
在藥品的開發(fā)和商業(yè)階段對(duì)藥品進(jìn)行穩(wěn)定性測(cè)試對(duì)整個(gè)行業(yè)而言�,無(wú)論是在成本、資源還是時(shí)間上都會(huì)造成重大負(fù)擔(dān)。預(yù)測(cè)性穩(wěn)定性方法利用加速或壓力條件下進(jìn)行較短期的穩(wěn)定性研究,并設(shè)計(jì)成可以將降解動(dòng)力學(xué)外推回環(huán)境存儲(chǔ)條件[1-5]。以這種方式,可以在通常持續(xù)一個(gè)月的短期研究中研究藥品物質(zhì)或藥品的穩(wěn)定性特性。通過預(yù)測(cè)性穩(wěn)定性研究���,不僅可以確定適宜的長(zhǎng)期存儲(chǔ)條件����,還可以選擇適當(dāng)?shù)陌b���,并預(yù)測(cè)復(fù)驗(yàn)期或貨架期。
1.2 實(shí)驗(yàn)原理
ASAP基于標(biāo)準(zhǔn)的阿倫尼烏斯動(dòng)力學(xué)方程(適用于溶液或液體),以及對(duì)固體的改進(jìn)的阿倫尼烏斯方程,還考慮了濕度對(duì)反應(yīng)速率的影響�,如下所示���。
其中:
k為反應(yīng)速率
ln(A)為碰撞頻率
Ea為活化能(kcal/mol)
R為氣體常數(shù)(kcal/(K·mol)
T為溫度(K)
B為濕度因子
RH為相對(duì)濕度(%)
ASAP研究的目的是在一系列溫度濕度條件下�,獨(dú)立地變化溫度和濕度����,將樣品降解至限度水平�。這樣可以確定在每個(gè)測(cè)試條件下達(dá)到規(guī)定限度所需的時(shí)間(或達(dá)到規(guī)定限度的反應(yīng)速率)�。為了求解相關(guān)的阿倫尼烏斯方程����,需要確定特定反應(yīng)的碰撞頻率(ln(A))���、活化能(Ea���,以kcal/mol表示)和濕度因子(B)(如果相關(guān)的話)。然后可以利用這些值預(yù)測(cè)在任何給定條件下達(dá)到限度的反應(yīng)速率����,從而確定樣品的存儲(chǔ)條件和復(fù)驗(yàn)期/貨架期�。重要的是�,樣品在每個(gè)存儲(chǔ)條件下都要被降解到相同程度(通常是標(biāo)準(zhǔn)中的限度),從而確保在整個(gè)研究中降解動(dòng)力學(xué)保持類似����,這個(gè)概念被稱為等轉(zhuǎn)化。這旨在克服非均質(zhì)固體動(dòng)力學(xué)的復(fù)雜性。
二�、ASAP預(yù)測(cè)方向
2.1化學(xué)穩(wěn)定性
ASAP研究可用于調(diào)查一系列藥品材料的化學(xué)穩(wěn)定性���,包括原料藥���、起始物料���、中間體、制劑(片劑、膠囊、顆粒、溶液�、凍干物等)�。迄今為止���,制藥行業(yè)進(jìn)行的ASAP研究通常應(yīng)用于小分子����,但也可以應(yīng)用于生物大分子,特別是在化學(xué)降解可能是貨架期限制屬性的情況下。
從ASAP研究中產(chǎn)生的數(shù)據(jù)反映了所用分析方法的質(zhì)量。這些方法應(yīng)具有穩(wěn)定性指示能力。特別是對(duì)于由液相色譜法(LC)進(jìn)行的有關(guān)物質(zhì)方法����,降解產(chǎn)物應(yīng)與主成分適當(dāng)分離�。因此�,建議進(jìn)行一些強(qiáng)制降解研究,并使用降解樣品來(lái)輔助方法開發(fā)�。對(duì)于含手性中心的藥品,還應(yīng)在ASAP實(shí)驗(yàn)中囊括異構(gòu)體雜質(zhì)的監(jiān)測(cè)�。
ASAP研究的一個(gè)局限性是它們往往專注于化學(xué)降解���,而這可能不是限制貨架壽命的關(guān)鍵屬性�。在預(yù)測(cè)貨架壽命時(shí)���,還應(yīng)考慮和調(diào)查其他穩(wěn)定性指示屬性,例如物理形態(tài)穩(wěn)定性����,口服固體劑型的溶解度或溶液制劑的沉淀、pH變化或微生物生長(zhǎng)����。
ASAP研究的一個(gè)重要前提是在研究過程中����,被研究物質(zhì)的實(shí)體不會(huì)改變物理形態(tài)���。需要考慮的物理變化,包括晶態(tài)轉(zhuǎn)變�、水合或脫水�、熔化、吸濕甚至升華等����。建議在最后一個(gè)時(shí)間點(diǎn)檢查存儲(chǔ)在最嚴(yán)苛條件下的ASAP樣品的物理形態(tài)����,并與初始樣品進(jìn)行比較,以確保沒有發(fā)生變化�。通常,分析來(lái)自最高溫度和濕度條件的樣品����,但還應(yīng)考慮高溫下的最低濕度���,因?yàn)檫@種條件可能引發(fā)水合物的脫水�。
任何形態(tài)變化都可能導(dǎo)致降解動(dòng)力學(xué)的變化���,使得對(duì)長(zhǎng)期存儲(chǔ)條件的預(yù)測(cè)失敗�。因此����,在設(shè)計(jì)ASAP研究方案時(shí)����,評(píng)估樣品或樣品組分在超過臨界溫度或濕度時(shí)可能改變形態(tài),并相應(yīng)地調(diào)整研究方案是很重要的���。
2.2 包裝系統(tǒng)預(yù)測(cè)
預(yù)測(cè)產(chǎn)品在貨架期的包裝內(nèi)相對(duì)濕度和不同包裝下降解程度�。還可以預(yù)測(cè)患者使用情境下的包裝濕度�,這些預(yù)測(cè)考慮了瓶子的開啟和關(guān)閉���,例如每次取出一定數(shù)量的藥片���。通過這些預(yù)測(cè)���,可以選擇合適的包裝形式和配置�。例如���,可以確定改變瓶中藥片數(shù)量的影響,以及增加干燥劑對(duì)樣品降解的影響����。
三�、材料
3.1 鹽溶液
飽和鹽溶液可以用于在不同溫度下維持特定的濕度水平���。當(dāng)自制濕度鹽溶液時(shí)需要注意至少提前24小時(shí)準(zhǔn)備并確保溶液始終處于飽和狀態(tài)。也可以購(gòu)買商業(yè)化的濕度膠囊�。
四、實(shí)驗(yàn)
4.1 ASAP方案設(shè)計(jì)
1. 在設(shè)計(jì)ASAP方案時(shí)���,現(xiàn)有樣品穩(wěn)定性的知識(shí)可以應(yīng)用到方案設(shè)計(jì)中。應(yīng)該設(shè)計(jì)特定條件和時(shí)間點(diǎn)以使樣品降解到規(guī)定的限度���。最理想的時(shí)間點(diǎn)是在規(guī)定時(shí)間的一半以上和不超過規(guī)定時(shí)間的150%之間。
2. 在ASAP研究中至少需要四個(gè)條件����,但最好使用至少五個(gè)或六個(gè)條件���。
3. 為了確定準(zhǔn)確的初始時(shí)間點(diǎn)的測(cè)量結(jié)果,并減少誤差����。通常,大多數(shù)時(shí)間點(diǎn)只進(jìn)行一次分析,但在一個(gè)中間條件和時(shí)間點(diǎn)上�,需要進(jìn)行多次重復(fù)分析,以確定相對(duì)標(biāo)準(zhǔn)偏差(RSD)���。然后可以將該值應(yīng)用于整個(gè)研究的數(shù)據(jù),以減少測(cè)試樣本的數(shù)量�。
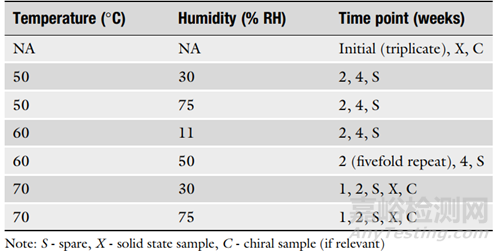
4. 在設(shè)計(jì)ASAP方案時(shí),考慮研究的目的也很重要���。表1是固體口服制劑的典型方案���,表2是貨架壽命研究的典型方案���。建議使用至少五個(gè)條件�,初始樣品至少進(jìn)行兩次分析����,中間條件和時(shí)間點(diǎn)進(jìn)行三次分析���。對(duì)于可能用于監(jiān)管申請(qǐng)的貨架壽命設(shè)置研究,建議使用至少六個(gè)條件�,初始樣品進(jìn)行三次分析���,并對(duì)中間樣品進(jìn)行五倍重復(fù)����。
▲表1-固體口服制劑的典型ASAP方案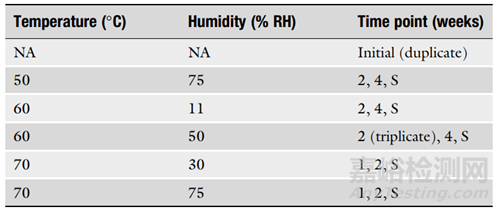
▲表2-貨架壽命研究的典型方案
5. 溫度和濕度在ASAP研究中應(yīng)該獨(dú)立變化�,如表1和表2中所示的方案所示���,否則無(wú)法確定每個(gè)變量的獨(dú)立效應(yīng)。
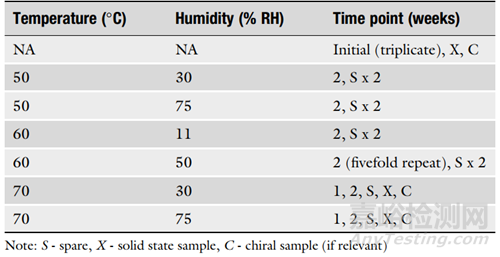
6. 如果對(duì)樣品的穩(wěn)定性的認(rèn)知有限���,可以在方案中設(shè)置多個(gè)備用樣品,如表3所示�。
▲表3-靈活可變的方案示例
7. ASAP研究的一個(gè)重要準(zhǔn)則是����,在研究過程中樣品的物理形式不發(fā)生變化。
對(duì)于制劑的ASAP研究�,這些界限適用于輔料和活性成分,因?yàn)檩o料形式的改變也可能改變活性成分降解的動(dòng)力學(xué)性質(zhì)���。
8. 與固體相比,對(duì)于溶液制劑���,ASAP方案通常要簡(jiǎn)單得多�,因?yàn)闈穸葘?duì)大多數(shù)溶液的降解沒有影響����,所以只需要變化溫度���。如表4所示,在這種情況下����,至少需要三個(gè)條件。
▲表4-液體制劑研究的典型ASAP方案
9. 對(duì)于所有的方案�,在每個(gè)條件下添加備用樣品是必要的�。如果在特定時(shí)間點(diǎn)對(duì)樣品的分析存在問題,并且需要進(jìn)行重復(fù)分析�,就可以采用備用樣品;或者延長(zhǎng)備用樣品的放置時(shí)間來(lái)使樣品進(jìn)一步降解以接近質(zhì)量標(biāo)準(zhǔn)極限�。
10. 在設(shè)計(jì)ASAP研究的方案時(shí),應(yīng)關(guān)注檢測(cè)項(xiàng)目、檢測(cè)方法以及時(shí)間點(diǎn)和條件����。對(duì)于典型的藥物物質(zhì)或固體口服制劑,使用具有穩(wěn)定性指示性HPLC進(jìn)行雜質(zhì)分析最常用�。
11. 在最后一個(gè)時(shí)間點(diǎn)的最嚴(yán)酷條件下�,應(yīng)考慮藥品的物理狀態(tài)(外觀)和手性雜質(zhì),以確認(rèn)在研究過程中未發(fā)生物理形態(tài)或手性的變化���。如果認(rèn)為轉(zhuǎn)化為對(duì)映異構(gòu)體是主要的降解機(jī)制,則應(yīng)在所有條件和時(shí)間點(diǎn)進(jìn)行手性分析�。
12. 當(dāng)研究可能用于支持監(jiān)管申請(qǐng)中的有效期聲明時(shí)���,也應(yīng)考慮詳細(xì)描述分析過程���。對(duì)于不同的制劑類型���,其他分析方法可能更相關(guān)���;對(duì)于溶液制劑,顏色變化可以用來(lái)監(jiān)測(cè)降解�。此外,可能需要確認(rèn)在研究過程中pH值未發(fā)生變化���,或者沒有發(fā)生沉淀。如果在ASAP條件下觀察到活性成分的沉淀����,則不應(yīng)使用該條件下的數(shù)據(jù)進(jìn)行ASAP模型分析,因?yàn)橐恍┗钚猿煞挚赡芤呀?jīng)發(fā)生了物態(tài)變化�,并且降解動(dòng)力學(xué)也可能受到影響����。
13. 在設(shè)計(jì)方案時(shí),應(yīng)根據(jù)每個(gè)分析所需的樣品量計(jì)算每個(gè)時(shí)間點(diǎn)的樣品量�。對(duì)于樣品量有限的制劑,可在每個(gè)時(shí)間點(diǎn)和條件下僅使用一個(gè)或兩個(gè)制劑����。
4.2 實(shí)施ASAP研究
1. 選擇有代表性的批次進(jìn)行ASAP研究。
2. ASAP樣品可以使用飽和鹽溶液控制濕度的烘箱存儲(chǔ)����,使用同時(shí)控制溫度和濕度的穩(wěn)定性室存儲(chǔ),或使用自動(dòng)化機(jī)器人存儲(chǔ)系統(tǒng)存儲(chǔ)�。
3. 測(cè)量樣品所暴露的準(zhǔn)確溫度和濕度數(shù)據(jù)非常重要,特別是用于支持貨架期申請(qǐng)的預(yù)測(cè)研究����??梢允褂脺貪穸葌鞲衅鱽?lái)檢測(cè),還可以使用同時(shí)測(cè)量溫度和濕度的探頭���,并將其與樣品和鹽溶液一起放置在密封罐或干燥器中���。
4. 在ASAP研究過程中發(fā)生的所有降解都是由溫度或濕度的影響引起的。如果樣品對(duì)光敏感���,需要在ASAP條件下做避光保護(hù)����。
5. 盡可能減小ASAP研究樣品分析的誤差����,從而減小預(yù)測(cè)結(jié)果的誤差���。因此,理想的做法是減少檢測(cè)���?��?梢酝ㄟ^錯(cuò)開起始點(diǎn)使實(shí)驗(yàn)重點(diǎn)在同一天,這樣可以在一個(gè)序列中分析所有樣品���。初始樣品和檢測(cè)時(shí)間點(diǎn)之前的樣品可以根據(jù)需要存放在冰箱中����。
4.3 收集數(shù)據(jù)
1. 對(duì)于ASAP研究�,通常對(duì)雜質(zhì)用面積歸一化法計(jì)算是足夠的����。對(duì)于可能用于監(jiān)管申請(qǐng)的有效期確定研究����,需要使用外標(biāo)法法計(jì)算�。
2. 對(duì)樣品在整個(gè)HPLC運(yùn)行過程中進(jìn)行隨機(jī)排序���,包括重復(fù)的初始樣品和中間樣品,以避免系統(tǒng)誤差影響后續(xù)的預(yù)測(cè)���。
4.4 審核數(shù)據(jù)
1. 在開始任何建模之前,完成分析后應(yīng)先審核數(shù)據(jù)�。
2. 對(duì)于雜質(zhì)分析�,需要從數(shù)據(jù)中確定可能限制有效期的降解產(chǎn)物���。
3. 如果形成多個(gè)降解產(chǎn)物,需要單獨(dú)對(duì)它們進(jìn)行建模����,以確定是限制有效期的關(guān)鍵雜質(zhì)����。
4. 降解產(chǎn)物的總水平也應(yīng)考慮,在多個(gè)降解產(chǎn)物在低水平時(shí),總雜已經(jīng)到限度水平���。
5. 確定主要降解產(chǎn)物后,應(yīng)審核數(shù)據(jù)以確認(rèn)在每個(gè)條件下樣品是否至少降解到限度要求的一半����,并且沒有過度超過限度要求(限度的150%)�。如果ASAP研究中的降解水平超過了限度,降解的動(dòng)力學(xué)可能會(huì)發(fā)生變化���。因此�,重要的是保持在限度的大約150%以下����。這樣做可以最大程度地減小在生成ASAP模型的誤差����。
6. 可能需要從模型中排除沒有發(fā)生降解的條件和降解超過150%限度的時(shí)間點(diǎn)���,因?yàn)榻到獾膭?dòng)力學(xué)可能會(huì)發(fā)生變化���。
7. 確定要在ASAP模型中使用的條件和時(shí)間點(diǎn)后,應(yīng)多次重復(fù)計(jì)算初始樣品的平均值���,并計(jì)算初始和中間條件/時(shí)間點(diǎn)的重復(fù)的相對(duì)標(biāo)準(zhǔn)偏差(RSD)。然后�,將RSD值中較高的值應(yīng)用于整個(gè)研究的數(shù)據(jù)。
8. 確定用于擬合數(shù)據(jù)的降解動(dòng)力學(xué)���。在大多數(shù)情況下,線性擬合就足夠了���。
4.5 建模ASAP數(shù)據(jù)
1. 有商業(yè)化的軟件可用于建模����,如ASAP(Accelerated Stability Assessment Program)。
2. 使用在每個(gè)條件下得到的降解速率來(lái)帶入阿倫尼烏斯方程�,并確定阿倫尼烏斯參數(shù)。
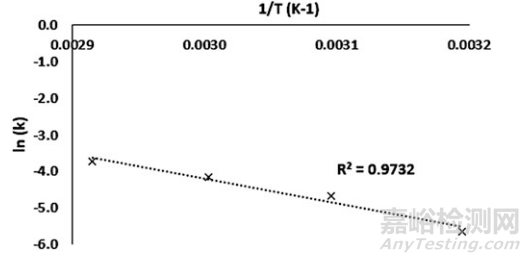
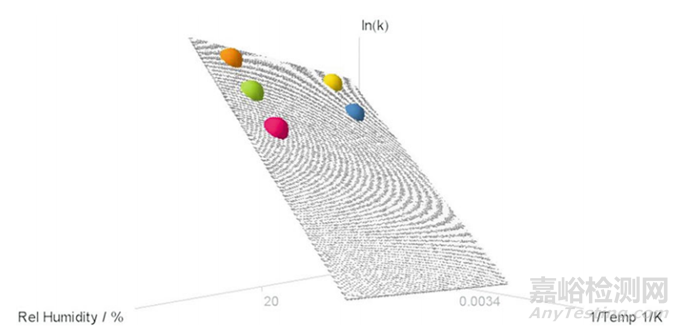
3. 可以通過2D或3D可視化來(lái)展示模型���,具體取決于樣品類型(圖1和圖2)。
▲圖1-典型液體樣品ASAP模型
▲圖2-典型固體樣品ASAP模型
4. ASAP軟件通常利用對(duì)重復(fù)樣品的存儲(chǔ)和分析計(jì)算出的誤差來(lái)確定在每個(gè)條件下達(dá)到限度所需的時(shí)間誤差���。此誤差隨后傳遞到最終的阿倫尼烏斯參數(shù),從而為預(yù)測(cè)長(zhǎng)期條件下的降解提供置信限���。
5. 評(píng)估模型����。阿倫尼烏斯常數(shù)應(yīng)在預(yù)期范圍內(nèi)����,活化能通常應(yīng)在15-40 kcal/mol的范圍����,B在0到0.1之間[4]���。每個(gè)條件應(yīng)在確定的誤差范圍內(nèi)與模型擬合����。這可以通過R平方項(xiàng)(理想情況下應(yīng)大于0.9)和殘差來(lái)確定���。
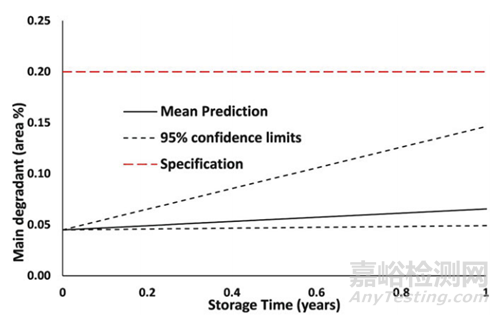
6. 生成可靠的模型后����,可以對(duì)不同儲(chǔ)存條件進(jìn)行預(yù)測(cè)���。這些預(yù)測(cè)可以用于處方篩選、預(yù)測(cè)復(fù)檢期或貨架壽命�。圖3顯示了一個(gè)典型的ASAP預(yù)測(cè)與主要降解產(chǎn)物0.2%限度的關(guān)系?���?梢钥闯?,這個(gè)例子的預(yù)測(cè)支持在上限95%置信限內(nèi)的12個(gè)月貨架壽命。
▲圖3- ASAP預(yù)測(cè)貨架期
五�、包裝預(yù)測(cè)
1. 要預(yù)測(cè)包裝產(chǎn)品的貨架壽命,首先需要通過實(shí)驗(yàn)或計(jì)算確定包裝的濕氣透過率(MVTR)���。聚合物片材或薄膜有標(biāo)準(zhǔn)的測(cè)試方法可用(ASTM E96)���,藥品瓶和泡罩有標(biāo)準(zhǔn)的測(cè)試方法可用(ASTM D7709)���。
2. 利用動(dòng)態(tài)蒸汽吸附曲線(DVS)確定產(chǎn)品在不同濕度下吸濕的能力。
3. 使用市售的現(xiàn)成軟件或制藥公司定制的軟件預(yù)測(cè)包裝內(nèi)的濕度隨時(shí)間的變化���。這些變量包括片劑數(shù)量���、大小以及瓶型包裝中的干燥劑用量。
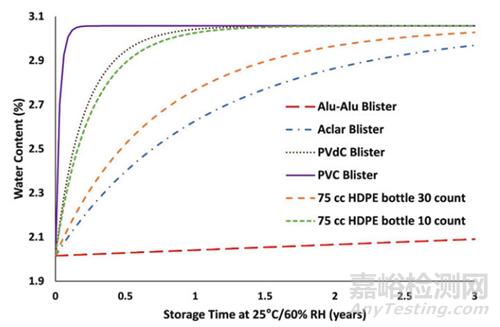
4. 利用ASAP研究中的阿倫尼烏斯參數(shù)�,可以將包裝內(nèi)的濕度轉(zhuǎn)換為存儲(chǔ)時(shí)間內(nèi)包裝內(nèi)的降解水平�。通過這種方法,可以比較不同的包裝類型和配置�,如圖4所示���,甚至無(wú)需進(jìn)行任何包裝產(chǎn)品的穩(wěn)定性測(cè)試����。
▲圖4- 典型包裝預(yù)測(cè)結(jié)果圖
六���、總結(jié)
預(yù)測(cè)穩(wěn)定性和ASAP研究在藥品研發(fā)和商業(yè)化周期中具有廣泛的應(yīng)用�。這些應(yīng)用包括配方篩選����、在開發(fā)早期設(shè)置初始復(fù)驗(yàn)期和貨架期����、控制策略支持����、質(zhì)量標(biāo)準(zhǔn)的制定和制定依據(jù)、研究批次間變異性[8]���、研究藥物物質(zhì)粒子工程對(duì)藥品穩(wěn)定性的影響,以及支持包裝變更�。
ASAP還可以評(píng)估在藥物物質(zhì)或藥品開發(fā)過程中的任何變化對(duì)化學(xué)穩(wěn)定性特性的影響。如果ASAP研究證明與現(xiàn)有藥物物質(zhì)或藥品等效���,則在那時(shí)可能不需要對(duì)新的藥物物質(zhì)或藥品進(jìn)行進(jìn)一步的穩(wěn)定性測(cè)試。ASAP研究還可用于處理開發(fā)過程中的偏差���,根據(jù)ASAP研究數(shù)據(jù)進(jìn)行預(yù)測(cè)�,以幫助定義藥品的合適偏差聲明�。同樣,如果發(fā)生了偏差���,則可以使用ASAP數(shù)據(jù)和預(yù)測(cè)來(lái)證明批次的適用性。
參考文獻(xiàn)
1)Methods for Stability Testing of Pharmaceuticals
2)Waterman K, Adami R (2005) Accelerated aging: prediction of chemical stability of pharmaceuticals.
3)Waterman K, Carella A, Gumkowski M et al (2007) Improved protocol and data analysis for accelerated shelf-life estimation of solid dosage forms.
4)Waterman K, Colgan S (2008) A science-based approach to setting expiry dating for solid drug products.
5)Waterman K (2011) The application of Accelerated Stability Assessment Program (ASAP) to Quality by Design (QbD) for drug product stability.
6)Waterman K, Swanson J, Lippold B (2014) A scienti?c and statistical analysis of accelerated aging for pharmaceuticals.
7)Waterman K, Macdonald B (2010) Package selection for moisture protection for solid oral drug products.
8)Colgan S, Watson T, Whipple R et al (2012) The application of science- and risk-based concepts to drug substance stability strategies.