你是否在進行多肽或蛋白質(zhì)等兩性分析物的質(zhì)量研究時遇到這樣的情況����?某些雜質(zhì)與主峰或雜質(zhì)與雜質(zhì)之間結(jié)構(gòu)與極性極其相似��,僅所帶電荷有差異����,采用RP-HPLC法無論怎樣調(diào)整分離條件都無法分開這些雜質(zhì)�����。這時可以考慮離子交換色譜法��。
離子交換色譜的分離是基于離子型分析物與鍵合在固定相上的離子基的反離子的交換�����,依靠待分析組分表面電荷差異實現(xiàn)分離����。在多肽及蛋白質(zhì)的分子中普遍存在與主成分相關(guān)的電荷差異雜質(zhì),這些雜質(zhì)會影響效力��、PK����、生物利用度����、免疫原性和結(jié)構(gòu)穩(wěn)定性����,因此基于電荷的方法是多肽和蛋白質(zhì)表征研究及質(zhì)量控制策略的重要組成部分��。
離子交換分離原理
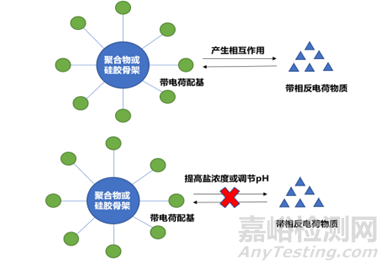
首先使待分析物和固定相帶有不同電荷��,產(chǎn)生相互作用�����,然后通過增加離子強度破壞兩者的相互作用(鹽濃度梯度)或者調(diào)節(jié)pH改變待分析組分表面電荷(pH梯度)來打破這種離子相互作用��,實現(xiàn)洗脫目的��,見圖1����。
圖1 離子交換色譜法原理
離子交換方法開發(fā)
雖然分離機理不同,但離子交換色譜仍屬于液相色譜范圍�����,其方法開發(fā)思路與普通RP-HPLC方法有許多相同之處,需要考慮的因素包括以下幾點:色譜柱類型����、鹽濃度、鹽種類����、流動相pH、梯度等�����。離子交換色譜法方法開發(fā)流程如下:
1 樣品相關(guān)信息收集
當(dāng)我們著手離子交換色譜法開發(fā)時��,最好先獲知待分析物PI值并考察待分析物在不同pH下的穩(wěn)定性如何�����。這些信息對色譜柱選擇和pH 的設(shè)定都具有很好的提示作用����。
2 色譜柱選擇
在離子交換色譜中色譜柱類型也代表分離模式,包括陽離子交換和陰離子交換兩種��。其中又可細(xì)分為強陽離子交換、弱陽離子交換����、強陰離子交換和弱陰離子交換。陽離子交換柱色譜柱填料本身帶負(fù)電荷��,陰離子交換柱填料本身帶正電荷�����。典型的固定相填料及適用pH范圍見表1�����。
表1 典型固定相填料分類及適用pH范圍
強離子交換柱可以在較寬pH范圍內(nèi)保持離子交換容量�����,弱離子交換柱則隨pH變化改變交換容量����。一般情況下首選強陽����、強陰離子交換柱,選擇性不好時考慮弱陽、弱陰離子交換柱����。
關(guān)于色譜柱選擇的一些經(jīng)驗見下表2。
表2 色譜柱選擇
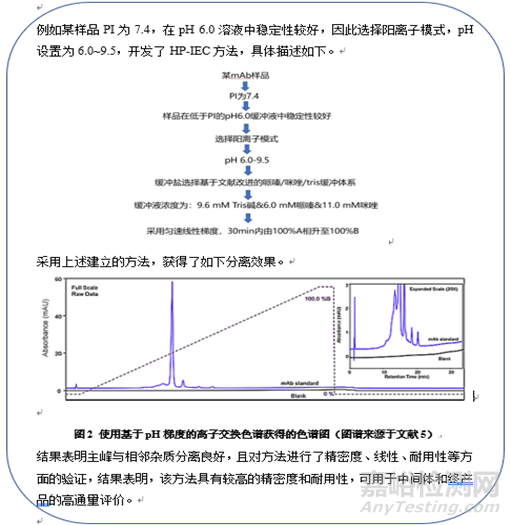
離子交換色譜法最初是應(yīng)用在生物樣品的純化試驗中�����,因為要確保待純化組分的活性��,盡量將pH設(shè)置在6-8之間��,因此通常情況下�����,對于低PI物質(zhì)��,首選陰離子交換�����,高PI物質(zhì)首選陽離子交換����。例如某樣品PI為5��,推薦陰離子交換模式�����,pH設(shè)置為6��;例如某樣品PI為8.5�����,那么推薦陽離子交換柱��,pH設(shè)置為7.5��。
與純化不同,在質(zhì)量控制的方法開發(fā)中�����,對于待分析組分是否保持活性并不十分關(guān)注�����,只要確保儀器�����、色譜柱能耐受,pH設(shè)置范圍可以更寬��,因此對于采用陰離子交換模式還是陽離子交換模式并沒有明顯的規(guī)律�����。例如某樣品PI為5����,可以選擇陰離子交換模式,pH設(shè)置為6進行鹽梯度洗脫或pH設(shè)置為7~3進行pH梯度洗脫��,也可以選擇陽離子交換模式�����,pH設(shè)置為4進行鹽梯度洗脫或pH設(shè)置為3~7進行pH梯度洗脫����。
3 pH
首先,pH設(shè)置與所選擇的色譜柱類型及待分析物的PI值息息相關(guān)����。
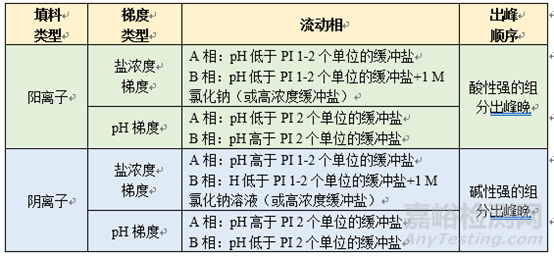
①在鹽濃度梯度條件下����,pH為單一值��,多為PI±1�����。陰離子模式下�����,pH為PI+1��,因為陰離子交換柱填料帶正電荷����,當(dāng)流動相pH高于PI時待分析物帶負(fù)電荷,可以與柱填料產(chǎn)生相互作用而被保留��,然后隨著鹽濃度增加逐漸解析下來�����;相反��,陽離子模式下�����,pH為PI-1��,因為陽離子交換柱填料帶負(fù)電荷����,當(dāng)流動相pH低于PI時待分析物帶正電荷,可以與柱填料產(chǎn)生相互作用而被保留����,然后隨著鹽濃度增加逐漸解析下來。
②在pH梯度條件下�����,pH范圍設(shè)置通常PI-2~PI+2����,可依據(jù)雜質(zhì)出峰時間和分離情況進一步優(yōu)化。陰離子模式下��,pH由高到低�����,因為陰離子交換柱填料帶正電荷,當(dāng)流動相pH高于PI時待分析物帶負(fù)電荷����,可以與柱填料產(chǎn)生相互作用而被保留,然后隨著pH逐漸降低��,帶分析物的負(fù)電荷逐漸被中和����,從而洗脫下來;陽離子模式下��,pH由低到高�����,因為陽離子交換柱填料帶負(fù)電荷��,當(dāng)流動相pH低于PI時待分析物帶正電荷��,可以與柱填料產(chǎn)生相互作用而被保留����,然后隨著pH逐漸降低,待分析物的正電荷逐漸被中和��,從而洗脫下來����。
其次,在pH選擇時也要充分考慮待分析物的穩(wěn)定性��,如果待分析物在低于其pI的pH下穩(wěn)定的��,則應(yīng)選擇陽離子交換��;如果待分析物在高于其pI的pH下穩(wěn)定��,則選擇陰離子交換劑�����。
4 鹽濃度
鹽濃度通常情況下為10-50 mM��,鹽濃度選擇與樣品凈電荷的多少有關(guān)��,如果樣品所帶電荷較多或樣品濃度較高����,可以適當(dāng)選擇稍高一點的鹽濃度��,如50 mM��,如果樣品本身所帶電荷較少或者樣品濃度較低��,可以選擇稍低的鹽濃度�����,如10 mM甚至是5 mM�����,但是要注意在低離子強度下��,化合物與固定相間的疏水作用增強�����,可能在一定程度上存在多模式分離�����,可能會出現(xiàn)與預(yù)期的分離效果不符的情況��,這種影響可能是正面的也可能是負(fù)面的����,結(jié)合實際情況考慮是否需要增強這種疏水作用力��。
5 鹽種類
緩沖鹽種類基本沒有限制����,只要在設(shè)定的pH范圍內(nèi)具有緩沖能力即可,磷酸鹽����、醋酸鹽、甲酸鹽��、檸檬酸鹽��、tris緩沖體系均可以嘗試�����。
6 梯度
1)梯度類型
有鹽濃度梯度和pH梯度����,在檢測效果不理想時也可以選擇鹽介導(dǎo)的pH梯度。
2)梯度變化速率
無論是鹽濃度梯度還是pH梯度都是依據(jù)雜質(zhì)的保留和分離情況來逐步調(diào)整的。這與RP-HPLC梯度思路調(diào)整相似��,在雜質(zhì)密集的部分可以適當(dāng)降低梯度變化速率����,在雜質(zhì)較少的部分可以適當(dāng)增快梯度變化速率。
小結(jié)
離子交換色譜法是檢測電荷變異雜質(zhì)的重要手段����,這種技術(shù)首先是在在兩性分析物(多肽、蛋白質(zhì)��、抗體等)的純化中得到應(yīng)用����,在有關(guān)物質(zhì)檢測中的應(yīng)用還相對較少,可查閱的文獻也不多��,相信隨著對生物藥物研究的深入����,對其質(zhì)量控制的要求會越來越高,離子交換色譜法的應(yīng)用會越來越普遍����。以上是我在實際工作中應(yīng)用離子交換色譜的一些心得��,希望能對正在或即將接觸離子交換色譜法的同仁起到一些指導(dǎo)作用�����,同時��,不夠科學(xué)和嚴(yán)謹(jǐn)之處,也敬請批評指正��。
參考文獻:
[1] Chris Selkirk,Methods in Molecular Biology, vol. 244: Protein Puri?cation Protocols: Second Edition,P124-131
[2] Michael W. Dong ,HPLC AND UHPLC FOR PRACTICING SCIENTISTS,P312-314
[3]Philip M. Cummins , Keith D. Rochfort, Ion-Exchange Chromatography: Basic Principles and Application,P209-221
[4] Szabolcs Fekete����,Ion-exchange chromatography for the characterization of Biopharmaceuticals,Journal of Pharmaceutical and Biomedical Analysis 113 (2015) 43–55
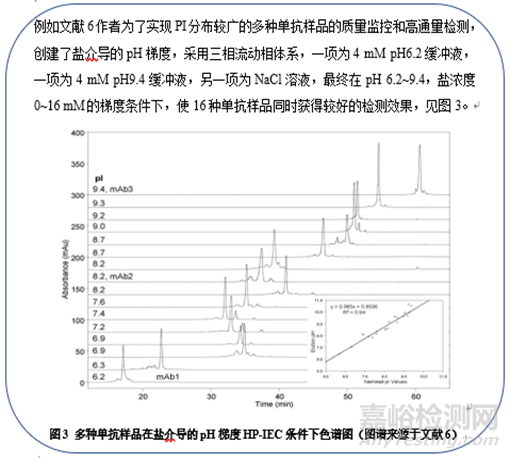
[5] Jennifer C. Rea, Validation of a pH gradient-based ion-exchange chromatography method for high-resolution monoclonal antibody charge variant separations, Journal of Pharmaceutical and Biomedical Analysis 54 (2011) 317–323.
[6] Liangyi Zhang, Improving pH gradient cation-exchange chromatography of monoclonal antibodies by controlling ionic strength, Journal of Chromatography A, 1272 (2013) 56–64