導(dǎo)語(yǔ)
抗體偶聯(lián)藥物(ADC)是一類新興的生物治療藥物���,由抗體���、連接子和小分子細(xì)胞毒素三部分組成。與傳統(tǒng)抗體藥物相比���,結(jié)構(gòu)會(huì)更加復(fù)雜���,其復(fù)雜程度受抗體種類���、偶聯(lián)方式���、連接子與毒素種類等多個(gè)因素影響。因此ADC分析方法的建立具有特殊性���,分析方法很難做到完全平臺(tái)化���,需要根據(jù)每類ADC的自身質(zhì)量屬性的特點(diǎn)進(jìn)行差異化開(kāi)發(fā)���。隨著越來(lái)越多復(fù)雜形式ADC分子的出現(xiàn)���,如何合理且準(zhǔn)確地看到ADC特有的各類質(zhì)量屬性將是未來(lái)的難點(diǎn)和挑戰(zhàn)。本文就ADC分析與表征的基礎(chǔ)技術(shù)做簡(jiǎn)要介紹探討���。
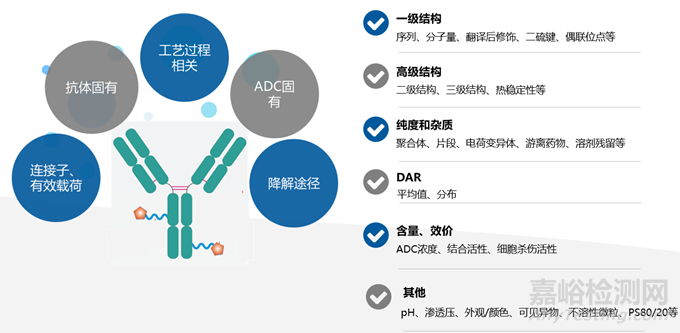
ADC產(chǎn)品關(guān)鍵質(zhì)量屬性(Critical Quality Attributes, CQA)舉例如下圖所示。根據(jù)先驗(yàn)知識(shí)和平臺(tái)經(jīng)驗(yàn)���,與分子安全性和有效性相關(guān)的物理���、化學(xué)���、生物或微生物性質(zhì)及特征���,均可納入關(guān)鍵質(zhì)量屬性���,且需隨產(chǎn)品開(kāi)發(fā)階段的進(jìn)步而不斷加深研究���。ADC主要的關(guān)鍵質(zhì)量屬性包括一級(jí)結(jié)構(gòu)���、高級(jí)結(jié)構(gòu)、純度與雜質(zhì)���、載藥量與藥物分布(Drug-to-Antibody Ratio, DAR)���、含量���、效價(jià)以及其他必須的生物制品質(zhì)量屬性。
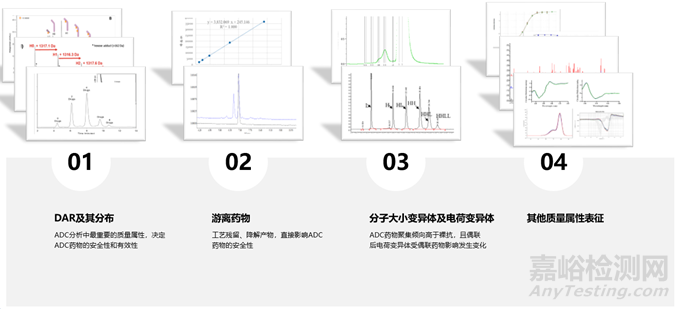
本文將從載藥量與藥物分布���、游離藥物���、分子大小變異體和電荷變異體四個(gè)方面進(jìn)行介紹���,討論各類分析技術(shù)是如何靈活配合用于表征分析ADC質(zhì)量屬性���。
DAR及其分布
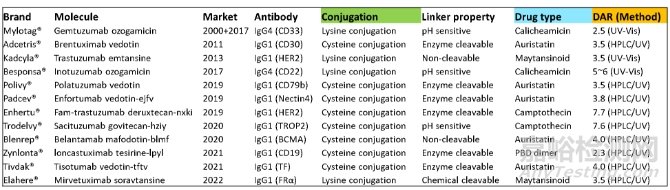
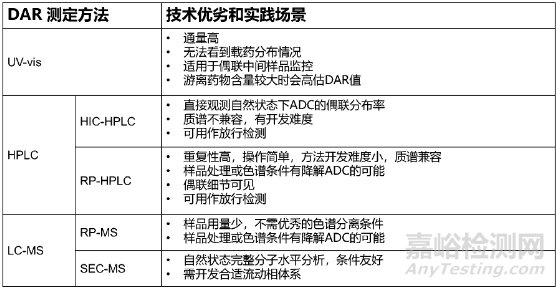
DAR(Drug-to-Antibody Ratio)���,即藥物小分子與抗體分子的數(shù)量比例���,可指示平均每個(gè)抗體上偶聯(lián)上的小分子藥物個(gè)數(shù)���。DAR與ADC的療效和安全性直接相關(guān)���,低載藥量(低DAR)會(huì)降低ADC的效力���,而高載藥量(高DAR)會(huì)改變ADC分子的藥代動(dòng)力學(xué)和毒性���。常規(guī)用于定量DAR的方法有光譜(UV-Vis)、色譜(HPLC)和質(zhì)譜(LCMS)等���。如下圖所示,已上市ADC產(chǎn)品在DAR分析質(zhì)控上主要是光譜和色譜這兩類技術(shù)���。
(1)光譜方法(UV-vis)
可實(shí)現(xiàn)DAR監(jiān)控需要有如下三個(gè)前提條件:
1)有效載荷應(yīng)含有紫外可見(jiàn)發(fā)色團(tuán)���;
2)有效載荷和抗體在其紫外可見(jiàn)光譜中應(yīng)顯示出不同的吸收峰屬性;
3)連接子-有效載荷的存在不影響ADC樣品中抗體部分的光吸收性質(zhì)���。
根據(jù)抗體部分和載荷部分的不同吸光度和消光系數(shù)���,依據(jù)Beer-Lambert原理計(jì)算出DAR值及ADC濃度���,典型圖譜及計(jì)算方式舉例如下
(2)色譜方法(HPLC)
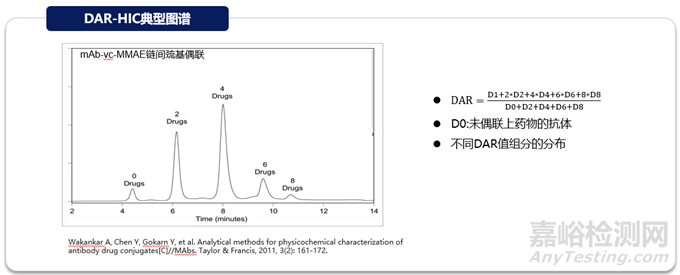
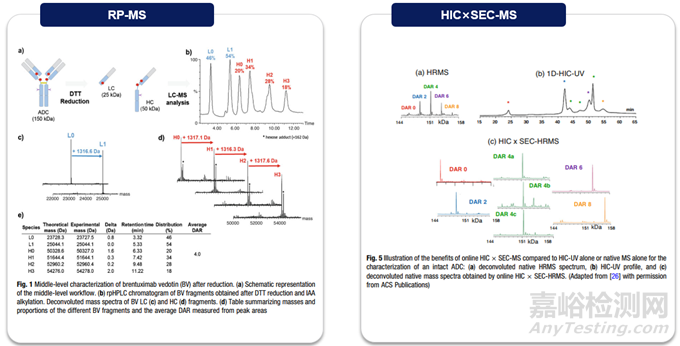
常見(jiàn)的可用于DAR分析的色譜方法有疏水色譜(HIC)和反相色譜(RP)。疏水色譜利用不同載藥組分的疏水性質(zhì)差異進(jìn)行分離���,不同的固定相(苯基���、丁基���、醚基等)具有不同的疏水性和選擇特性���,采用高鹽濃度流動(dòng)相使蛋白結(jié)合到固定相���,繼而降低鹽濃度進(jìn)行洗脫,這種溫和的結(jié)合與洗脫條件可以保持ADC藥物的天然構(gòu)象���。HIC是可在完整分子水平上監(jiān)控DAR的最佳方法���,可直接定量不載藥抗體(DAR0)組分���,一般認(rèn)為D0為非有效組分且會(huì)占據(jù)ADC結(jié)合位點(diǎn)影響ADC內(nèi)吞���。
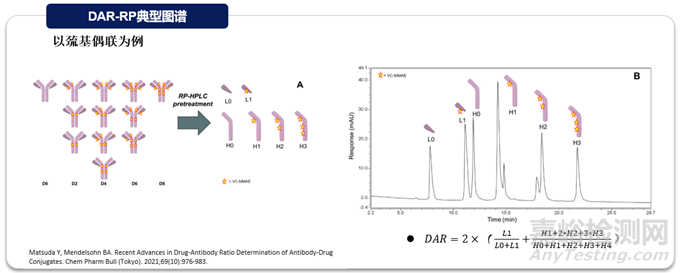
反相色譜(RP)利用目標(biāo)分子之間的極性差異進(jìn)行分離,分離度較好���,且方法本身質(zhì)譜兼容,可直接進(jìn)行不同載藥形式的分子量定性���。反相方法也可直觀看到小分子藥物在不同位點(diǎn)的分布情況���。如下圖所示���,對(duì)于常規(guī)鏈間二硫鍵巰基偶聯(lián)的ADC分子���,由于高載藥異質(zhì)性,需對(duì)樣品進(jìn)行還原后再進(jìn)行分析���,目標(biāo)物非完整狀態(tài),雖然可以監(jiān)控藥物在不同位點(diǎn)的分布���,但無(wú)法定量完整的不載藥抗體DAR0的比例���。
(3)質(zhì)譜方法(LC-MS)
質(zhì)譜方法是另一種常用的DAR分析技術(shù)。目前使用電噴霧電離(ESI)與飛行時(shí)間(TOF)或具有更大質(zhì)量范圍的Orbitrap可以以足夠的分辨率區(qū)分ADC的異質(zhì)分子物種���。例如���,在還原和非還原條件下,通過(guò)完整的質(zhì)量測(cè)量���,可以獲得ADC分子的完整質(zhì)量分布。
以上三種常規(guī)分析技術(shù)擁有各自的優(yōu)點(diǎn)和最佳應(yīng)用場(chǎng)景,可按照ADC分子特點(diǎn)和所處的開(kāi)發(fā)階段���,按需開(kāi)發(fā)或配置相應(yīng)的DAR定量方法���。
游離藥物
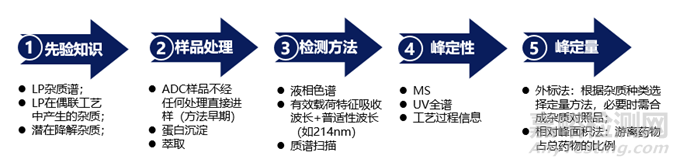
所有ADC共有的一個(gè)重要質(zhì)量屬性是游離(未結(jié)合)藥物的數(shù)量,這會(huì)引起對(duì)毒性和潛在安全問(wèn)題的關(guān)注���。未偶聯(lián)藥物或藥物相關(guān)雜質(zhì)的殘留量可能殘留在最終產(chǎn)品中���。未偶聯(lián)藥物的相關(guān)形式,如連接藥物種類或其他降解產(chǎn)物���,也可以在偶聯(lián)物存儲(chǔ)期間釋放���。因此,開(kāi)發(fā)和應(yīng)用合適的方法來(lái)檢測(cè)���、表征和量化游離藥物是至關(guān)重要的���。常規(guī)的游離藥物監(jiān)控方法的開(kāi)發(fā)思路如下。
分子大小變異體
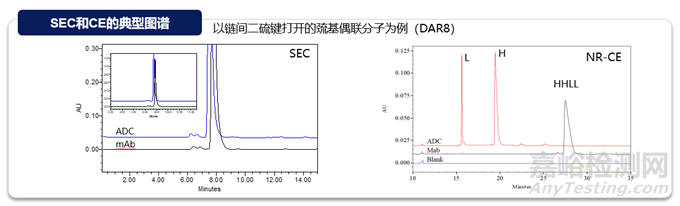
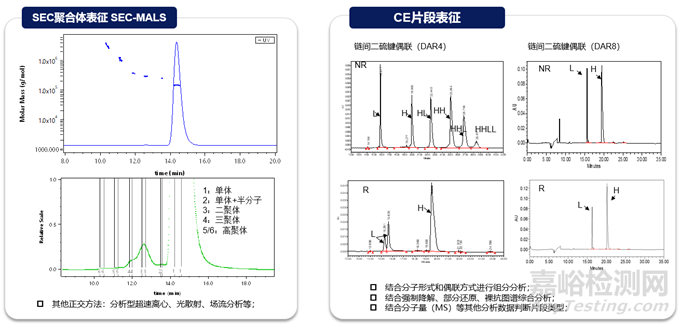
分子大小變異體(聚集體���、片段等)是重要的質(zhì)量屬性���,可直接影響蛋白質(zhì)療法的療效或安全性���。聚集是蛋白質(zhì)最常見(jiàn)的物理降解途徑,且ADC比抗體更容易聚集���,主要是因?yàn)樗幬?連接子分子的存在���,使連接位點(diǎn)的局部表面具有更多的疏水性。與抗體分析的技術(shù)一致���,體積排阻色譜(SEC)���、光散射(SEC-MALS)等常規(guī)技術(shù)可用于支持ADC分子聚合體的分析表征,非還原/還原毛細(xì)管電泳(non-reduced/reduced Capillary Electrophoresis)可用于支持ADC片段的分析表征���。
電荷變異體
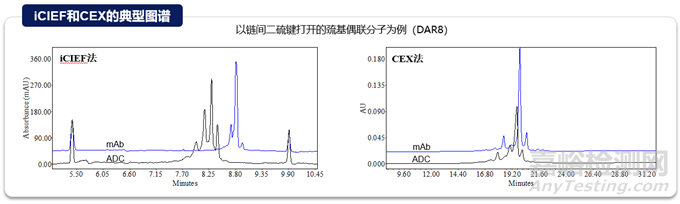
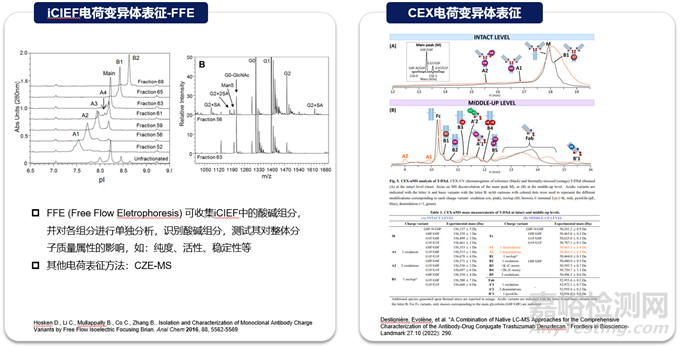
與抗體一致���,ADC的電荷變異體是關(guān)鍵的質(zhì)量屬性,因?yàn)樗鼈儗?duì)穩(wěn)定性和生物活性有潛在影響���。在ADC中可以觀察到各種形式的與電荷相關(guān)的異質(zhì)性���,貢獻(xiàn)這些異質(zhì)性的因素包括抗體自身展示的電荷變異性、偶聯(lián)工藝過(guò)程引入的修飾���、小分子藥物本身的結(jié)構(gòu)以及在不同偶聯(lián)位點(diǎn)引起的電荷變化等���。常規(guī)分析技術(shù)如離子交換色譜(Ion Exchange Chromatography,IEX)或者等點(diǎn)聚焦電泳(iCIEF)可以實(shí)現(xiàn)電荷變異體的監(jiān)測(cè)���。常規(guī)的電荷變異體表征策略也適用于ADC分子���,富集單一變異體組分后,進(jìn)行完整水平(Top-down)���、亞基水平(Middle-down)或肽段水平(bottom-up)質(zhì)譜解析���。
ADC作為一種抗癌治療極具潛力的藥物,引起越來(lái)越多的興趣���。與單獨(dú)的抗體相比���,ADC由于偶聯(lián)的異質(zhì)性而具有更高的結(jié)構(gòu)復(fù)雜性���。分析技術(shù)的改進(jìn)提供了更好的工具去表征這些產(chǎn)品,從而為ADC開(kāi)發(fā)人員提供工藝和處方開(kāi)發(fā)所需的信息���,并確定質(zhì)量控制批放行和穩(wěn)定性測(cè)試所需穩(wěn)健耐用的方法���。
參考文獻(xiàn)
1)Nakada, T., Sugihara, K., Jikoh, T., Abe, Y., & Agatsuma, T. (2019). The latest research and development into the antibody–drug conjugate, [fam-] trastuzumab deruxtecan (DS-8201a), for HER2 cancer therapy. Chemical and Pharmaceutical Bulletin, 67(3), 173-185.
2)Tong, J. T., Harris, P. W., Brimble, M. A., & Kavianinia, I. (2021). An insight into FDA approved antibody-drug conjugates for cancer therapy. Molecules, 26 (19), 5847.
3)Fu, Z., Li, S., Han, S., Shi, C., & Zhang, Y. (2022). Antibody drug conjugate: the “biological missile” for targeted cancer therapy. Signal Transduction and Targeted Therapy, 7(1), 93.
4)Kim, M. T., Chen, Y., Marhoul, J., & Jacobson, F. (2014). Statistical modeling of the drug load distribution on trastuzumab emtansine (Kadcyla), a lysine-linked antibody drug conjugate. Bioconjugate chemistry, 25(7), 1223-1232.
5)Wakankar A, Chen Y, Gokarn Y, et al. Analytical methods for physicochemical characterization of antibody drug conjugates[C]//MAbs. Taylor & Francis, 2011, 3(2): 161-172.
6)Matsuda Y, Mendelsohn BA. Recent Advances in Drug-Antibody Ratio Determination of Antibody-Drug Conjugates. Chem Pharm Bull (Tokyo). 2021;69(10):976-983.
7)Chapel, Soraya, et al. "Two-dimensional liquid chromatography coupled to high-resolution mass spectrometry for the analysis of ADCs." Antibody-Drug Conjugates: Methods and Protocols (2020): 163-185.
8)Hosken D., Li C., Mullappally B., Co C., Zhang B.. Isolation and Characterization of Monoclonal Antibody Charge Variants by Free Flow Isoelectric Focusing Brian. Anal Chem 2016, 88, 5562-5569
9)Deslignière, Evolène, et al. "A Combination of Native LC-MS Approaches for the Comprehensive Characterization of the Antibody-Drug Conjugate Trastuzumab Deruxtecan." Frontiers in Bioscience-Landmark 27.10 (2022): 290.