相比于靜脈注射的抗體藥物����,皮下注射制劑可以減少輸液的時間��,較少輸液耗材使用��,同時一些預裝針的使用可以方便患者自行用藥和長期用藥�,提高用藥依從性。因此��,在已上市注射劑的基礎上��,進一步開發(fā)皮下注射劑型成為下一代抗體藥物開發(fā)的新選擇����。同時�,新開發(fā)的抗體制劑也大多數(shù)轉向皮下制劑開發(fā)。然而����,皮下注射制劑與靜脈注射相比��,濃度較高��,物理穩(wěn)定性較差�,且容易產(chǎn)生免疫反應��,開發(fā)皮下注射制劑存在一定挑戰(zhàn)�。本文對抗體皮下注射制劑開發(fā)技術進行總結,以期為業(yè)內(nèi)相關研究提供參考��。
一��、提高抗體濃度技術
1.處方
皮下注射制劑給藥體積一般小于2ml,要想與靜脈注射制劑達到相同的給藥劑量就必須提高給藥濃度����,然而高濃度的抗體制劑物理穩(wěn)定性差,容易聚集��,且粘度較大�,給生產(chǎn)工藝中灌裝及后續(xù)注射器給藥帶來不便。從處方上考慮通常添加聚山梨酸酯等非離子表面活性劑以減少抗體聚集����。需要注意的是�,殘留宿主細胞蛋白(HCPs)中的酶可誘導水解表面活性劑分子中的酯鍵�,導致聚山梨酸酯的降解,并且這種影響在高單抗?jié)舛认驴赡芨用黠@����。此外,可以通過改變離子強度��、優(yōu)化pH值/選擇合適緩沖液或使用特定添加劑(如精氨酸等氨基酸��、氯化鈉等)來降低粘度����。
2.制劑工藝
處方調(diào)整后,對于仍然易于聚集��,穩(wěn)定性較差的抗體�,可以考慮采用凍干工藝提高長期儲存穩(wěn)定性。然而�,凍干粉針劑需要稀釋劑和重構步驟����,無法使用標準預充式注射器和自動注射器進行患者自我給藥,需要使用更復雜的雙腔注射器��,將凍干產(chǎn)品和稀釋劑分別放在不同的腔室中,增加了皮下給藥的復雜性����。此外,高濃度的凍干制劑由于凍干餅的物理性質����,例如孔徑和結晶度等影響,復溶時間很有可能會長達30分鐘以上����。
近年來,研究者們開發(fā)了一些新的高濃度抗體制劑制備方法��,例如�,Maa等人研究了使用噴霧干燥制備高濃度單抗粉末懸浮液的方法,運用噴霧干燥的方法將單抗懸浮在乙酸乙酯��、苯甲酸芐酯或Miglyol 840中��,抗體濃度大于300 mg/ml����。Bechthold-Peters等人還討論了其他蛋白質干燥技術,例如超臨界流體干燥�。另外��,Altus biologics公司固體單克隆抗體晶也已成功用于開發(fā)高濃度的單克隆抗體懸浮液����,并已在臨床前和早期臨床開發(fā)中進行了測試�。但是,皮下給藥的單克隆抗體晶體可能會產(chǎn)生一些不希望的緩釋效應����。
二、增大給藥體積技術
當藥物濃度提高到一定限度仍然不能滿足給藥劑量時��,可以考慮采取一些辦法增大給藥體積����。一般來說,皮下注射劑的最大注射量約為1-2 mL�。然而,皮下注射量取決多方面因素����,包括注射速度、注射部位�、注射量、滲漏/組織背壓����、藥物制劑組成和個體患者特征,包括患者的疼痛感覺敏感性等�。Mathaes等人得出結論,可以考慮大于2.5 mL的皮下注射體積����,例如,600mg卡西維單抗和600mg 伊德單抗注射用于COVID-19單抗治療;使用方法為120 mg/ml濃度在不同部位進行四次皮下注射�,每次2.5 mL。另一個例子是evolocumab��,此藥可通過可穿戴設備在5-9分鐘的時間內(nèi)注射420mg /3.5 mL�。
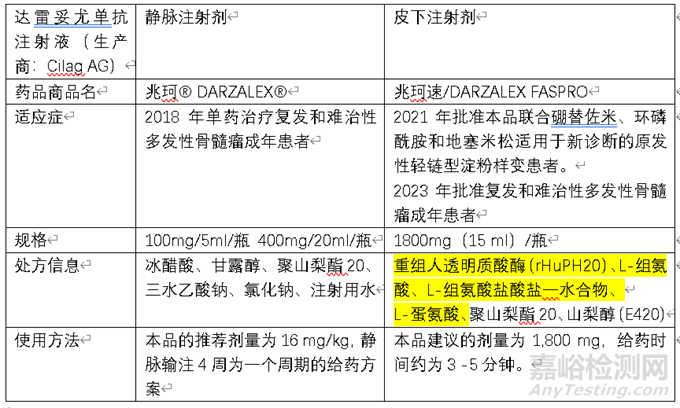
通過使用重組透明質酸酶PH20 (rHuPH20),一種降解局部透明質基質的酶�,可以顯著增加皮下給藥的最大注射量。透明質酸存在于人體皮下間隙�,作為液體流動的一個屏障。透明質酸酶通過在注射部位局部分解透明質酸并暫時清除該屏障��,因此大量的液體可以被注入皮下間隙并分散��。而透明質酸在24小時之內(nèi)即可在皮膚下恢復��。因此,采用重組人透明質酸酶(rHuPH20)技術可突破給藥量限制在2ml的皮下天然屏障�,允許將較大劑量的藥物通過一次皮下注射遞送。rHuPH20在包括歐盟和美國在內(nèi)的全球多個市場獲得批準��,其安全性和有效性已得到證實��。臨床研究還發(fā)現(xiàn)��,rHuPH20有助于改善共同給藥產(chǎn)品的藥代動力學特征����,提高生物利用度、提升最高血藥濃度(Cmax)�,以及縮短藥物達峰時(Tmax)等。使用rHuPH20開發(fā)用于皮下注射制劑的單克隆抗體的例子包括赫賽汀®和MabThera®�。赫賽汀®皮下注射實現(xiàn)曲妥珠單抗劑量的濃縮,從420mg(20ml)濃縮至600mg(5ml)��,和靜脈劑型具有相似的藥代動力學結果�。MabThera 10mg/ml通過靜脈輸注給藥全程耗時約2.5小時,而皮下注射劑型MabThera(非霍奇金淋巴瘤(NHL): 1400 mg /11.7 mL; 慢性淋巴細胞白血?�。–LL): 1600 mg, 13.4 mL solution)通過皮下注給藥����,耗時僅為5分鐘,而且創(chuàng)傷更小。
三����、抗體設計技術
當上述技術都無法滿足開發(fā)皮下注射劑所需的濃度或體積時�,就需要從分子本身的角度出發(fā)尋求新的突破。例如�,治療性單克隆抗體的主要同型IgG1家族,其氨基酸序列總體上非常相似�,只有可變區(qū)域的12個CDRS是高度可變的;使用蛋白工程可以在不影響其抗原結合或Fc藥理活性的情況下,提高分子的延展性�,降低黏度和防止聚集。Wu和他的同事們通過在可變區(qū)突變��,通過改變CH3-H區(qū)疏水性�,以及在CH2-H區(qū)引入n -糖基化位點增加其pl來設計他們的IgG1分子。據(jù)報道��,最后一種方法的溶解度提高了至少8倍��,同時保持了原有的結合親和力�。Kant及其同事在單克隆抗體中發(fā)現(xiàn)了聚集傾向區(qū)(APRs)。通過引入人工合成的“卡口”殘基��,在保持抗原結合的同時����,顯著降低聚集傾向��。
另一種方法是設計抗體片段��,而不是使用整個單抗分子��。例如����,上市單抗片段(Fab)有阿昔單抗和雷珠單抗�。此外,單克隆抗體的基本分子結構可以重新設計��,例如:Certolizumab pegol(塞妥珠單抗)是抗TNF- α單抗的Fab片段和聚乙二醇(40 kDa)的組合����。它的總分子量是91 kDa。Certolizumab pegol可作為200 mg/mL溶液用于皮下注射��,其藥代動力學行為(tmax和t1/2)與全長鏈單抗相當��。另一個例子是納米抗體�,它是在羊駝外周血液中發(fā)現(xiàn)的一種天然缺失輕鏈的抗體。這類抗體只包含1個重鏈可變區(qū)(VHH)和2個常規(guī)的CH2及CH3區(qū)����,與人工改造的單鏈抗體片段不同��,其不易相互粘連����、聚集成塊����,更重要的是����,單獨克隆并表達的VHH結構具有與原重鏈抗體相當?shù)慕Y構穩(wěn)定性以及結合抗原的活性,是已知可結合目標抗原的最小單位�,因此被稱作納米抗體或單域抗體。唯一被批準的納米抗體制劑是一種二價單域抗體caplacizumab�,其分子量為28 kDa,體內(nèi)半衰期相對較短����,因此皮下注為一天一次。Caplacizumab是治療血栓性血小板減少性紫癜(TTP)的納米抗體藥物��。
四�、批準上市產(chǎn)品
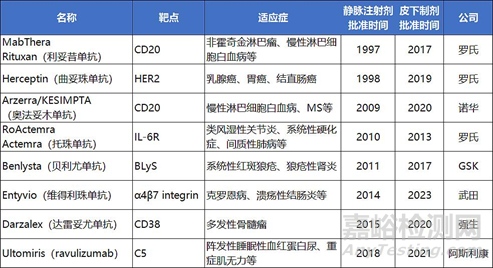
下表展示了FDA批準的不同注射劑型單抗
以下選擇兩個國內(nèi)上市靜脈注射制劑改成皮下注射制劑案例進行解析
案例1
案例2
2021年����,先聲藥業(yè)��、思路迪醫(yī)藥��、康寧杰瑞生物制藥三方戰(zhàn)略合作的PD-L1單域抗體恩維達®(恩沃利單抗注射液)正式獲得NMPA批準����,成為首個且目前唯一獲準上市的皮下注射PD-L1抗體藥物。它是人源化抗程序性死亡配體-1(PD-L1)單域抗體和人免疫球蛋白IgG1Fc片段的新型融合蛋白��,與其他靜脈注射單抗相比����,該產(chǎn)品獨特的分子結構為皮下注射提供成藥的可能性,注射劑量只是其他靜脈注射藥物絕對劑量的八分之一�,安全性更高。此外�,臨床治療只需要皮下注射30秒,使得腫瘤免疫治療可在家完成�。近兩年,藥企開發(fā)皮下注射PD-L1熱情高漲����,君實生物特瑞普利單抗皮下注射液JS001sc已于2022年3月獲批臨床�,恒瑞PD-1皮下注射劑SHR-1901正在開展臨床研究�,百濟神州也于今年8月向NMPA遞交了替雷利珠單抗皮下注射劑的臨床申請。
五��、總結
開發(fā)皮下注射抗體制劑關鍵在于提高抗體濃度的同時避免蛋白的聚集��,盡量降低抗體粘度�。對于創(chuàng)新藥而言,如果能在藥物設計階段就考慮高溶解性�、低粘度和低聚集的抗體分子將有助于規(guī)避后期制劑開發(fā)的種種問題,從而簡化藥物開發(fā)途徑�,縮短開發(fā)時間。對于改變給藥途徑的藥物開發(fā)而言�,選擇合適的輔料����、運用新型的制劑技術是開發(fā)成功的關鍵。為了便于高粘度抗體制劑的皮下注射�,一些新型的給藥系統(tǒng)也應運而生,例如:錐形針以及具有各種壓力分布的高壓注射器����,可用于各種類型產(chǎn)品皮下注射。此外�,還有一些通過25#針頭可以注入粘度值高達1000cp的溶液的輸液系統(tǒng)��,如Bespak和Arc-Bios系統(tǒng)�。隨著技術的發(fā)展��,越來越多的新方法可以使皮下注射劑的開發(fā)成為可能�。值得注意的是,不管是新分子還是改變給藥途徑�,開發(fā)皮下注射劑首先還是要從臨床安全性和有效性出發(fā),關注免疫原性和藥代動力學的變化��。
參考文獻:
1.Jiskoot W, Hawe A, Menzen T, Volkin DB, Crommelin DJA. Ongoing Challenges to Develop High Concentration Monoclonal Antibody-based Formulations for Subcutaneous Administration: Quo Vadis? J Pharm Sci. 2022 Apr;111(4):861-867.
2.Turner MR, Balu-Iyer SV. Challenges and Opportunities for the Subcutaneous Delivery of Therapeutic Proteins. J Pharm Sci. 2018 May;107(5):1247-1260.
3.Bittner B, Richter W, Schmidt J. Subcutaneous Administration of Biotherapeutics: An Overview of Current Challenges and Opportunities. BioDrugs. 2018 Oct;32(5):425-440.