今日頭條
蘇州勤浩SHP2抑制劑獲批肺癌臨床����。勤浩醫(yī)藥1類化藥GH21膠囊獲國(guó)家藥監(jiān)局臨床許可�,擬聯(lián)合甲磺酸奧希替尼片用于治療伴有表皮生長(zhǎng)因子受體(EGFR)突變的晚期非小細(xì)胞肺癌(NSCLC)。GH21是一款新型蛋白酪氨酸磷酸酶(SHP2)變構(gòu)抑制劑��,正在中美兩地開(kāi)展用于治療晚期實(shí)體瘤的Ⅰ/Ⅱ期臨床。已有研究數(shù)據(jù)顯示��,GH21具有良好的PK和安全性,同時(shí)在低劑量組已觀察到初步療效信號(hào)����。
國(guó)內(nèi)藥訊
1.錦州奧鴻C(jī)DK4/6抑制劑報(bào)產(chǎn)��。復(fù)星醫(yī)藥旗下奧鴻藥業(yè)開(kāi)發(fā)的CDK4/6抑制劑FCN-437c的上市申請(qǐng)獲CDE受理,推測(cè)申報(bào)的適應(yīng)癥為“激素受體陽(yáng)性/人表皮生長(zhǎng)因子受體2陰性(HR+/HER2-)晚期乳腺癌”�。公布于ASCO2022年會(huì)上Ⅰb期臨床數(shù)據(jù)顯示����,F(xiàn)CN-437c的客觀緩解率(ORR)為57.1%��;6個(gè)月和12個(gè)月的PFS率分別為92.3%和83.5%,DOR率分別為100%和90%。此外����,藥物耐受性良好��。
2.映恩HER2-ADC啟動(dòng)國(guó)際III期臨床����。映恩生物HER2 ADC藥物DB-1303在中國(guó)登記啟動(dòng)一項(xiàng)III期臨床(DYNASTY-Breast02),旨在評(píng)估DB-1303與研究者選擇的化療方案在接受內(nèi)分泌治療后出現(xiàn)疾病進(jìn)展的HER2低表達(dá)、激素受體陽(yáng)性轉(zhuǎn)移性乳腺癌患者中有效性和安全性。這是一項(xiàng)國(guó)際Ⅲ期臨床��,中國(guó)部分的主要研究者由中國(guó)醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院醫(yī)學(xué)博士徐兵河和復(fù)旦大學(xué)附屬腫瘤醫(yī)院醫(yī)學(xué)博士邵志敏共同擔(dān)任��。
3.安進(jìn)長(zhǎng)效多肽PDC在華獲批減重臨床����。安進(jìn)1類生物制品AMG 133獲國(guó)家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可����,擬開(kāi)發(fā)用于體重控制。AMG 133是一款GIPR/GLP-1R雙抗多肽偶聯(lián)(PDC)藥物,目前正在Ⅱ期臨床中評(píng)估用于超重或肥胖無(wú)糖尿病患者�、超重或肥胖合并2型糖尿病患者減重的治療效果。在I期臨床中�,與安慰劑相比�,AMG 133(140mg和420mg)每四周給藥一次可使患者體重顯著下降(-7.2%和-14.5%�,vs1.49%)。
4.AZ二代PRMT5抑制劑中國(guó)報(bào)IND。阿斯利康1類化藥AZD3470薄膜衣片的臨床試驗(yàn)申請(qǐng)獲CDE受理。AZD3470是一款特異性靶向甲基硫代腺苷(MTA)和蛋白質(zhì)精氨酸甲基轉(zhuǎn)移酶5(PRMT5)復(fù)合物的二代PRMT5抑制劑,可減少一代PRMT5抑制劑的血液毒性等不良作用,提高治療指數(shù)����。在臨床前研究中,AZD3470已在肺腫瘤異種移植模型中顯示出積極的抗腫瘤活性�。
5.海思科DPP-1抑制劑授權(quán)海外權(quán)益。海思科與意大利Chiesi公司就其臨床期高選擇性二肽基肽酶1(DPP-1)小分子抑制劑HSK31858簽署許可協(xié)議,Chiesi將獲得HSK31858在大中華區(qū)以外的全球開(kāi)發(fā)、生產(chǎn)和商業(yè)化的獨(dú)家權(quán)利。HSK31858臨床擬用于治療支氣管擴(kuò)張癥及急性肺損傷/急性呼吸窘迫綜合征引起的下呼吸道疾病。根據(jù)協(xié)議����,海思科將獲得首付款1300萬(wàn)美元����,開(kāi)發(fā)、監(jiān)管和商業(yè)里程碑后期付款以及產(chǎn)品的銷售提成��。預(yù)計(jì)項(xiàng)目交易金額合計(jì)4.62億美元。
國(guó)際藥訊
1.長(zhǎng)效PTH前藥獲批上市��。Ascendis Pharma公司長(zhǎng)效甲狀旁腺激素(PTH)前藥Yorvipath(palopegteriparatide)獲歐盟委員會(huì)批準(zhǔn)上市����,用于治療成人慢性甲狀旁腺功能減退(HP)。在III期PaTHway研究中�,與安慰劑組相比,Yorvipath治療組實(shí)現(xiàn)不依賴常規(guī)治療并保持血清鈣水平在正常范圍內(nèi)(8.3–10.6 mg/dL)的患者比例更高(78.7%vs4.8%,p<0.0001)�。就在上周��,該公司在美國(guó)重新提交Yorvipath的新藥申請(qǐng)����,以及新的生產(chǎn)控制策略。
2.強(qiáng)生EGFR/c-MET雙抗報(bào)sBLA。強(qiáng)生EGFR/c-Met雙抗藥物Rybrevant(amivantamab)向FDA遞交補(bǔ)充生物制品許可申請(qǐng)(sBLA)�,與化療(卡鉑和培美曲塞)聯(lián)用治療EGFR ex19del或L858R突變�、局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)經(jīng)治患者。在Ⅲ期臨床MARIPOSA-2中����,與單獨(dú)化療相比�,Rybrevant(伴和不伴lazertinib)和化療兩種方案均顯著提高患者無(wú)進(jìn)展生存期��,將疾病進(jìn)展或死亡的風(fēng)險(xiǎn)分別降低56%和52%。
3.施維雅IDH1/2抑制劑Ⅲ期臨床積極�。施維雅潛在“first-in-class”IDH1/2抑制劑vorasidenib治療IDH突變型彌漫性膠質(zhì)瘤的Ⅲ期臨床INDIGO積極結(jié)果公布于SNO2023年會(huì)上��。與安慰劑相比����,vorasidenib治療患者顯著改善無(wú)進(jìn)展生存期(中位PFS:27.7個(gè)月vs11.1個(gè)月);vorasidenib組患者每六個(gè)月腫瘤體積平均減少2.5%��,而安慰劑組患者的腫瘤體積平均每六個(gè)月增加13.9%��。該公司計(jì)劃在年底向FDA提交vorasidenib新藥申請(qǐng)�。
4.新型放療藥物膠質(zhì)瘤Ⅱ期臨床積極��。Plus公司可注射放療藥物186Re-obisbemeda治療復(fù)發(fā)性膠質(zhì)母細(xì)胞瘤(rGBM)的Ⅱ期臨床ReSPECT-GBM結(jié)果積極����。與貝伐珠單抗相比����,186Re-obisbemeda治療顯著提高患者總生存期(mOS:13個(gè)月vs8個(gè)月),將死亡風(fēng)險(xiǎn)降低63%��。兩組患者中位無(wú)進(jìn)展生存期(mPFS)分別為11個(gè)月和為4個(gè)月����。此外����,藥物的總體安全性良好�。
5.拜耳口服XIa抑制劑III期臨床失敗。拜耳宣布終止新型口服FXIa抑制劑Asundexian用于預(yù)防有卒中風(fēng)險(xiǎn)的房顫患者發(fā)生卒中或體循環(huán)栓塞的III期OCEANIC-AF研究����。根據(jù)獨(dú)立數(shù)據(jù)監(jiān)測(cè)委員會(huì)(IDMC)評(píng)估��,asundexian的療效數(shù)據(jù)統(tǒng)計(jì)劣效于對(duì)照組(阿哌沙班)����。不過(guò),asundexian的安全性與已知研究一致�。在II期臨床中��,Asundexian與阿哌沙班相比至少減少50%的出血事件����。
6.百時(shí)美施貴BCMA CAR-T療法sBLA被延遲審評(píng)。FDA延遲審查百時(shí)美施貴寶與2seventy bio開(kāi)發(fā)的BCMA靶向CAR-T療法Abecma用于治療已接受免疫調(diào)節(jié)劑����、蛋白酶體抑制劑和抗CD38單抗治療的復(fù)發(fā)和難治性多發(fā)性骨髓瘤(MM)的補(bǔ)充生物制劑許可申請(qǐng)(sBLA)。在臨床研究KarMMa-3中����,在接受過(guò)2-4線的患者中����,Abecma治療較對(duì)照組使疾病進(jìn)展或死亡風(fēng)險(xiǎn)降低51%(mPFS:13.3個(gè)月vs4.4個(gè)月)。目前FDA尚未確定ODAC會(huì)議時(shí)間�,預(yù)計(jì)需提供OS數(shù)據(jù)。
醫(yī)藥熱點(diǎn)
1.歐洲國(guó)家禁止Ozempic用于減肥�。近日�,由于糖尿病患者藥物短缺��,比利時(shí)(Belgium)宣布禁止將諾和諾德公司的糖尿病藥物Ozempic用于減肥����,德國(guó)正在考慮采取類似的行動(dòng)。司美格魯肽以治療2型糖尿病的Ozempic和減肥的Wegovy的雙品牌策略上市�,但兩者都有相同的活性成分,進(jìn)而導(dǎo)致了廣泛的標(biāo)簽外使用����。諾和諾德11月10日在其網(wǎng)站上更新的一份聲明中表示,預(yù)計(jì)“供應(yīng)將持續(xù)中斷”����,并將限制低劑量的批發(fā)商向零售藥店分銷�。
2.上海13家醫(yī)院成為國(guó)際醫(yī)療旅游試點(diǎn)單位�。11月16-18日����,上海召開(kāi)第四屆海峽兩岸國(guó)際醫(yī)療與特需服務(wù)發(fā)展大會(huì),確定首批13家上海三甲綜合醫(yī)院和三級(jí)?�?漆t(yī)院作為國(guó)際醫(yī)療旅游試點(diǎn)單位����。該項(xiàng)目由復(fù)旦大學(xué)附屬華山醫(yī)院牽頭��,正在制定“國(guó)際醫(yī)療服務(wù)規(guī)范”上海市地方標(biāo)準(zhǔn)��,填補(bǔ)國(guó)內(nèi)該領(lǐng)域空白。預(yù)計(jì)到2025年��,中國(guó)醫(yī)療旅游市場(chǎng)規(guī)模將達(dá)到3000億元�。
3.首都醫(yī)學(xué)科學(xué)創(chuàng)新中心揭牌��。11月9日�,首都醫(yī)學(xué)科學(xué)創(chuàng)新中心在首都醫(yī)科大學(xué)正式揭牌�,梅林教授受聘擔(dān)任創(chuàng)新中心主任。創(chuàng)新中心將密切聯(lián)合首都醫(yī)科大學(xué)院系及學(xué)科特色明顯的附屬醫(yī)院����,充分挖掘和利用首都地區(qū)優(yōu)質(zhì)臨床資源,致力于探索建立以醫(yī)學(xué)為核心��,以有目標(biāo)�、有組織科研為主的新型醫(yī)學(xué)研究組織模式��,建立促進(jìn)基礎(chǔ)研究和臨床醫(yī)學(xué)研究成果轉(zhuǎn)化的平臺(tái)體系����,推動(dòng)醫(yī)學(xué)基礎(chǔ)研究和轉(zhuǎn)化醫(yī)學(xué)研究相結(jié)合����,建設(shè)世界高水平醫(yī)藥創(chuàng)新研發(fā)集群����。
評(píng)審動(dòng)態(tài)
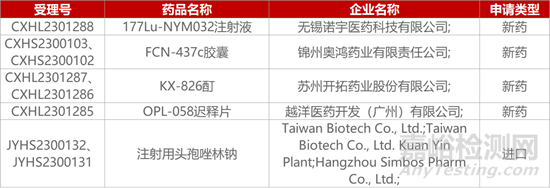
1. CDE新藥受理情況(11月21日)
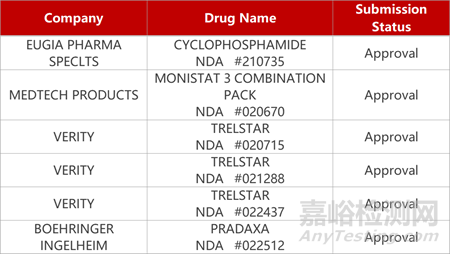
2. FDA新藥獲批情況(北美11月20日)