一�、概述
ICH Q10將藥品生命周期內(nèi)的技術(shù)活動(dòng)劃分為工藝開發(fā)�����、技術(shù)轉(zhuǎn)移�����、商業(yè)生產(chǎn)�、產(chǎn)品終止四個(gè)階段[1]。藥品技術(shù)轉(zhuǎn)移是藥品生命周期中的關(guān)鍵環(huán)節(jié)���,它涉及藥企內(nèi)部從研發(fā)到生產(chǎn)階段的平穩(wěn)過渡�,也涉及藥品在企業(yè)內(nèi)部或外部不同生產(chǎn)場地之間的轉(zhuǎn)移和驗(yàn)證�����。技術(shù)轉(zhuǎn)移要確保質(zhì)量的一致性�����,轉(zhuǎn)移過程需要進(jìn)行細(xì)致的風(fēng)險(xiǎn)評(píng)估�����、風(fēng)險(xiǎn)控制�、方案計(jì)劃以及驗(yàn)證實(shí)施等。
質(zhì)量風(fēng)險(xiǎn)管理(Quality Risk Management���,QRM)在藥品技術(shù)轉(zhuǎn)移過程中起到了重要的作用���。它通過風(fēng)險(xiǎn)識(shí)別和評(píng)估、采取應(yīng)對(duì)和改進(jìn)措施�、建立控制策略、制定驗(yàn)證計(jì)劃以及促進(jìn)團(tuán)隊(duì)溝通�����,以保障在技術(shù)轉(zhuǎn)移過后新工廠或?qū)嶒?yàn)室能夠產(chǎn)出符合預(yù)期質(zhì)量的藥品���,確保技術(shù)轉(zhuǎn)移的順利進(jìn)行�。
二�、技術(shù)轉(zhuǎn)移活動(dòng)與法規(guī)參考
藥品技術(shù)轉(zhuǎn)移方案包含一系列有計(jì)劃的和受控的活動(dòng),這些活動(dòng)根據(jù)規(guī)定好的可接受標(biāo)準(zhǔn)���,從轉(zhuǎn)出方傳遞生產(chǎn)工藝�、分析方法�����、原輔料、包裝材料�����、或者其他任何與藥品生命周期有關(guān)的步驟或者工藝到接收方���。技術(shù)轉(zhuǎn)移是一個(gè)系統(tǒng)性的程序���,遵守該程序是為了能將在研發(fā)過程中已記錄和/或已驗(yàn)證的知識(shí)和經(jīng)驗(yàn)轉(zhuǎn)移到另外一個(gè)適當(dāng)?shù)慕?jīng)過授權(quán)的責(zé)任主體方。
2.1 技術(shù)轉(zhuǎn)移活動(dòng)與管理
在當(dāng)前制藥行業(yè)環(huán)境中涉及的技術(shù)轉(zhuǎn)移活動(dòng)主要體現(xiàn)在如下方面:
1)企業(yè)內(nèi)部:
①研發(fā)部將小試轉(zhuǎn)移到中試(臨床批次)���;
②研發(fā)部轉(zhuǎn)移到商業(yè)化生產(chǎn)現(xiàn)場�;
③產(chǎn)品從老現(xiàn)場轉(zhuǎn)移新現(xiàn)場�����;
2)企業(yè)之間:
①研發(fā)機(jī)構(gòu)轉(zhuǎn)移到商業(yè)化生產(chǎn)現(xiàn)場���;
②商業(yè)化生產(chǎn)現(xiàn)場轉(zhuǎn)移到新商業(yè)化生產(chǎn)現(xiàn)場(包括委托生產(chǎn)、項(xiàng)目轉(zhuǎn)讓等)�����;
③商業(yè)化生產(chǎn)企業(yè)委托另外一家具備相應(yīng)資質(zhì)和條件的公司(實(shí)驗(yàn)室)進(jìn)行放行檢驗(yàn)測(cè)試。
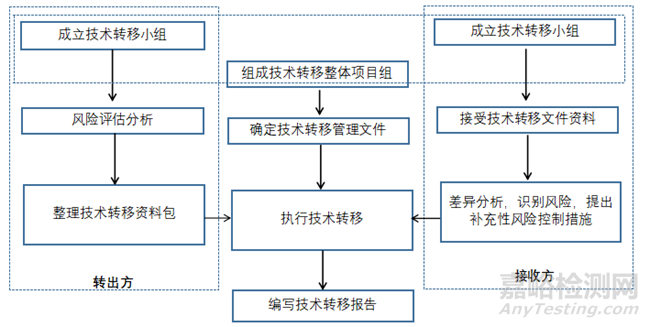
藥品技術(shù)轉(zhuǎn)移項(xiàng)目管理需要由技術(shù)轉(zhuǎn)出方和技術(shù)接收方協(xié)調(diào)完成�����, 轉(zhuǎn)移項(xiàng)目應(yīng)通過一系列組織化的管理流程進(jìn)行管理和執(zhí)行( 見圖2) �����。一般在技術(shù)轉(zhuǎn)移工作啟動(dòng)之前���,參與技術(shù)轉(zhuǎn)移的各方應(yīng)當(dāng)制定清晰明確的轉(zhuǎn)移流程:
① 組建轉(zhuǎn)移團(tuán)隊(duì)���,明確轉(zhuǎn)移雙方人員的角色與職責(zé);
② 明確轉(zhuǎn)移的工作計(jì)劃與節(jié)點(diǎn)目標(biāo)���;
③ 起草轉(zhuǎn)移方案�;
④ 確認(rèn)資源就位( 經(jīng)培訓(xùn)合格的人員���、滿足要求的設(shè)備�、檢驗(yàn)合格的物料等) �����;
⑤ 實(shí)施轉(zhuǎn)移;
⑥ 整理與分析數(shù)據(jù)�����, 形成轉(zhuǎn)移報(bào)告�����, 完成轉(zhuǎn)移�����。
▲圖1-藥品技術(shù)轉(zhuǎn)移項(xiàng)目管理流程
項(xiàng)目轉(zhuǎn)移過程需要轉(zhuǎn)移雙方緊密無間的高度配合�。轉(zhuǎn)移雙方需深度交流并共同制定轉(zhuǎn)移方案,轉(zhuǎn)出方通過培訓(xùn)或技術(shù)指導(dǎo)使接收方對(duì)轉(zhuǎn)移技術(shù)具有全面的理解和認(rèn)知�����。
2.2 參考法規(guī)
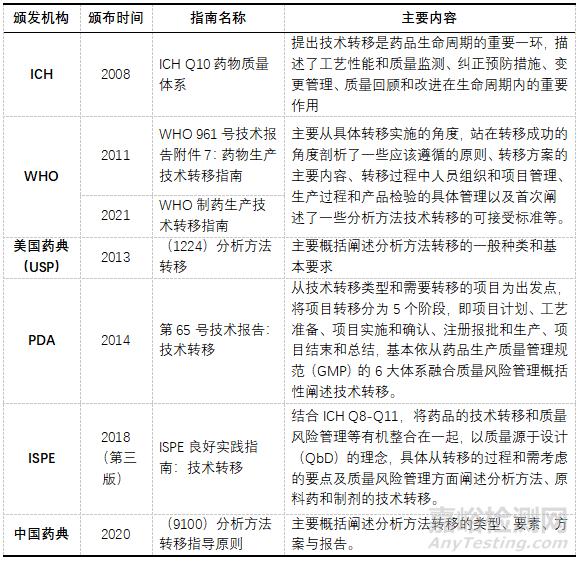
在技術(shù)轉(zhuǎn)移項(xiàng)目執(zhí)行過程中�����,必須參考法規(guī)指南合理合規(guī)的實(shí)施�����,匯總涉及項(xiàng)目轉(zhuǎn)移的不同技術(shù)指南�����,供不同類型的技術(shù)轉(zhuǎn)移項(xiàng)目參考���,見表1���。
▲表1-制藥技術(shù)轉(zhuǎn)移參考法規(guī)與指南
三、技術(shù)轉(zhuǎn)移過程中的質(zhì)量風(fēng)險(xiǎn)管理
技術(shù)轉(zhuǎn)移過程中的質(zhì)量風(fēng)險(xiǎn)管理是確保技術(shù)轉(zhuǎn)移項(xiàng)目符合質(zhì)量標(biāo)準(zhǔn)和要求的關(guān)鍵�。包括對(duì)技術(shù)轉(zhuǎn)移過程中可能出現(xiàn)的質(zhì)量問題和風(fēng)險(xiǎn)進(jìn)行評(píng)估和控制,確保技術(shù)的有效性���、可靠性和安全性�。通過有效的質(zhì)量風(fēng)險(xiǎn)管理�,可以提高技術(shù)轉(zhuǎn)移項(xiàng)目的質(zhì)量水平,減少糾錯(cuò)成本�����,保證技術(shù)的順利轉(zhuǎn)移和實(shí)施。
3.1 質(zhì)量風(fēng)險(xiǎn)管理
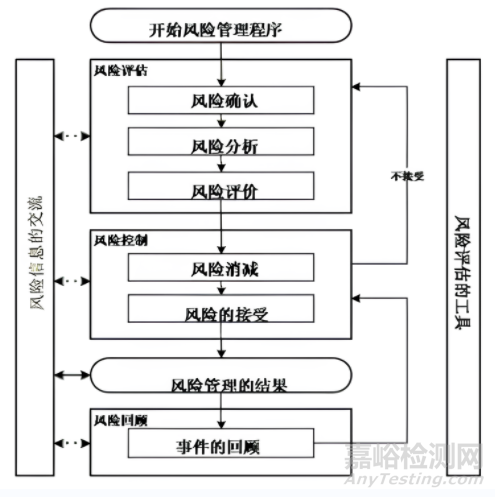
質(zhì)量風(fēng)險(xiǎn)管理是在整個(gè)產(chǎn)品生命周期中采用前瞻或回顧的方式�����,對(duì)質(zhì)量風(fēng)險(xiǎn)進(jìn)行識(shí)別���、評(píng)估�����、控制�����、溝通�、審核的系統(tǒng)過程�。其一般流程如下,圖2���。
▲圖2-質(zhì)量風(fēng)險(xiǎn)管理流程圖
風(fēng)險(xiǎn):危害發(fā)生的可能性及其嚴(yán)重程度�。
風(fēng)險(xiǎn)評(píng)估:在一個(gè)風(fēng)險(xiǎn)管理過程中用于支持所做的風(fēng)險(xiǎn)決策的組織信息的系統(tǒng)過程�����,其包含對(duì)危險(xiǎn)因素的辨識(shí),對(duì)暴露在這些危險(xiǎn)因素相關(guān)風(fēng)險(xiǎn)的分析�����、評(píng)價(jià)�����。
風(fēng)險(xiǎn)控制:實(shí)施風(fēng)險(xiǎn)管理決策的行為���。
從流程圖可看出,質(zhì)量風(fēng)險(xiǎn)管理過程分為:確定事件并啟動(dòng)風(fēng)險(xiǎn)管理流程→風(fēng)險(xiǎn)評(píng)估→風(fēng)險(xiǎn)控制→風(fēng)險(xiǎn)過程結(jié)果或輸出→風(fēng)險(xiǎn)回顧�����。
通過對(duì)質(zhì)量風(fēng)險(xiǎn)進(jìn)行評(píng)估�,可以識(shí)別出潛在的問題和風(fēng)險(xiǎn)源,從而采取相應(yīng)的預(yù)防和控制措施���,降低質(zhì)量風(fēng)險(xiǎn)發(fā)生的可能性和影響���。
3.2 技術(shù)轉(zhuǎn)移風(fēng)險(xiǎn)評(píng)估
技術(shù)轉(zhuǎn)移風(fēng)險(xiǎn)評(píng)估是在藥品技術(shù)轉(zhuǎn)移過程中進(jìn)行的一項(xiàng)關(guān)鍵工作。它旨在識(shí)別�、評(píng)估和管理技術(shù)轉(zhuǎn)移過程中可能面臨的風(fēng)險(xiǎn)和不確定性因素。通過風(fēng)險(xiǎn)評(píng)估,技術(shù)轉(zhuǎn)移團(tuán)隊(duì)可以定量或定性地確定風(fēng)險(xiǎn)的嚴(yán)重程度�、概率和可能的影響。
3.2.1風(fēng)險(xiǎn)評(píng)估考慮因素
技術(shù)轉(zhuǎn)移轉(zhuǎn)出和接收方需對(duì)轉(zhuǎn)移的新產(chǎn)品和工藝充分溝通討論���,并成立技術(shù)轉(zhuǎn)移項(xiàng)目組(詳見4.1)對(duì)轉(zhuǎn)入新產(chǎn)品的生產(chǎn)線�,從物料���、廠房���、設(shè)施、設(shè)備���、人員�����、法規(guī)�、文件�����、生產(chǎn)�、實(shí)驗(yàn)室控制�、方案裝與標(biāo)簽等方面存在的風(fēng)險(xiǎn)進(jìn)行評(píng)估���,針對(duì)存在的問題和風(fēng)險(xiǎn)制訂相應(yīng)的控制和預(yù)防�����,見表2。
▲表2-技術(shù)轉(zhuǎn)移風(fēng)險(xiǎn)評(píng)估因素
對(duì)各環(huán)節(jié)中的因素進(jìn)行分析�,列出風(fēng)險(xiǎn)評(píng)估中發(fā)現(xiàn)的風(fēng)險(xiǎn)點(diǎn),進(jìn)行逐一識(shí)別�����,查找導(dǎo)致風(fēng)險(xiǎn)的直接原因���,以及可能的后果進(jìn)行評(píng)估�,根據(jù)風(fēng)險(xiǎn)等級(jí)制定相應(yīng)的控制措施�。技術(shù)轉(zhuǎn)移接收方風(fēng)險(xiǎn)評(píng)估結(jié)束,由技術(shù)轉(zhuǎn)移風(fēng)險(xiǎn)評(píng)估小組起草風(fēng)險(xiǎn)評(píng)估報(bào)告經(jīng)相關(guān)部門和負(fù)責(zé)人審核批準(zhǔn)�。
3.2.2 轉(zhuǎn)移和接收方差距分析法
在技術(shù)轉(zhuǎn)移過程中,轉(zhuǎn)出方和接收方出現(xiàn)的任何差異都可能會(huì)給產(chǎn)品的實(shí)現(xiàn)帶來潛在的風(fēng)險(xiǎn)�,例如,可能延長技術(shù)轉(zhuǎn)移時(shí)間�、增加技術(shù)轉(zhuǎn)移活動(dòng)的費(fèi)用���、影響轉(zhuǎn)移產(chǎn)品的質(zhì)量等。差距分析是風(fēng)險(xiǎn)評(píng)估的一種���,通過識(shí)別接收方現(xiàn)有情況與轉(zhuǎn)出方的技術(shù)要求或預(yù)期標(biāo)準(zhǔn)之間的差距�,并提出相應(yīng)的控制措施���,確保產(chǎn)品引入的過程規(guī)范�。在制定技術(shù)轉(zhuǎn)移方案之前由轉(zhuǎn)出方和接收方各領(lǐng)域的主題專家組建差距分析小組開展技術(shù)轉(zhuǎn)移差距分析活動(dòng)�。
差距分析接收方為主,轉(zhuǎn)出方輔助�����,從“人�、機(jī)、料�����、法���、環(huán)�、測(cè)”等方面對(duì)于技術(shù)轉(zhuǎn)移過程進(jìn)行對(duì)比分析。
▲表3-差距分析法要素和要求
3.3 技術(shù)轉(zhuǎn)移風(fēng)險(xiǎn)控制
包括風(fēng)險(xiǎn)降低和接受風(fēng)險(xiǎn)兩個(gè)部分�,見表4。
▲表4-風(fēng)險(xiǎn)控制及要求
3.4 風(fēng)險(xiǎn)管理過程輸出/結(jié)果
技術(shù)轉(zhuǎn)移小組組長對(duì)風(fēng)險(xiǎn)管理過程輸出/結(jié)果以及對(duì)評(píng)估結(jié)果與糾正措施進(jìn)行審核�����,確認(rèn)風(fēng)險(xiǎn)分析與評(píng)估的合理性���,并經(jīng)過討論和決策�����,制定出風(fēng)險(xiǎn)應(yīng)對(duì)的措施和策略,并交由轉(zhuǎn)移雙方質(zhì)量部批準(zhǔn)實(shí)施���。
3.5 風(fēng)險(xiǎn)評(píng)審�、回顧
技術(shù)轉(zhuǎn)移小組在實(shí)施風(fēng)險(xiǎn)降低措施過程中���,有可能將新的風(fēng)險(xiǎn)引入系統(tǒng)�����,或增加了其他風(fēng)險(xiǎn)發(fā)生的可能�。因此,在措施實(shí)施后須重新進(jìn)行風(fēng)險(xiǎn)評(píng)估和風(fēng)險(xiǎn)回顧�����,見表5�。
▲表5-風(fēng)險(xiǎn)評(píng)審、回顧及要求
四�、技術(shù)轉(zhuǎn)移實(shí)施
技術(shù)轉(zhuǎn)移實(shí)施需要有細(xì)致的計(jì)劃、團(tuán)隊(duì)合作�����、驗(yàn)證和監(jiān)控評(píng)估���。它是確保技術(shù)順利轉(zhuǎn)移到商業(yè)化生產(chǎn)環(huán)境的重要步驟�����,對(duì)于保證產(chǎn)品質(zhì)量和有效至關(guān)重要�����。
4.1 技術(shù)轉(zhuǎn)移項(xiàng)目組
技術(shù)轉(zhuǎn)移活動(dòng)類型多樣���。企業(yè)內(nèi)的技術(shù)轉(zhuǎn)移活動(dòng)�����,因轉(zhuǎn)出方和接收方均在該企業(yè)的管理體系內(nèi)�����,其轉(zhuǎn)移流程相對(duì)可控���,技術(shù)轉(zhuǎn)移項(xiàng)目團(tuán)隊(duì)構(gòu)成關(guān)系相對(duì)簡單。對(duì)于企業(yè)間的技術(shù)轉(zhuǎn)移活動(dòng)�,因轉(zhuǎn)出方和接收方具有不同的質(zhì)量管理體系、不同的知識(shí)背景�,甚至是不同的藥政背景,其轉(zhuǎn)移流程相對(duì)復(fù)雜�,技術(shù)轉(zhuǎn)移項(xiàng)目團(tuán)隊(duì)需要更多的組織和溝通�,而且將會(huì)面臨更大的挑戰(zhàn)。
管理層
技術(shù)轉(zhuǎn)移項(xiàng)目組在技術(shù)轉(zhuǎn)移項(xiàng)目中以項(xiàng)目團(tuán)隊(duì)的形式出現(xiàn)�,任命項(xiàng)目經(jīng)理。項(xiàng)目經(jīng)理可由技術(shù)轉(zhuǎn)移部門/公司代表擔(dān)任�,其可代表各自上層管理者之間的利益,對(duì)技術(shù)轉(zhuǎn)移項(xiàng)目進(jìn)度�����、完整度、轉(zhuǎn)移效果���、成本預(yù)算等項(xiàng)目進(jìn)行管理和監(jiān)控�。
執(zhí)行層
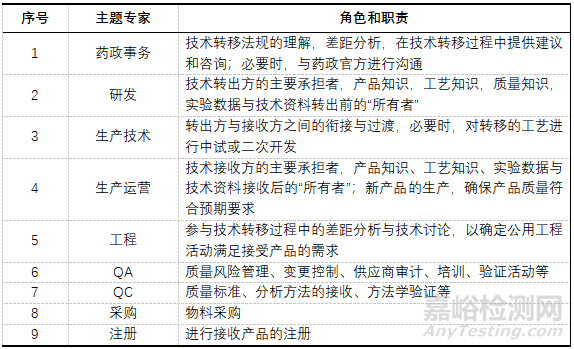
基于技術(shù)轉(zhuǎn)移活動(dòng)存在的復(fù)雜性�,技術(shù)轉(zhuǎn)移項(xiàng)目執(zhí)行組由技術(shù)轉(zhuǎn)移所必須的多學(xué)科主題專家(SME)組成,專家成員背景知識(shí)組成需包含待轉(zhuǎn)移的產(chǎn)品知識(shí)�、工藝知識(shí)、質(zhì)量知識(shí)及支持轉(zhuǎn)移所需的知識(shí)等���。需要注意的是�,轉(zhuǎn)出方和接收方團(tuán)隊(duì)中應(yīng)設(shè)定相應(yīng)負(fù)責(zé)人進(jìn)行協(xié)調(diào)�����。技術(shù)轉(zhuǎn)移項(xiàng)目專題專家的職責(zé)說明�����,見表6�����。
▲表6-技術(shù)轉(zhuǎn)移組專家及其職責(zé)
項(xiàng)目團(tuán)隊(duì)成員可以開發(fā)里程碑和項(xiàng)目進(jìn)度節(jié)點(diǎn),確定技術(shù)轉(zhuǎn)移產(chǎn)品合適的生產(chǎn)批次數(shù)與驗(yàn)收標(biāo)準(zhǔn)�、技術(shù)轉(zhuǎn)移文件方案并提供貫穿項(xiàng)目始終的知識(shí)轉(zhuǎn)移活動(dòng)。
4.2 實(shí)施過程
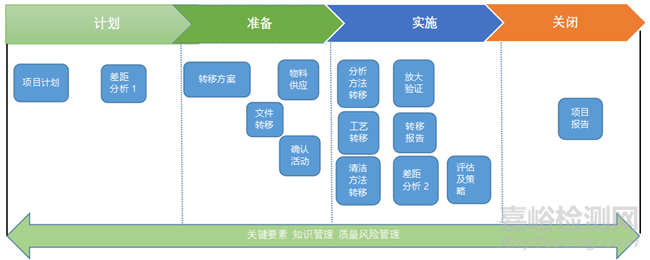
技術(shù)轉(zhuǎn)移方案結(jié)合WHO���、ISPE���、PDA技術(shù)轉(zhuǎn)移指南,將技術(shù)轉(zhuǎn)移活動(dòng)的具體實(shí)施可分四大階段:計(jì)劃�����、準(zhǔn)備���、實(shí)施�、關(guān)閉�����,每個(gè)階段應(yīng)開展的活動(dòng)如下所示�����,見圖3�����。
▲圖3-技術(shù)轉(zhuǎn)移實(shí)施流程
4.2.1項(xiàng)目計(jì)劃
項(xiàng)目計(jì)劃階段�����,由技術(shù)轉(zhuǎn)移小組編寫技術(shù)轉(zhuǎn)移項(xiàng)目計(jì)劃���,描述技術(shù)轉(zhuǎn)移的范圍���,制定目標(biāo)與可接受標(biāo)準(zhǔn),并明確各部門在技術(shù)轉(zhuǎn)移任務(wù)中的職責(zé)�、團(tuán)隊(duì)活動(dòng)、項(xiàng)目活動(dòng)的策略���、變更控制等內(nèi)容�����。
技術(shù)轉(zhuǎn)出方協(xié)助接收方對(duì)與項(xiàng)目相關(guān)的廠房設(shè)施���、設(shè)備能力、產(chǎn)能�����,人員知識(shí)水平、技能等現(xiàn)有資源與成功轉(zhuǎn)移所需資源及流程之間的差距分析/風(fēng)險(xiǎn)評(píng)估�����,明確接收方的差距/風(fēng)險(xiǎn)���。
4.2.2項(xiàng)目準(zhǔn)備
根據(jù)風(fēng)險(xiǎn)評(píng)估和差距分析結(jié)果確定總體轉(zhuǎn)移方案���。總體轉(zhuǎn)移方案應(yīng)由各子方案組成�,主要方案括設(shè)施與設(shè)備方案,產(chǎn)品工藝方案�����,清潔工藝方案�����,分析方法方案等�。
依據(jù)產(chǎn)品特性、注冊(cè)法規(guī)要求等編寫文件轉(zhuǎn)移方案目錄�����,接收方成員依據(jù)轉(zhuǎn)移文件方案目錄審核轉(zhuǎn)出方提交的轉(zhuǎn)移資料���,對(duì)文件內(nèi)容進(jìn)行初步核對(duì)�。
準(zhǔn)備階段還需要進(jìn)行物料的準(zhǔn)備活動(dòng)�,包括供應(yīng)商的審計(jì)、物料的采購等活動(dòng)�����。同時(shí)�,人員的培訓(xùn),設(shè)施設(shè)備的采購、改造�、確認(rèn)等活動(dòng)也需要在此階段進(jìn)行。
4.2.3項(xiàng)目實(shí)施
技術(shù)轉(zhuǎn)移實(shí)施階段按照前期建立的技術(shù)轉(zhuǎn)移方案進(jìn)行分析方法轉(zhuǎn)移�、生產(chǎn)工藝轉(zhuǎn)移以及清潔工藝轉(zhuǎn)移等活動(dòng)。需要注意的是���,分析方法轉(zhuǎn)移應(yīng)在工藝轉(zhuǎn)移之前�,這樣才能保證工藝的轉(zhuǎn)移過程中對(duì)產(chǎn)品進(jìn)行恰當(dāng)?shù)臋z測(cè)�����。
(1)分析方法轉(zhuǎn)移
分析方法包括原料、中間體���、成品�,以及清潔驗(yàn)證樣品中的檢驗(yàn)方法等���。由雙方分析方法轉(zhuǎn)移團(tuán)隊(duì)執(zhí)行轉(zhuǎn)移�。分析方法轉(zhuǎn)移的實(shí)施是按照基于雙方分析檢驗(yàn)方面的情況進(jìn)行的風(fēng)險(xiǎn)評(píng)估和差距分析所形成的分析方法技術(shù)轉(zhuǎn)移方案執(zhí)行���??梢愿鶕?jù)情況采取對(duì)比檢測(cè)�、兩個(gè)或多個(gè)實(shí)驗(yàn)室進(jìn)行聯(lián)合驗(yàn)證、再驗(yàn)證或部分驗(yàn)證等方式進(jìn)行轉(zhuǎn)移���。
(2)工藝轉(zhuǎn)移
工藝轉(zhuǎn)移可以根據(jù)物料�����、工藝�、設(shè)備條件等具體情況分析���,開展預(yù)中試研究(若適用)�����、中試研究(若適用)���、試產(chǎn)研究(若適用)等,工藝驗(yàn)證是產(chǎn)品生命周期及技術(shù)轉(zhuǎn)移的重要節(jié)點(diǎn)�,故工藝驗(yàn)證批次必須成功實(shí)施才能確認(rèn)工藝的有效轉(zhuǎn)移。關(guān)于工藝驗(yàn)證有以下幾點(diǎn)需重點(diǎn)關(guān)注�����。
①工藝驗(yàn)證將確認(rèn)的原輔料�、已確認(rèn)的設(shè)備、設(shè)施�、公用系統(tǒng)、經(jīng)培訓(xùn)的人員�����、生產(chǎn)工藝�����、控制程序等各種因素組合在一起���,證明其能講行重復(fù)性的商業(yè)化生產(chǎn)�;
②實(shí)施工藝驗(yàn)證必須遵循商業(yè)化生產(chǎn)的工藝與常規(guī)程序,即原輔料�����、生產(chǎn)環(huán)境�����、生產(chǎn)介質(zhì)�、人員和生產(chǎn)步驟等均應(yīng)與預(yù)期日常生產(chǎn)時(shí)的操作相同;
③方案需包括生產(chǎn)條件�����、可接受標(biāo)準(zhǔn)等內(nèi)容�,還應(yīng)包括對(duì)偏差的處理方法和對(duì)不符合數(shù)據(jù)處理的規(guī)定;
④工藝驗(yàn)證至少連續(xù)生產(chǎn)三批成功�,需驗(yàn)證工藝參數(shù)范圍和質(zhì)量數(shù)據(jù)無明顯波動(dòng),產(chǎn)品的質(zhì)量指標(biāo)合格以及制定的質(zhì)量標(biāo)準(zhǔn)合理等���。此外�����,還需評(píng)價(jià)任何預(yù)期之外的觀察結(jié)果以及方案中沒有規(guī)定的額外數(shù)據(jù)�,討論總結(jié)不符合項(xiàng)以及其他相關(guān)信息。
(3)清潔工藝轉(zhuǎn)移
清潔工藝轉(zhuǎn)移一般由工藝技術(shù)轉(zhuǎn)移團(tuán)隊(duì)執(zhí)行�。接收方根據(jù)轉(zhuǎn)出方提供的清潔資料,評(píng)估預(yù)期使用的清潔材料和清潔劑的適用性�,有以下可能情況:
①清潔方法適用,生產(chǎn)部組織起草清潔操作規(guī)程并對(duì)其驗(yàn)證���;
②清潔方法不適用,工藝技術(shù)轉(zhuǎn)移小組結(jié)合企業(yè)產(chǎn)品�����、新產(chǎn)品特性等與轉(zhuǎn)出方進(jìn)行清潔方法開發(fā)�,共同重新確定清潔方法,同時(shí)進(jìn)行清潔驗(yàn)證風(fēng)險(xiǎn)評(píng)估���、起草驗(yàn)證方案并實(shí)施驗(yàn)證���。
清潔驗(yàn)證可與工藝驗(yàn)證同步進(jìn)行。之后進(jìn)行產(chǎn)品穩(wěn)定性考察���,完成驗(yàn)證報(bào)告���、技術(shù)轉(zhuǎn)移報(bào)告�。
4.2.4項(xiàng)目關(guān)閉
項(xiàng)目的最后階段�,需要總結(jié)項(xiàng)目的整體工藝概況、中控與產(chǎn)品放行及特征數(shù)據(jù)�����、設(shè)備列表�、關(guān)鍵/主要偏差、取得的經(jīng)驗(yàn)教訓(xùn)���、技術(shù)轉(zhuǎn)移指標(biāo)�、所有成果�����、持續(xù)監(jiān)控轉(zhuǎn)移技術(shù)的工藝確認(rèn)計(jì)劃���。
五���、結(jié)束語
成功的技術(shù)轉(zhuǎn)移活動(dòng)必須在法規(guī)指南指導(dǎo)下。首先,根據(jù)項(xiàng)目特點(diǎn)和實(shí)際情況制定項(xiàng)目轉(zhuǎn)移規(guī)劃�����,建立切實(shí)可行的時(shí)間線���,這是確保技術(shù)轉(zhuǎn)移過程能夠高效率�����、低成本和符合法規(guī)要求的前提�。其次�����,知識(shí)管理的理念也是實(shí)現(xiàn)成功技術(shù)轉(zhuǎn)移的關(guān)鍵要素�,在技術(shù)轉(zhuǎn)移項(xiàng)目過程中�,有大量的多學(xué)科信息被收集、分析和描述�,應(yīng)該基于團(tuán)隊(duì)和項(xiàng)目情況,設(shè)計(jì)系統(tǒng)的方式實(shí)現(xiàn)轉(zhuǎn)出方和接收方間信息的取得�、儲(chǔ)存、分析���、傳播和轉(zhuǎn)移等���,以確保技術(shù)在轉(zhuǎn)移過程中不會(huì)喪失或損害�,同時(shí)能夠保持工藝的可重復(fù)性和產(chǎn)品質(zhì)量的一致性�。最后,質(zhì)量風(fēng)險(xiǎn)管理也必須貫穿技術(shù)轉(zhuǎn)移的始終�����。通過對(duì)潛在的質(zhì)量問題和風(fēng)險(xiǎn)進(jìn)行評(píng)估和控制���,可以確保技術(shù)轉(zhuǎn)移過程中的每個(gè)環(huán)節(jié)都符合質(zhì)量標(biāo)準(zhǔn)和法規(guī)要求�����,以保證技術(shù)轉(zhuǎn)移項(xiàng)目的成功實(shí)施�。
參考文獻(xiàn)
[1]ICH Q10., Expert Working Group. ICH Q10: Pharmaceutical Quality System [EB/OL]. (2008).https://www.ich.org/page/quality-guidelines.
[2]ICH.,Q9 Expert Working Group. ICH Q9(R1):Quality Risk Management[EB /OL].(2023). https://www.ich.org/page/quality-guidelines.
[3]PDA., Technical reports[EB/OL]. (2018) . https://www. pda.org.
[4]國家食品藥品監(jiān)督管理總局.藥品生產(chǎn)質(zhì)量管理規(guī)范 (2010年修訂) (衛(wèi)生部令第79號(hào)) [EB/OL]. (2011). http:/www.nmpa.gov.cn/WS04CL2174/300569.html.
[5]ISPE. Good Practice Cuide: Tecnalogy Transter 3rd Edition[EB/OL]. (2018). Good Practice Guide: Technology Transfer 3rd Edition.
[6]WHO.WHO Tecnical Repont Series, No.961, Appendix 7[EB/OL].(2011). https://apps.who.int/iris/bitstream/handle/10665/44079/WHO_TRS_961_eng.pdf;jsessionid=67589FDF6ECD8F0CF48C9776257775C5?sequence=1.
[7]WHO. WHO guidelines on the transfer of technology in pharmaceutieal manufaeturing.Working doeument QAS/20.860/Revl[EB/OL].(2021). https://cdn.who.int/media/docs/default-source/essential-medicines/norms-and-standards/qas20-869-transfer-of-technology.pdf?sfvrsn=2a4723bc_5.
[8]USP.(1224) Transfer of Analytieal Procedures [EB/OL].(2013). https://www.ropack.com/wp-content/uploads/c1224.pdf.
[9]國家藥典委員會(huì).中華人民共和國藥典[S].四部. 北京:中國醫(yī)藥科技出版社���,2020.