內(nèi)源性藥物簡(jiǎn)介:源性物質(zhì)是機(jī)體內(nèi)天然存在的物質(zhì)�����,是代謝中產(chǎn)生的活性物質(zhì)及最終產(chǎn)物����,包括維生素、激素����、蛋白質(zhì)及電解質(zhì)類等[1]。這類藥物藥理作用強(qiáng)����,副作用小,很少引起過(guò)敏反應(yīng)����,因此從研究?jī)?nèi)源性物質(zhì)著手尋求治療疾病的藥物成為新藥研發(fā)的最重要的途徑之一�����,大量?jī)?nèi)源性藥物應(yīng)運(yùn)而生����。
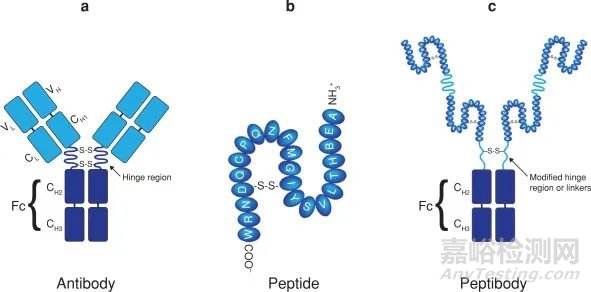
由于內(nèi)源性藥物是體內(nèi)為維持生命所產(chǎn)生的生物物質(zhì)��,具有代謝反應(yīng)半衰期較短��、穩(wěn)定性差缺點(diǎn)�����,對(duì)pH值����、金屬離子、溫度等環(huán)境因素較為敏感�����。為增強(qiáng)藥物的穩(wěn)定性和半衰期�����,小分子藥物一般使用化學(xué)修飾的方式;大分子藥物則采用化學(xué)修飾和與大蛋白融合等方式�����。最常見的技術(shù)是Fc融合蛋白�����、血清白蛋白融合蛋白和轉(zhuǎn)鐵蛋白融合蛋白[2] [3]����。其中����,F(xiàn)c融合蛋白是指通過(guò)基因工程技術(shù)將功能蛋白與抗體的Fc片段融合而成(圖1)。這種融合策略不僅保留了功能蛋白的生物活性��,而且延長(zhǎng)了半衰期����,提高了穩(wěn)定性,有利于融合蛋白的表達(dá)��、純化和檢測(cè)[4]����。
圖1. FC 融合蛋白結(jié)構(gòu)[4]
已上市的內(nèi)源性藥物:目前比較熱門的重組蛋白中的功能片段有如下幾類[5]:
1.多肽類激素如:胰島素及胰島素類似物����、生長(zhǎng)激素��、促卵泡成熟激素等����;
2.細(xì)胞因子主要有: 白細(xì)胞介素(Interleukin,IL)�����、干擾素(interferon��,IFN)����、腫瘤壞死因子(tumor necrosis factor,TNF)��、集落刺激因子(colony stimulating factor�����,CSF)、生長(zhǎng)因子(growth factor�����,GF)����、趨化性細(xì)胞因子(chemokine);
3.酶如:尿激酶原��。
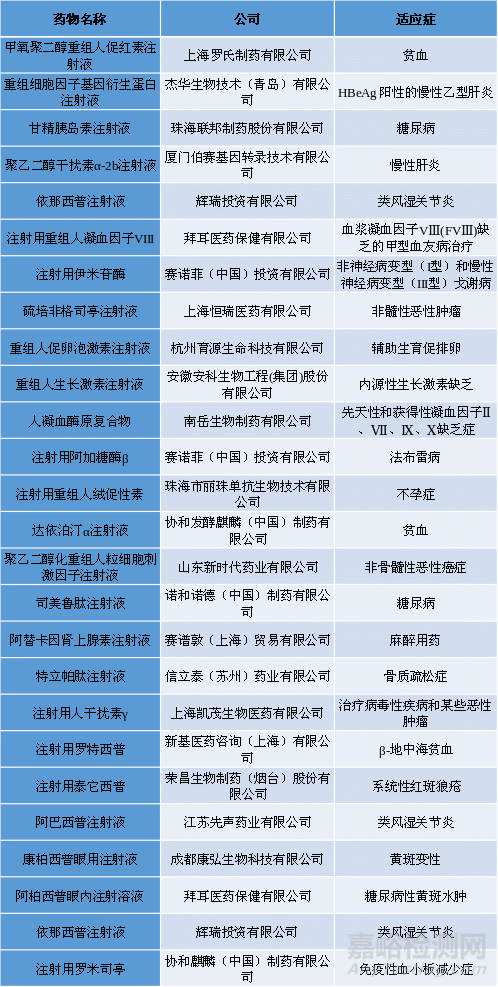
表一總結(jié)了目前已上市的內(nèi)源性藥物[6]����。
表1.已上市的內(nèi)源性藥物[6]
內(nèi)源性藥物生物分析難點(diǎn):內(nèi)源性藥物的生物分析主要包括PK藥代動(dòng)力學(xué)�����、ADA抗藥抗體以及Nab中和抗體分析����。分析所用到的方法主要包括LC-MS/MS和LBA配體受體結(jié)合試驗(yàn)。在內(nèi)源性藥物的分析方法建立中����,正是由于內(nèi)源性藥物區(qū)別于外源性藥物的特征����,造成了其生物分析的挑戰(zhàn)和難點(diǎn)��,主要表現(xiàn)在以下幾方面:
1.如何消除內(nèi)源物對(duì)檢測(cè)的干擾
在傳統(tǒng)生物分析過(guò)程中��,用于制備校準(zhǔn)標(biāo)準(zhǔn)品的基質(zhì)應(yīng)盡可能與含有分析物的研究樣品相似����。然而,在定量生物樣品中的內(nèi)源性物質(zhì)時(shí)��,空白基質(zhì)還包含影響分析水平的分析物��。同時(shí)�����,由于多肽的內(nèi)源性對(duì)應(yīng)物在體內(nèi)是動(dòng)態(tài)變化的��,因此如何消除內(nèi)源性對(duì)檢測(cè)的干擾是需要考慮的��。
2.空白基質(zhì)的獲取
由于內(nèi)源性藥物是機(jī)體內(nèi)天然存在的物質(zhì)��,人的實(shí)際基質(zhì)中也含有內(nèi)源性物質(zhì),因此����,在檢測(cè)過(guò)程中,如何排除干擾取得真正不含待測(cè)物的生物基質(zhì)制備標(biāo)準(zhǔn)曲線是進(jìn)行PK藥代動(dòng)力學(xué)的重要挑戰(zhàn)��。
3.穩(wěn)定性的影響
由于機(jī)體自身穩(wěn)定性機(jī)制����,內(nèi)源性藥物的穩(wěn)定性問(wèn)題是在生物分析方法開發(fā)中常見的問(wèn)題,尤其是一些缺乏修飾基團(tuán)或多肽兩端缺乏保護(hù)性基團(tuán)的多肽類分子����。對(duì)pH值、金屬離子����、溫度等環(huán)境因素較為敏感����,甚至降解或產(chǎn)生構(gòu)象變化為生物分析方法的穩(wěn)定性研究帶來(lái)挑戰(zhàn)。
4.多結(jié)構(gòu)域治療性的免疫原性分析較為復(fù)雜
對(duì)于大分子藥物��,為增強(qiáng)內(nèi)源性藥物的穩(wěn)定性和半衰期�����,通常將內(nèi)源性分子與大蛋白融合。融合引入新的抗原表位����,對(duì)確證為陽(yáng)性的樣本免疫原性分析需要開展結(jié)構(gòu)域特異性評(píng)價(jià)。
2����、內(nèi)源性藥物指導(dǎo)原則比較和解讀
PK藥代動(dòng)力學(xué)指導(dǎo)原則
2018年FDA Guidance (Bioanalytical Method Validation Guidance for Industry)第5節(jié)第1部分描述了內(nèi)源性物質(zhì)的生物分析[7]。指導(dǎo)原則指出“對(duì)于內(nèi)源性分析物����,當(dāng)分析不能區(qū)分治療劑和內(nèi)源性對(duì)應(yīng)物時(shí),分析物測(cè)量的準(zhǔn)確性提出了挑戰(zhàn)����。在這種情況下,建議采用以下方法來(lái)驗(yàn)證和監(jiān)測(cè)分析性能��。如果有科學(xué)原理的支持����,也可以考慮其他方法。1)用于制備校準(zhǔn)標(biāo)準(zhǔn)品的生物基質(zhì)應(yīng)與研究樣品相同�����,且不含內(nèi)源性分析物。應(yīng)證明基質(zhì)具有:a)無(wú)可測(cè)量的內(nèi)源性分析物或b)與生物基質(zhì)相比�����,無(wú)基質(zhì)效應(yīng)或干擾�����。使用替代基質(zhì)(如緩沖液��、透析血清)制備校準(zhǔn)標(biāo)準(zhǔn)品也是合理的����。QC樣品的制備方法是在與研究樣品相同的生物基質(zhì)中加入已知數(shù)量的分析物。應(yīng)在QC制備前評(píng)估生物基質(zhì)中分析物的內(nèi)源性濃度(例如�����,通過(guò)重復(fù)分析)��。QC的濃度應(yīng)考慮生物基質(zhì)(即添加劑)中的內(nèi)源性濃度��。2)內(nèi)源化合物的生物分析應(yīng)評(píng)估其平行性����。”
雖然FDA明確建議了關(guān)于內(nèi)源性藥物方法驗(yàn)證的建議,但卻未對(duì)準(zhǔn)確度與精密度如何計(jì)算����、選擇性以及平行性如何評(píng)估等具體的細(xì)節(jié)做出相關(guān)決定。2022年5月24日新生效的ICHM10(Bioanalytical method validation and study sample analysis)第7.1部分著重強(qiáng)調(diào)了待測(cè)物同為內(nèi)源性物質(zhì)的分析方法[8]�����,包括7.1.1質(zhì)控樣品�����,7.1.2選擇性��、回收率與基質(zhì)效應(yīng)����,7.1.3平行性,7.1.4準(zhǔn)確度與精密度以及7.1.5穩(wěn)定性的分析方法����。下面將對(duì)相關(guān)章節(jié)進(jìn)行詳細(xì)的解讀。
研究樣品中待測(cè)物濃度計(jì)算方法:ICH M10中提供了4種計(jì)算研究樣品中待測(cè)物濃度方法(圖2):替代基質(zhì)法����、替代待測(cè)物法��、背景扣除法和標(biāo)準(zhǔn)添加法�����。
1�����、替代基質(zhì)法是使用簡(jiǎn)單緩沖液或人工基質(zhì)等�����,代替存在干擾的基質(zhì)來(lái)配制標(biāo)準(zhǔn)曲線��。該方法經(jīng)濟(jì)實(shí)用��,獲取方式相對(duì)簡(jiǎn)單��,是配體結(jié)合實(shí)驗(yàn)中較為常用的方法��。
2��、替代待測(cè)物法是采用穩(wěn)定同位素標(biāo)記的待測(cè)物作為替代分析物�����,常用于色譜法中����。該方法的優(yōu)勢(shì)在于可以采用與生物樣本相同的真實(shí)基質(zhì)�����。
3�����、背景扣除法同樣也可以采用真實(shí)基質(zhì)����,該方法是在真實(shí)基質(zhì)中添加待測(cè)物,用測(cè)得的濃度減去在基質(zhì)中測(cè)得的內(nèi)源性物質(zhì)濃度��,使用凈差值來(lái)建立標(biāo)準(zhǔn)曲線����。
4、標(biāo)準(zhǔn)添加法僅適用于具有線性響應(yīng)的分析平臺(tái)。
圖2.四種計(jì)算研究樣品中待測(cè)物濃度方法[8]
質(zhì)控樣品的配制:在制備QC樣品之前��,應(yīng)評(píng)估生物基質(zhì)中內(nèi)源性物質(zhì)濃度����。對(duì)于QC樣品的配制,通常LQC和LLOQ會(huì)使用未添加待測(cè)物的基質(zhì)��,ULOQ��、HQC和MQC則是通過(guò)向基質(zhì)(LQC或LLOQ)中添加已知濃度的待測(cè)物來(lái)制備����。添加樣品(LQC或LLOQ)中待測(cè)物添加量應(yīng)足以提供比內(nèi)源性物質(zhì)濃度高三倍以上,或統(tǒng)計(jì)學(xué)上足以顯示比內(nèi)源性濃度更高�����。若基質(zhì)中的內(nèi)源性水平較高��,無(wú)法用于制備LQC��,則考慮使用稀釋基質(zhì)或替代基質(zhì)�����。
選擇性、回收率與基質(zhì)效應(yīng)評(píng)估:對(duì)于選擇性��、回收率與基質(zhì)效應(yīng)評(píng)估�����,ICH M10詳細(xì)描述了替代基質(zhì)����、替代待測(cè)物�����、實(shí)際生物基質(zhì)的選擇性如何評(píng)估��。1)如果方法使用了替代基質(zhì)法�����,應(yīng)評(píng)估替代基質(zhì)和實(shí)際基質(zhì)中不同基質(zhì)效應(yīng)和回收率的影響��。應(yīng)在同一項(xiàng)實(shí)驗(yàn)中��,采用基質(zhì)中加入待測(cè)物��、僅內(nèi)源性基質(zhì)以及替代基質(zhì)中加入待測(cè)物得到的QC樣品,用替代校準(zhǔn)曲線進(jìn)行分析����。2)如果在質(zhì)譜色譜法中使用替代待測(cè)物方法,應(yīng)評(píng)估替代待測(cè)物和實(shí)際內(nèi)源性物質(zhì)之間不同基質(zhì)效應(yīng)和回收率的影響�����。應(yīng)在同一項(xiàng)實(shí)驗(yàn)中��,采用基質(zhì)中加入待測(cè)物����、僅內(nèi)源性基質(zhì)以及替代物加入基質(zhì)中得到的QC樣品,用替代基質(zhì)校準(zhǔn)曲線進(jìn)行分析����。3)在某些情況下,當(dāng)內(nèi)源性物質(zhì)水平較高且LLOQ需要降低時(shí)��,可能需要使用替代基質(zhì)稀釋QC樣品(例如背景扣除法)��。此時(shí)����,應(yīng)使用內(nèi)源性物質(zhì)濃度在LLOQ和LQC之間的實(shí)際生物基質(zhì)(如果可用)����,重復(fù)進(jìn)行回收率和基質(zhì)效應(yīng)實(shí)驗(yàn)����。4)由于生物基質(zhì)的成分可能會(huì)影響方法性能,因此要對(duì)至少6種(色譜法)/10種(LBA法)的實(shí)際生物基質(zhì)的選擇性進(jìn)行評(píng)估�����。
平行性:對(duì)于平行性評(píng)估����,應(yīng)在替代基質(zhì)和替代待測(cè)物方法中對(duì)平行性進(jìn)行評(píng)估��,并考慮LBA法和色譜法中對(duì)平行性的評(píng)估不同�����。
準(zhǔn)確度和精密度:如果使用替代基質(zhì)或替代待測(cè)物方法�����,應(yīng)根據(jù)替代校準(zhǔn)曲線分析QC樣品來(lái)評(píng)估準(zhǔn)確度和精密度��。比較重要的一點(diǎn)是,ICH M10明確指出了內(nèi)源性藥物的準(zhǔn)確度的計(jì)算公式����。當(dāng)QC樣品由含有內(nèi)源性水平的待測(cè)物的基質(zhì)中加入真實(shí)待測(cè)物制備時(shí),建議使用以下公式計(jì)算準(zhǔn)確度:
穩(wěn)定性:為了盡可能模擬研究樣品��,應(yīng)對(duì)2.1.2章節(jié)描述的HQC和LQC的穩(wěn)定性進(jìn)行評(píng)估�����。如果替代基質(zhì)用于配制標(biāo)準(zhǔn)曲線��,還應(yīng)評(píng)估替代基質(zhì)中待測(cè)物的穩(wěn)定性�����。
ADA抗藥抗體指導(dǎo)原則
對(duì)于ADA抗藥抗體的檢測(cè)����,2019年美國(guó)FDA發(fā)表的“Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection”[9]和2021年國(guó)家藥品監(jiān)督管理局發(fā)布的《藥物免疫原性研究技術(shù)指導(dǎo)原則》[10]均明確指出“對(duì)于多結(jié)構(gòu)域治療性蛋白藥物,如聚乙二醇化蛋白�����、多特異性抗體�����,建議針對(duì)整個(gè)治療性蛋白藥物進(jìn)行初步篩選試驗(yàn)和確證試驗(yàn),基于風(fēng)險(xiǎn)或產(chǎn)品特征��,對(duì)確證為陽(yáng)性的樣本進(jìn)一步開展域特異性評(píng)價(jià)�����。”
Nab 中和抗體分析指導(dǎo)原則
對(duì)于Nab中和抗體的檢測(cè)�����,其指導(dǎo)原則與常規(guī)的大分子的指導(dǎo)原則類似����,有基于細(xì)胞的中和抗體檢測(cè)方法和非基于細(xì)胞的中和抗體檢測(cè)方法�����,可以根據(jù)具體的大分子藥物的作用機(jī)制��、選擇性�����、靈敏度、精度和穩(wěn)健性等選擇分析方法�����。一般來(lái)說(shuō)����,F(xiàn)DA建議使用基于細(xì)胞的生物測(cè)定法進(jìn)行中和試驗(yàn)[10]。
參考文獻(xiàn):
[1] Zhu Q, Huang Z, Huang Y, Qin Y. [Expression of rhEPO-L-Fc fusion protein and analysis of its bioactivity and pharmacokinetics]. Sheng Wu Gong Cheng Xue Bao. 2008 Nov;24(11):1874-9. Chinese.
[2] Kontermann RE. Half-life extended biotherapeutics. Expert Opin Biol Ther. 2016 Jul;16(7):903-15. doi: 10.1517/14712598.2016.1165661. Epub 2016 Apr 18. Erratum in: Expert Opin Biol Ther. 2016 Sep;16(9):1179.
[3] Steiner D, Merz FW, Sonderegger I, Gulotti-Georgieva M, Villemagne D, Phillips DJ, Forrer P, Stumpp MT, Zitt C, Binz HK. Half-life extension using serum albumin-binding DARPin® domains. Protein Eng Des Sel. 2017 Sep 1;30(9):583-591.
[4] Pei D, Hu J, Rao C, Yu P, Xu H, Wang J. Anti-Tumor Activity and Pharmacokinetics of AP25-Fc Fusion Protein. Int J Med Sci. 2019 Jun 10;16(7):1032-1041.
[5] An G, Ohls RK, Christensen RD, Widness JA, Mock DM, Veng-Pedersen P. Population Pharmacokinetics of Darbepoetin in Infants Following Single Intravenous and Subcutaneous Dosing. J Pharm Sci. 2017 Jun;106(6):1644-1649.
[6]來(lái)源:國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心��。部分同類或BE藥物不予展示�����。
[7]US FDA Guidance for Industry, Bioanalytical Method Validation, May 2018.
[8] ICHM10 Guideline, Bioanalytical method validation and study sample analysis, 24 May 2022.
[9] US FDA Guidance for Industry, Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection, 24 May 2022.
[10]國(guó)家藥品監(jiān)督管理局,藥物免疫原性研究技術(shù)指導(dǎo)原則, 2021.