近日CDE發(fā)布了《藥品注冊(cè)研發(fā)生產(chǎn)主體合規(guī)信息管理與審查指導(dǎo)原則(試行)征求意見(jiàn)稿》����,在該文件中提出了要建立研發(fā)生產(chǎn)主體合規(guī)管理信息庫(kù)的相關(guān)意見(jiàn)。
什么是注冊(cè)研發(fā)生產(chǎn)主體合規(guī)信息����?
主體合規(guī)信息似乎是以往很少提及的概念,但其實(shí)在2021年發(fā)布的藥品注冊(cè)核查檢驗(yàn)啟動(dòng)工作程序(試行)中就已經(jīng)有規(guī)定“啟動(dòng)藥品注冊(cè)核查考慮的風(fēng)險(xiǎn)因素包括品種因素和研發(fā)生產(chǎn)主體合規(guī)因素����。其中����,品種因素包括藥物創(chuàng)新程度����、藥品類型、工藝和設(shè)施等����,研發(fā)生產(chǎn)主體合規(guī)因素包括參與藥學(xué)研制、臨床試驗(yàn)����、藥理毒理學(xué)研究以及生產(chǎn)制造的相關(guān)單位和機(jī)構(gòu)既往接受核查的情況等。”而合規(guī)因素的體現(xiàn)即本文件的主題“藥品注冊(cè)研發(fā)生產(chǎn)主體合規(guī)信息”����。
意見(jiàn)稿中,合規(guī)信息是指能夠直接或間接反映其在擬注冊(cè)品種的研制過(guò)程中合規(guī)性的信息����。包括但不限于:
(1)研發(fā)生產(chǎn)主體的基本信息和資質(zhì)證明信息;
(2)在擬注冊(cè)品種研制過(guò)程中承擔(dān)的主要職責(zé)����;
(3)接受國(guó)內(nèi)外藥品監(jiān)管機(jī)構(gòu)注冊(cè)核查和監(jiān)督檢查的情況����;
(4)對(duì)注冊(cè)核查����、監(jiān)督檢查發(fā)現(xiàn)問(wèn)題的整改情況;
(5)研發(fā)生產(chǎn)主體的質(zhì)量管理體系建設(shè)運(yùn)行情況等����。
從以上定義看����,合規(guī)信息集中在研發(fā)生產(chǎn)主體既往提交的資料中與主體有關(guān)的信息以及既往接受核查、檢查的情況����,包括企業(yè)內(nèi)的質(zhì)量和注冊(cè)部門(mén)所保存的歷次官方檢查(審計(jì))的資料信息。
須注意的是研發(fā)生產(chǎn)主體并不限于注冊(cè)申請(qǐng)人企業(yè)自己的檢查信息����,還包括和產(chǎn)品有關(guān)的其他合作單位的檢查信息,即不單是GMP����,還有GCP等檢查����。
合規(guī)信息有什么價(jià)值����?
根據(jù)征求意見(jiàn)稿,CDE要“建立健全研發(fā)生產(chǎn)主體合規(guī)信息管理體系����,以滿足基于風(fēng)險(xiǎn)的核查啟動(dòng)工作需要。”因此合規(guī)信息的最直接價(jià)值是為CDE對(duì)申請(qǐng)人的風(fēng)險(xiǎn)評(píng)估提供切實(shí)全面的依據(jù)����。
現(xiàn)在CDE實(shí)行基于風(fēng)險(xiǎn)啟動(dòng)藥品注冊(cè)核查的制度模式,即基于風(fēng)險(xiǎn)決定是否啟動(dòng)藥品注冊(cè)研制現(xiàn)場(chǎng)核查和生產(chǎn)現(xiàn)場(chǎng)核查����。而對(duì)于申請(qǐng)人企業(yè)的風(fēng)險(xiǎn)究竟如何衡量和評(píng)估則是未有過(guò)很明確的指導(dǎo)的。
可供參照的是FDA用一種被稱為場(chǎng)地選擇模型(SSM)的風(fēng)險(xiǎn)評(píng)估工具來(lái)收集合規(guī)信息����,以確定對(duì)生產(chǎn)場(chǎng)地的GMP檢查的優(yōu)先順序。FDA要收集生產(chǎn)場(chǎng)地的以下信息:場(chǎng)地類型(例如生產(chǎn)商or僅包裝商or僅質(zhì)控實(shí)驗(yàn)室)����、自上次監(jiān)督檢查以來(lái)的時(shí)間����、FDA合規(guī)歷史����、國(guó)家或地區(qū)的合規(guī)歷史、外國(guó)監(jiān)管機(jī)構(gòu)的檢查歷史����、患者暴露、危害信號(hào)(例如現(xiàn)場(chǎng)警示報(bào)告����、生物制品偏差報(bào)告,MedWatch報(bào)告����、召回等)����、固有產(chǎn)品風(fēng)險(xiǎn)(例如劑型、無(wú)菌制劑等)����?���;谑占降臄?shù)據(jù)����,使用SSM為生產(chǎn)場(chǎng)地生成風(fēng)險(xiǎn)評(píng)分,進(jìn)而確定生產(chǎn)場(chǎng)地檢查的優(yōu)先級(jí)����。詳細(xì)信息可閱讀 MAPP 5014.1 Rev.1 Understanding CDER's Risk-Based Site Selection Model 而現(xiàn)在CDE要建立的研發(fā)生產(chǎn)主體合規(guī)信息管理也是這樣一種風(fēng)險(xiǎn)評(píng)估工具,但是覆蓋面更廣����。
對(duì)藥企后續(xù)工作的影響
在知曉了監(jiān)管機(jī)構(gòu)對(duì)于啟動(dòng)藥品注冊(cè)核查的風(fēng)險(xiǎn)關(guān)注點(diǎn)后,申請(qǐng)人企業(yè)也就有了標(biāo)尺去評(píng)估自己的合規(guī)現(xiàn)狀����。但是對(duì)企業(yè)來(lái)說(shuō), 更重要的在于如何主動(dòng)去做好自身的合規(guī)管理����。
征求意見(jiàn)稿倡導(dǎo)“研發(fā)生產(chǎn)主體建立自身合規(guī)信息庫(kù),合規(guī)信息庫(kù)應(yīng)包含研制活動(dòng)合規(guī)風(fēng)險(xiǎn)的評(píng)估情況����,并根據(jù)后續(xù)發(fā)現(xiàn)合規(guī)問(wèn)題的情況對(duì)風(fēng)險(xiǎn)數(shù)據(jù)進(jìn)行更新����。”這是一項(xiàng)很有價(jià)值的建議����,源于在現(xiàn)實(shí)中可能會(huì)存在的兩種情形
(1)對(duì)于多數(shù)企業(yè)來(lái)說(shuō),過(guò)往肯定是有保存著這些檢查信息����。但由于在面臨監(jiān)管機(jī)構(gòu)檢查以及完成后續(xù)整改行動(dòng)時(shí)會(huì)有兩個(gè)部門(mén)同時(shí)牽涉其中:即質(zhì)量部門(mén)和注冊(cè)部門(mén)。而這樣就可能會(huì)出現(xiàn)同一次檢查的所有信息被保存在兩個(gè)部門(mén)且互相不知情����。但如果企業(yè)內(nèi)能建立一個(gè)統(tǒng)一的數(shù)據(jù)庫(kù)就可以避免這種情況,做到全部合規(guī)信息的統(tǒng)一保存和管理����。
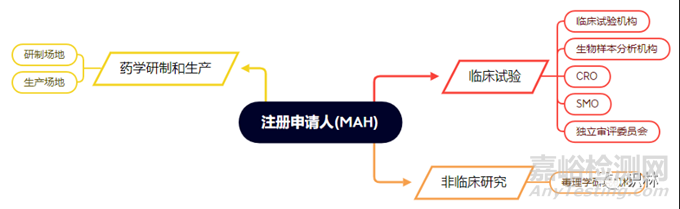
(2)申請(qǐng)人企業(yè)對(duì)于自己的合規(guī)信息可以做到充分收集和保存,但對(duì)產(chǎn)品從研發(fā)走到臨床結(jié)束的其他相關(guān)方的信息就會(huì)缺失����。在本文件中是分別介紹了藥學(xué)研制與生產(chǎn)����、藥物臨床試驗(yàn)����、藥理毒理學(xué)研究三大部分的合規(guī)信息內(nèi)容要求的����。因此,與一個(gè)要注冊(cè)申請(qǐng)的藥品有關(guān)的主體不止申請(qǐng)人企業(yè)一家����,至少就有下圖所示的多個(gè)不同角色
如果申請(qǐng)人企業(yè)內(nèi)部也能有一個(gè)數(shù)據(jù)庫(kù)系統(tǒng),將已有的相關(guān)方的合規(guī)信息錄入管理����,也能起到更好的風(fēng)險(xiǎn)控制效果。不但能減少正在進(jìn)行注冊(cè)產(chǎn)品的不合規(guī)風(fēng)險(xiǎn)����,也能為后續(xù)開(kāi)展項(xiàng)目時(shí)選擇合作的相關(guān)方提供更可靠的信息。
從企業(yè)實(shí)施角度的一些思考
1. 信息庫(kù)建成后����,與本企業(yè)產(chǎn)品有關(guān)的外部單位(比如臨床試驗(yàn)機(jī)構(gòu)、委托生產(chǎn)場(chǎng)地)的信息如何保持更新還未被提到。是CDE通過(guò)其他數(shù)據(jù)庫(kù)獲取還是外部單位自行去更新登記����,還是作為藥品責(zé)任主體的申請(qǐng)人企業(yè)進(jìn)行外部單位信息的更新?如果不同企業(yè)提交了同一家外部單位的信息����,但是這些信息不一致時(shí)該怎么辦?
2. 征求意見(jiàn)稿要求的合規(guī)信息的提交是在涉及注冊(cè)核查的注冊(cè)申請(qǐng)時(shí)����。這些信息未來(lái)是否也會(huì)作為其他監(jiān)管行動(dòng)比如臨床試驗(yàn)申請(qǐng)、新藥上市申請(qǐng)時(shí)的基礎(chǔ)信息用以支撐申報(bào)����?
3. 在藥品上市后企業(yè)是否還要繼續(xù)填報(bào)更新信息?合規(guī)信息如果一直在更新����,是否可以擴(kuò)展到影響GMP符合性檢查等的風(fēng)險(xiǎn)評(píng)估?
4. 合規(guī)信息庫(kù)中CRO等單位的合規(guī)信息是否會(huì)具有類似SMF(場(chǎng)地主文件)的作用����?在信息庫(kù)中已登記的企業(yè)或機(jī)構(gòu)的合規(guī)信息能否被有限度的查詢到,以供申請(qǐng)人企業(yè)在選擇非臨床研究����、臨床試驗(yàn)的合作單位時(shí)參考?
5. 同一企業(yè)在信息庫(kù)中作為研制場(chǎng)地和生產(chǎn)場(chǎng)地的合規(guī)信息是否會(huì)分開(kāi)登記����,還是只以唯一的企業(yè)主體登記?例如某企業(yè)過(guò)去作為生產(chǎn)場(chǎng)地存在不合規(guī)信息����,未來(lái)只作為研制場(chǎng)地時(shí)會(huì)不會(huì)還將關(guān)聯(lián)到此信息而影響注冊(cè)核查的風(fēng)險(xiǎn)評(píng)判?
6. 如果不同企業(yè)提交了同一家公司的信息����,但是這些信息不一樣該怎么辦?會(huì)導(dǎo)致什么樣的結(jié)果����?