藥物開發(fā)和生產(chǎn)的各個階段的根基是分析方法����。分析方法需要開發(fā)、驗證和控制���,就像所有其他產(chǎn)品和過程開發(fā)活動一樣����。原料藥特性�、影響API性質的因素和關鍵雜質的檢測是藥品研發(fā)有效性和安全性的核心。
從藥品研發(fā)歷史上看,含量對產(chǎn)品質量�、放行檢測和產(chǎn)品控制的關注嚴重不足����。用于測定精密度的變異系數(shù)(Coefficient ofVariation, CV)計算是必要的,但不足以衡量測定方法的可靠性���,并且可能因為CV與產(chǎn)品驗收和放行檢測限度沒有關系而具有誤導性。
分析和測定系統(tǒng)必須看作是一個過程。檢測過程由方法�、軟件、試劑�、分析人員���、樣品制備�、環(huán)境條件和儀器/設備組成���。質量風險管理和統(tǒng)計數(shù)據(jù)分析技術應用于整個實驗過程����,并識別可能影響精密度、準確性���、線性�、信噪比����、檢測和定量的限度和任何其參數(shù)的因素���,以獲得最佳的分析結果����。
本文根據(jù)ICH指導原則中Q2(R1)���、Q8(R2)和Q9指南討論了一種分析方法開發(fā)和驗證的系統(tǒng)方法�。大致可以分為一下十個步驟�。
1.確定分析方法的目的(表征/放行)和所有關鍵質量屬性(Critical QualityAttributes, CQAs)
分析方法的目的有兩種,一種是用于樣品的放行檢測一種是用于工藝過程中的控制����。根據(jù)ICH Q8(R2)和樣品特征確定的終產(chǎn)品的CQAs�。對于雜質控制來講,需要控制的雜質范圍����,雜質的限度����,若雜質不做控制的風險評估���,該方法與其他方法相關性,每個測定方法與用于評價產(chǎn)品的其他測定方法的正交性如何����。在藥物開發(fā)和生產(chǎn)過程中���,該檢測方法如何最小化或影響風險����。
2.根據(jù)CQAs和開發(fā)目標選擇合適的分析方法
分析方法有很多中,最需要關注的是方法需要具有較高的選擇性和可靠性。
3.確定與方法相關的流程步驟
確保所有的分析方法步驟,并且詳細說明了流程�、材料試劑和儀器的使用����。確定實驗中可能產(chǎn)生偏差和精確度的步驟。
4.確定所有與發(fā)布測試相關的規(guī)格限制
對于那些將用于放行測試的分析方法�,控制產(chǎn)品放行的限度是什么? 限度設定的依據(jù)可以從歷史數(shù)據(jù),行業(yè)標準���,基于多批次數(shù)據(jù)統(tǒng)計學的偏差和平均值等確定���。限度需要反映患者用藥風險、CQAs保證和藥品生產(chǎn)過程中的物料和終產(chǎn)品的控制����。
5.對需要進行分析的地方進行風險評估
分析方法風險評估用于確定分析的步驟對精密度����、準確度、線性����、專屬性、靈敏度(信噪比)等的影響�。可以使用故障模式與理象分析(Failure Mode andEffects Analysis , FMEA)或其他風險評估方法評估。此外�,我們需要在風險中添加CQAs和不確定性的影響因素進行排名����。驗證過程均應從這個角度出發(fā)����,對具體可能影響精密度或者準確度的因素進行驗證���。
6.a.系統(tǒng)設計(合適的工藝/設備/技術)
b.參數(shù)設計(設計范圍)
c.可接受范圍設計(允許偏差)
在風險評估的基礎上���,取樣量和取樣方法的確定是關鍵的考慮因素����。
分析開發(fā)可分為三個步驟:1)系統(tǒng)設計,2)參數(shù)設計3)可接受范圍設計�。
系統(tǒng)設計是確保我們選擇合適的材料���,合適的技術和設備。參數(shù)設計是通常是通過DOEs來完成的����,并確保方法在最佳設計范圍�?���?山邮芊秶O計中的精密度和準確度是最為關鍵的兩個指標。
7. 完成驗證
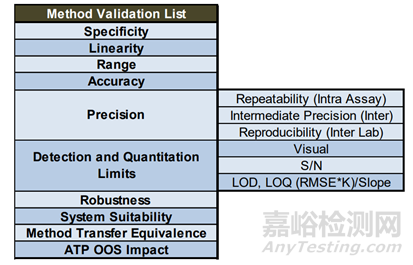
圖1方法驗證項目匯總
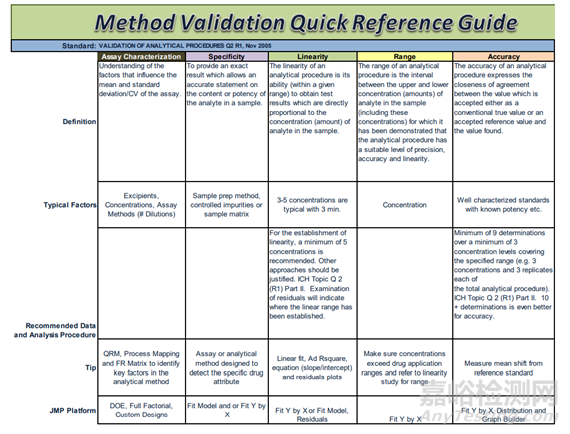
圖2方法驗證操作細則
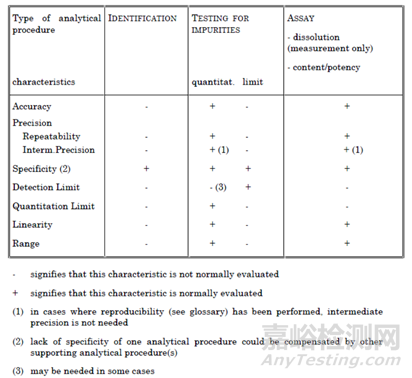
圖3 ICH Q2(R1)中分析方法驗證內(nèi)容
8.定義方法的控制策略
一旦該分析方法完成開發(fā)和驗證�,就需要制定一個明確的控制策略(PAT)���。例如:被分析物和參比分別是什么?如何確定參比的穩(wěn)定性����?什么將用于跟蹤和趨勢分析藥品隨時間推移發(fā)生的變化���?一旦檢測結果發(fā)生漂移���,用什么來調(diào)整/修正���?多套數(shù)據(jù)資料見如何互相參引和利用等。
9.對所有分析人員進行該方法的培訓
應對所有使用分析方法的人員進行培訓�。分析方法中可能出錯的點有:樣本選擇����,樣品制備、稱量�、混合����、稀釋���、濃縮����、峰位置、進樣方法���、時間變化等。
10.確定分析方法對工藝變更�、驗證和產(chǎn)品合格率的影響
總體標準偏差可以表示為:
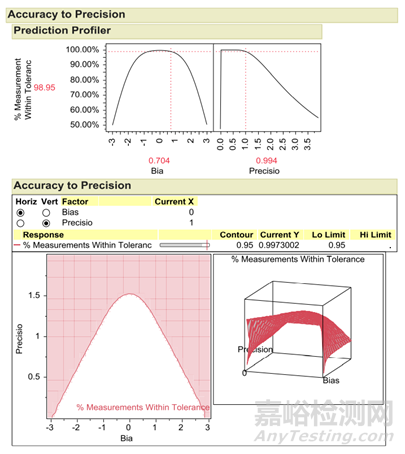
隨著分析方法誤差的增加,總體誤差也隨之增加����。利用準確度到精密度(Precision ToAccuracy , ATP)模型���,可以可視化產(chǎn)品合格率的準確度和精密度之間的關系����。ATP模型顯示了精密度和準確度的變化如何影響產(chǎn)品合格率和分析誤差設計空間���。一般使用數(shù)字5.15表示99%的分析誤差���?��?傮w測量誤差%= (標準偏差測量誤差*5.15)/(限度最高值-限度最低值)�。
圖4精密度和準確度的關系
重視方法的開發(fā)�、驗證和風險控制將極大地提高方法的有效性、藥物研發(fā)質量���、患者安全���。