摘 要 / Abstract
臨床研究在藥物研發(fā)和醫(yī)學(xué)領(lǐng)域中的作用越來越重要,其中數(shù)據(jù)質(zhì)量與科學(xué)性是重要環(huán)節(jié)之一���。為了提高數(shù)據(jù)準(zhǔn)確性���,我國監(jiān)管機(jī)構(gòu)積極推進(jìn)臨床研究監(jiān)管改革,并強(qiáng)調(diào)源數(shù)據(jù)的可追溯性和準(zhǔn)確性��。電子源數(shù)據(jù)記錄(ESR)技術(shù)在提高數(shù)據(jù)質(zhì)量和降低成本方面具有重要作用��。研究團(tuán)隊圍繞源數(shù)據(jù)質(zhì)量進(jìn)行探索�����,提出建立基于臨床研究項目的電子源數(shù)據(jù)存儲庫(ESDR)的研究流程以及對應(yīng)的審核查驗要點等解決方案���?��;贓SDR源數(shù)據(jù)管理系統(tǒng)的工作流程覆蓋了從研究項目源數(shù)據(jù)采集、治理到研究數(shù)據(jù)庫輸出等各個環(huán)節(jié)���,同時對臨床研究的數(shù)據(jù)管理過程操作留痕���,具有完備的稽查軌跡�����,有利于高效地進(jìn)行審核查驗工作。
Clinical research plays an increasingly important role in drug development and the medical field, with data quality and scientific rigor being crucial aspects. In order to enhance data accuracy, regulatory agencies in China are actively promoting reforms of clinical research supervision, emphasizing the traceability and accuracy of source data. Electronic source record(ESR) technology plays a vital role in improving data quality and reducing costs. This research team explores the quality of source data and proposes possible solutions, such as a research workflow for establishing an electronic source data repository(ESDR) based on clinical research projects, along with corresponding audit and inspection points.The ESDR workflow, which relies on the electronic information system, covers the entire process from source data collection and governance to data output, leaving a comprehensive audit trail. This feature makes it convenient for efficient audit and inspection work in the data management process of clinical research.
關(guān) 鍵 詞 / Key words
電子源數(shù)據(jù)存儲庫;源數(shù)據(jù)管理���;審核查驗;臨床研究
electronic source data repository; source data management; audit and inspection; clinical research
1��、我國監(jiān)管機(jī)構(gòu)在臨床研究監(jiān)管方面的改革進(jìn)展
2015年7月22日原國家食品藥品監(jiān)督管理總局發(fā)布了關(guān)于開展藥物臨床試驗數(shù)據(jù)自查核查工作的公告[1]���,此后80%新藥申請的臨床研究項目被撤回���,成為我國醫(yī)藥研發(fā)領(lǐng)域著名的“7·22事件”,對我國藥品監(jiān)管改革與醫(yī)藥創(chuàng)新發(fā)展具有里程碑意義���。2018年我國學(xué)者針對英國醫(yī)學(xué)雜志(British Medical Journal,BMJ)在2016年的1篇質(zhì)疑我國臨床試驗數(shù)據(jù)質(zhì)量的新聞報道[2]發(fā)表了觀點性文章�����,闡述了該公告的發(fā)布是為了進(jìn)一步保障我國臨床研究數(shù)據(jù)的準(zhǔn)確性�����,并提出了建立醫(yī)院臨床研究源數(shù)據(jù)管理平臺及源數(shù)據(jù)管理流程架構(gòu)來提高我國臨床研究數(shù)據(jù)可靠性的解決方案�����,即在醫(yī)院建立一個獨立的臨床研究項目源數(shù)據(jù)管理系統(tǒng),用于電子化同步和存儲所有與研究相關(guān)的電子源數(shù)據(jù)[3]��。
臨床研究在藥物研發(fā)和醫(yī)學(xué)領(lǐng)域中的作用越來越重要�����,其中數(shù)據(jù)質(zhì)量與科學(xué)性是重要環(huán)節(jié)之一。為了進(jìn)一步提高臨床研究數(shù)據(jù)的質(zhì)量和準(zhǔn)確性�����,我國監(jiān)管機(jī)構(gòu)積極推進(jìn)臨床研究監(jiān)管改革���,不斷完善監(jiān)管政策與規(guī)范���。2017年���,原國家食品藥品監(jiān)督管理總局正式加入國際人用藥品注冊技術(shù)協(xié)調(diào)會(International Council on Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)��,意味著我國藥品監(jiān)管部門、制藥行業(yè)和研發(fā)機(jī)構(gòu)將逐步轉(zhuǎn)化和執(zhí)行國際制藥研發(fā)生產(chǎn)的最高技術(shù)標(biāo)準(zhǔn)和指南���。2019年一項關(guān)于臨床真實世界數(shù)據(jù)和證據(jù)用于藥品醫(yī)療器械審評審批的相關(guān)探索研究中[4],為保障臨床研究收集數(shù)據(jù)的完整性�����、準(zhǔn)確性、一致性及可溯源性,提出了制定真實世界數(shù)據(jù)標(biāo)準(zhǔn)�����,探索新的高效���、可靠的數(shù)據(jù)采集模式。2021年國家藥品監(jiān)督管理局食品藥品審核查驗中心發(fā)布了《藥品注冊核查工作程序(試行)》等5個文件的通告[5]�����,同年國家藥品監(jiān)督管理局藥品審評中心也發(fā)布了《藥品注冊核查檢驗啟動工作程序(試行)》的通告[6]��。這兩份文件對藥品注冊核查���、申報上市等提出了大量要求��,預(yù)示著今后國內(nèi)新藥的注冊審批會更加規(guī)范���。2021年9月�����,國家衛(wèi)生健康委發(fā)布了《醫(yī)療衛(wèi)生機(jī)構(gòu)開展研究者發(fā)起的臨床研究管理辦法(試行)》[7]��,第三十九條指出:醫(yī)療衛(wèi)生機(jī)構(gòu)應(yīng)當(dāng)建立臨床研究源數(shù)據(jù)的管理體系���,實現(xiàn)集中統(tǒng)一存儲�����,保障臨床研究數(shù)據(jù)在收集、記錄�����、修改���、處理和保存過程中的真實性���、準(zhǔn)確性���、完整性��、規(guī)范性���、保密性���,確保數(shù)據(jù)可查詢�����、可溯源��。
2���、電子源數(shù)據(jù)管理在臨床研究中的重要性
真實世界數(shù)據(jù)(real world data,RWD)是指來源于日常所收集的各種與患者健康狀況或診療及保健有關(guān)的數(shù)據(jù)[8]。盡管已有許多關(guān)于如何進(jìn)一步提高數(shù)據(jù)準(zhǔn)確性的建議���,但在保障源數(shù)據(jù)可溯源性等方面仍面臨諸多挑戰(zhàn)[9]。源數(shù)據(jù)是指臨床研究中的原始記錄或其核證副本上記載的所有信息��,包括臨床發(fā)現(xiàn)���、觀測結(jié)果以及用于重建和評價該試驗所必需的其他相關(guān)活動記錄[10-11]�����。臨床研究的源數(shù)據(jù)類型包括醫(yī)療病歷文本�����、醫(yī)學(xué)影像���、音頻(比如醫(yī)生與患者之間的對話�����、心跳聲音���、呼吸音)和視頻(比如手術(shù)過程、康復(fù)訓(xùn)練)等多種形式的數(shù)據(jù)���。源數(shù)據(jù)應(yīng)當(dāng)具有可歸因性、易讀性��、同時性��、原始性���、準(zhǔn)確性、完整性�����、一致性和持久性[12]���。與之對應(yīng)的另一個術(shù)語——元數(shù)據(jù)(metadata)���,是指“數(shù)據(jù)的數(shù)據(jù)”���,即用于描述�����、解釋和簡化數(shù)據(jù)檢索�����、使用和管理的數(shù)據(jù)[13]��。元數(shù)據(jù)包含了關(guān)鍵信息��,如數(shù)據(jù)收集時間���、收集者身份、儀器標(biāo)識等��,對于正確理解和驗證數(shù)據(jù)至關(guān)重要�����。臨床研究中�����,如果沒有正確的元數(shù)據(jù)說明�����,數(shù)據(jù)就可能變得毫無意義���。元數(shù)據(jù)可以手動錄入或通過自動捕獲生成,且能與源數(shù)據(jù)通過唯一標(biāo)識符相互關(guān)聯(lián)���,確保數(shù)據(jù)的可追溯性���。
電子源數(shù)據(jù)記錄(electronic source record,ESR)技術(shù)通常指直接從源數(shù)據(jù)來源捕獲�����、收集并存儲與研究項目直接相關(guān)的電子源數(shù)據(jù)和元數(shù)據(jù),以簡化臨床研究的操作流程�����,進(jìn)一步提升效率與質(zhì)量[14]��。電子源數(shù)據(jù)存儲庫(electronic source data repository,ESDR)是利用ESR技術(shù)建立的一個同步和采集�����、存儲臨床研究項目所有電子源數(shù)據(jù)的數(shù)據(jù)庫�����。ESDR可提供數(shù)據(jù)的安全存儲和管理���,在臨床研究中扮演關(guān)鍵角色���。另外,由于ESDR中的源數(shù)據(jù)記錄與元數(shù)據(jù)緊密相關(guān)���,能記錄數(shù)據(jù)生成和處理的所有步驟���,因此可通過數(shù)據(jù)留痕和防止篡改保證數(shù)據(jù)可追溯。
3���、保障臨床源數(shù)據(jù)質(zhì)量的研究進(jìn)展
在上述研究背景下,本研究團(tuán)隊立足于國內(nèi)臨床研究現(xiàn)狀��,將解決“源數(shù)據(jù)”方面的挑戰(zhàn)作為解決臨床研究質(zhì)量的瓶頸���,并在海南博鰲樂城國際醫(yī)療旅游先行區(qū)(以下簡稱樂城先行區(qū))開展了許多重要的探索研究�����。前期研究提出了適用于提高我國臨床研究數(shù)據(jù)可靠性的解決方案�����,即建立醫(yī)院臨床研究源數(shù)據(jù)平臺�����,構(gòu)建臨床研究源數(shù)據(jù)通用管理流程[9]��。在此基礎(chǔ)上���,研究團(tuán)隊在樂城先行區(qū)開展RWD研究項目的實踐��,進(jìn)一步提出了數(shù)字化的RWD采集模式[15]��。此外��,研究團(tuán)隊針對臨床研究數(shù)據(jù)庫數(shù)據(jù)現(xiàn)狀提出適用于RWD的數(shù)據(jù)治理模式[16]以及保障數(shù)據(jù)安全方面的實施策略[17-18]�����。2021年��,研究團(tuán)隊提出了RWD采集���、治理與管理一體化解決工具的建設(shè)方案[19]以及RWD相關(guān)的數(shù)據(jù)標(biāo)準(zhǔn)轉(zhuǎn)化的解決方案[20-21]。研究團(tuán)隊與其他機(jī)構(gòu)合作開發(fā)了ESR工具[22]��,并在多個真實世界研究項目中進(jìn)行了試用[23-24]���。
基于前期的經(jīng)驗��,本研究將提出圍繞ESDR的新型臨床研究模式,并結(jié)合我國監(jiān)管機(jī)構(gòu)對審核查驗的政策文件要求�����,提出對應(yīng)的審核查驗路徑與要點���,以期為促進(jìn)監(jiān)管機(jī)構(gòu)對臨床研究監(jiān)管提供參考建議�����。
4���、基于ESDR的臨床研究流程
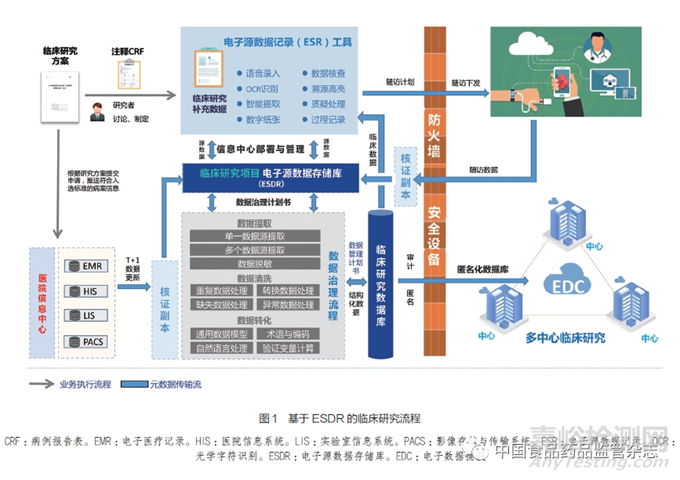
在臨床研究中�����,質(zhì)量源于設(shè)計(quality by design,Qb D)理念也是確保研究質(zhì)量的關(guān)鍵要素[25]��,旨在通過在研究設(shè)計和執(zhí)行階段的質(zhì)量策略和風(fēng)險管理[26]��,確保研究數(shù)據(jù)的準(zhǔn)確性��、可靠性和一致性��。研究團(tuán)隊基于Qb D理念提出了基于ESDR的臨床研究流程(圖1),將有助于更好地理解和控制潛在的質(zhì)量風(fēng)險�����,提高研究數(shù)據(jù)的質(zhì)量��,并確保研究結(jié)果的可信度和可重復(fù)性��。通過基于ESDR的臨床研究流程��,研究者可以高效、準(zhǔn)確地采集和管理臨床研究數(shù)據(jù)���,同時確保數(shù)據(jù)的安全性、完整性和可溯源性等特性�����。該流程有望優(yōu)化臨床研究的傳統(tǒng)數(shù)據(jù)采集流程,促進(jìn)臨床研究的質(zhì)量��,并為監(jiān)管機(jī)構(gòu)審核查驗提供輔助技術(shù)。
4.1 制定臨床研究方案和電子病例報告表(electronic case report form,eCRF)
研究開始時,研究團(tuán)隊需要確定臨床研究方案���,并設(shè)計相應(yīng)的e CRF,用于采集研究數(shù)據(jù)��。根據(jù)研究方案進(jìn)行適用性評價��,包括確定數(shù)據(jù)的來源、采集方式和質(zhì)量�����,評估研究的設(shè)計和方法是否合理��,能否回答特定的研究問題等。
4.2 院內(nèi)數(shù)據(jù)采集與備份
基于臨床醫(yī)療場景與臨床研究方案���,制定出適用于臨床醫(yī)生診療常規(guī)的源數(shù)據(jù)采集模式���。ESR工具嵌入了多種功能�����,如語音錄入���、光學(xué)字符識別(optical character recognition,OCR)和智能提取��,幫助研究者高效采集院內(nèi)研究數(shù)據(jù)。研究開始前���,對參與研究的人員進(jìn)行相關(guān)工具使用和操作技能的培訓(xùn)以及資質(zhì)的審核等���。采集后的數(shù)據(jù)不需要轉(zhuǎn)化��,即保留最初的特征以形成核證副本數(shù)據(jù)庫用于驗證數(shù)據(jù)的原始性。這些數(shù)據(jù)通過數(shù)據(jù)脫敏與權(quán)限管理可實現(xiàn)遠(yuǎn)程審核查驗的需求��。
4.3 院外隨訪數(shù)據(jù)采集與備份
醫(yī)生可以在平臺上定制研究的隨訪計劃�����,通過院內(nèi)防火墻將其傳輸?shù)交颊叨耍ㄈ缡謾C(jī)等),并且與患者密切溝通以減少方案偏離的風(fēng)險和提高患者安全。在院外采集的隨訪數(shù)據(jù)通過院內(nèi)防火墻加入已有的核證副本��,減少研究者院內(nèi)外管理的負(fù)擔(dān)。采集院內(nèi)和院外的數(shù)據(jù)并備份至核證副本數(shù)據(jù)庫中可有效提高研究數(shù)據(jù)的完整性�����。
4.4 數(shù)據(jù)治理
在確定數(shù)據(jù)治理計劃書后���,技術(shù)人員執(zhí)行數(shù)據(jù)治理流程��。這包括數(shù)據(jù)提取��、數(shù)據(jù)清洗和數(shù)據(jù)轉(zhuǎn)化等步驟���。數(shù)據(jù)提取涉及單一數(shù)據(jù)源提取�����、多個數(shù)據(jù)源提取和數(shù)據(jù)脫敏等操作�����;數(shù)據(jù)清洗包括處理重復(fù)數(shù)據(jù)��、缺失數(shù)據(jù)、轉(zhuǎn)換數(shù)據(jù)和異常數(shù)據(jù)等�����;數(shù)據(jù)轉(zhuǎn)化包括通用數(shù)據(jù)模型���、自然語言處理��、術(shù)語與編碼以及驗證變量計算等操作��。
4.5 數(shù)據(jù)核查與處理
ESR工具配備了數(shù)據(jù)核查模塊�����,該模塊可以在原始記錄的核證副本中高亮顯示研究數(shù)據(jù)對應(yīng)的源數(shù)據(jù)�����,便于進(jìn)行一致性比對和溯源。存疑數(shù)據(jù)會進(jìn)行質(zhì)疑處理�����,錯誤數(shù)據(jù)將由被授權(quán)的研究者進(jìn)行修訂���。
4.6 數(shù)據(jù)庫形成與傳輸
基于數(shù)據(jù)管理計劃書產(chǎn)生結(jié)構(gòu)化��、標(biāo)準(zhǔn)化的臨床研究數(shù)據(jù)庫��,然后通過對e CRF涉及個人隱私的字段進(jìn)行脫敏和加密技術(shù)處理��,最終生成一個匿名化的臨床研究數(shù)據(jù)庫�����,并與多中心臨床研究數(shù)據(jù)管理系統(tǒng)對接�����,實現(xiàn)真正的電子數(shù)據(jù)捕獲(electronic data capture,EDC)��。
4.7 全流程元數(shù)據(jù)記錄的保存
整個過程的所有操作都會被記錄以確保數(shù)據(jù)稽查軌跡的完整性和可追溯性��。此外���,需要做好各種文檔的記錄���,比如在采集工具使用前需要提供軟件測試和系統(tǒng)驗證文檔等。
5��、醫(yī)院回顧性數(shù)據(jù)質(zhì)量挑戰(zhàn)與前瞻性數(shù)據(jù)收集策略
以新型冠狀病毒感染(COVID-19)相關(guān)研究項目進(jìn)行舉例��,基于前文所述ESDR的工作流程��,研究團(tuán)隊在某醫(yī)院的回顧性研究項目中部署了ESR工具�����,以檢查該項目的數(shù)據(jù)完整性(表1)���。其中,模塊的內(nèi)容通常不是固定的,不同的研究項目可能會有不同的模塊和變量�����,其主要根據(jù)研究需要而進(jìn)行設(shè)計���。每個研究項目可能會定義不同的模塊內(nèi)容���,以確保收集和記錄與研究問題相關(guān)的數(shù)據(jù)。
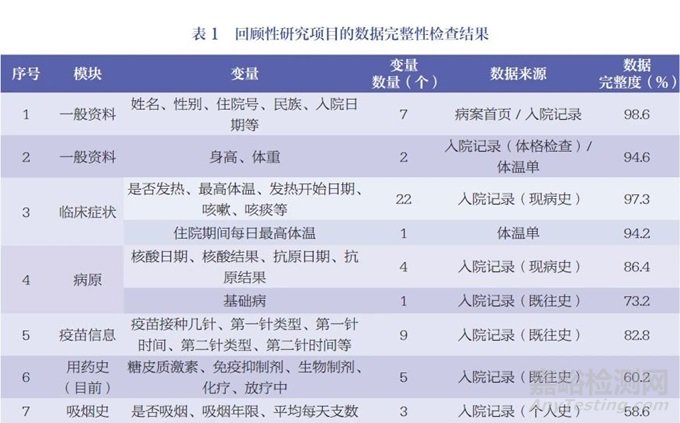
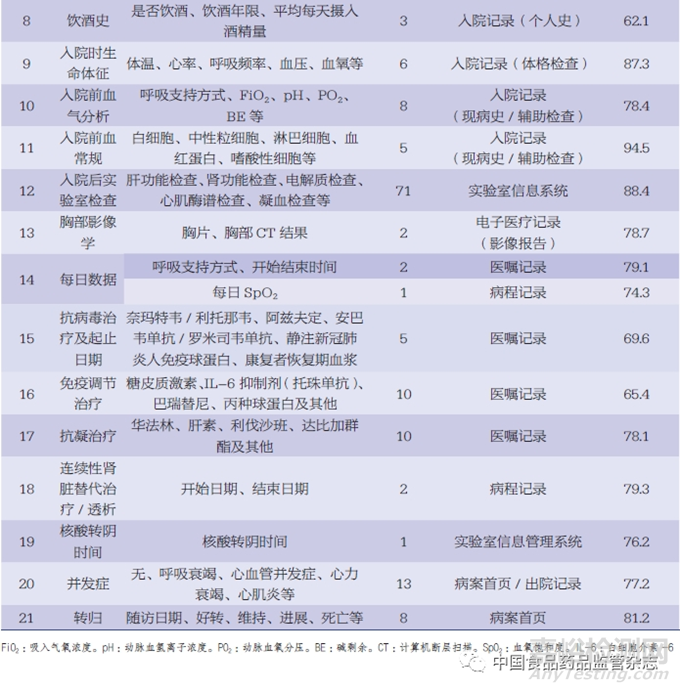
由于回顧性研究的局限性,數(shù)據(jù)采集過程中可能遇到諸多數(shù)據(jù)質(zhì)量問題��,如數(shù)據(jù)缺失、重復(fù)�����、唯一標(biāo)識缺失等?����;仡櫺匝芯宽椖恐写蟛糠?jǐn)?shù)據(jù)的采集來自于院內(nèi)診療系統(tǒng)���,而在數(shù)據(jù)采集及治理的過程中可能遇到的較大問題和挑戰(zhàn)主要體現(xiàn)在5個方面:(1)數(shù)據(jù)的完整性不高���。一方面由于醫(yī)院信息系統(tǒng)(hospital information system,HIS)相對獨立��,信息化水平不一致�����,區(qū)域衛(wèi)生信息中心平臺覆蓋不全���;另一方面由于部分醫(yī)療機(jī)構(gòu)追求診斷效率�����,導(dǎo)致HIS使用不完全或業(yè)務(wù)未開展,仍主要采用回顧性填寫臨床病歷的方式���,從而造成數(shù)據(jù)不完整��。(2)數(shù)據(jù)的標(biāo)準(zhǔn)化程度不夠高。在實際臨床工作中��,醫(yī)務(wù)人員在使用HIS時,出于對診療效率和診療精確度的考慮,對標(biāo)準(zhǔn)化術(shù)語��、名稱等的使用不夠規(guī)范。(3)數(shù)據(jù)的準(zhǔn)確度不夠高��。由于大部分HIS的自動化程度低,醫(yī)務(wù)人員在診療過程中需要手動錄入數(shù)據(jù)��,可能出現(xiàn)原始數(shù)據(jù)錯漏、不完整等問題��。(4)數(shù)據(jù)的整合性欠缺。缺乏統(tǒng)一的元數(shù)據(jù)標(biāo)準(zhǔn)���,數(shù)據(jù)整合存在困難��;缺乏對主數(shù)據(jù)的統(tǒng)一管理��,對患者或醫(yī)生醫(yī)療過程中的核心數(shù)據(jù)實體難以進(jìn)行唯一標(biāo)識���,因而無法實時更新;大量數(shù)據(jù)以文本���、圖像、影像等非結(jié)構(gòu)化的形式存儲等��。多種因素使得數(shù)據(jù)后續(xù)整合與分析的難度增加�����。(5)數(shù)據(jù)的一致性較差���。一方面由于現(xiàn)有的醫(yī)療數(shù)據(jù)標(biāo)準(zhǔn)尚未完全統(tǒng)一��,健康醫(yī)療信息領(lǐng)域市場巨大,醫(yī)療信息化廠商多���,導(dǎo)致異構(gòu)數(shù)據(jù)源產(chǎn)出的健康醫(yī)療數(shù)據(jù)標(biāo)準(zhǔn)不一致���;其次,同一醫(yī)療機(jī)構(gòu)內(nèi)部不同治療階段的數(shù)據(jù)存在前后不一致的問題��,這可能是由于數(shù)據(jù)記錄方式�����、采集時間點和指標(biāo)統(tǒng)計方法的不一致所致���。
院內(nèi)業(yè)務(wù)診療數(shù)據(jù)作為醫(yī)療行業(yè)重要的信息資源,是臨床研究的重要數(shù)據(jù)支撐��。對于回顧性研究而言���,數(shù)據(jù)質(zhì)量將直接影響研究的最終結(jié)果輸出。由于難以通過有效的方式進(jìn)行數(shù)據(jù)補(bǔ)充���,只能利用研究病例的數(shù)量范圍進(jìn)行篩選,整體過程有一定的局限性及傾向性���。同時�����,針對這些回顧性數(shù)據(jù),如何對其進(jìn)行高效的治理��、如何充分發(fā)揮其價值作用�����,已成為目前醫(yī)療信息研究過程中考慮的關(guān)鍵步驟�����。
考慮到回顧性研究數(shù)據(jù)來源范圍的缺陷���,一項真實世界數(shù)據(jù)研究方案設(shè)計中根據(jù)Qb D理念�����,在前瞻性研究中通過使用研究型病歷補(bǔ)充采集及患者隨訪上報等方式對回顧性研究中缺失的數(shù)據(jù)進(jìn)行了完善�����。前瞻性研究可根據(jù)研究方案的要求���,對項目所需的數(shù)據(jù)內(nèi)容實現(xiàn)靈活配置���,從而最大可能地采集臨床研究數(shù)據(jù)���。源數(shù)據(jù)采集的方式也會根據(jù)數(shù)據(jù)的來源不同�����,實現(xiàn)不同的技術(shù)匹配�����。對健康醫(yī)療大數(shù)據(jù)而言,因大部分?jǐn)?shù)據(jù)存儲在診療業(yè)務(wù)系統(tǒng)中���,需要通過協(xié)調(diào)相應(yīng)的廠商或信息科開放相應(yīng)的接口�����,通過接口對接的方式進(jìn)行數(shù)據(jù)采集�����;對于無法采集或者完整度較低的數(shù)據(jù)���,可通過設(shè)計臨床研究補(bǔ)充病歷進(jìn)行采集���,生成臨床研究電子采集病歷的電子紙張,研究者通過手動填寫��、語音錄入�����、OCR識別���、外掛鏈接獲取等多種方式�����,實現(xiàn)此部分的數(shù)據(jù)采集�����;而對于院外研究數(shù)據(jù)���,需要分析其數(shù)據(jù)承載的載體類型�����,若為手機(jī)應(yīng)用程序��、小程序等信息化載體���,也可通過接口對接的方式獲取�����,而如果該數(shù)據(jù)的存儲載體為某項硬件或者其他�����,則需要具體問題具體分析���。
6、基于ESDR的真實世界數(shù)據(jù)研究項目實踐
在樂城先行區(qū)開展的某醫(yī)療器械RWD研究項目中的ESDR涵蓋了院內(nèi)數(shù)據(jù)�����、院內(nèi)補(bǔ)充數(shù)據(jù)和院外隨訪數(shù)據(jù)��,適用于監(jiān)管機(jī)構(gòu)到醫(yī)療機(jī)構(gòu)進(jìn)行現(xiàn)場審核查驗�����,以驗證RWD的臨床相關(guān)性���、數(shù)據(jù)準(zhǔn)確性��、系統(tǒng)合規(guī)性和質(zhì)量控制措施等,增強(qiáng)真實世界研究的科學(xué)性�����、數(shù)據(jù)可追溯性和患者數(shù)據(jù)隱私保護(hù)���。
6.1 系統(tǒng)部署
為確保系統(tǒng)的安全性并滿足平臺要求�����,研究人員采用了醫(yī)院內(nèi)部的純內(nèi)網(wǎng)解決方案��,即將服務(wù)器部署在醫(yī)院內(nèi)網(wǎng)中,并引入一臺前置機(jī)用于執(zhí)行接口程序���。研究人員還提供了原始數(shù)據(jù)源���,并附上了數(shù)據(jù)來源�����、采集方法確認(rèn)文件以及項目性能確認(rèn)(performance qualification,PQ)文檔�����,以驗證數(shù)據(jù)采集方式的適用性��。這些措施確保了系統(tǒng)數(shù)據(jù)來源的完整性和可靠性��,有助于提高研究的準(zhǔn)確性和可信度�����。
由于研究涉及真實世界的醫(yī)療數(shù)據(jù)�����,系統(tǒng)在部署前已存在一些回顧性的醫(yī)療數(shù)據(jù)。在成功與醫(yī)院內(nèi)部業(yè)務(wù)系統(tǒng)(包括電子病歷��、實驗室信息系統(tǒng)和心電系統(tǒng)等)對接后��,系統(tǒng)自動采集了患者在醫(yī)院內(nèi)部系統(tǒng)中的診療數(shù)據(jù)���,研究人員可以通過比較自動提取的數(shù)據(jù)與人工錄入數(shù)據(jù)的準(zhǔn)確性來進(jìn)行驗證�����。對于影像類型的數(shù)據(jù)�����,如核磁共振圖像和手術(shù)過程視頻�����,系統(tǒng)支持將這些影像上傳���,以供后續(xù)的量表評分和分析。
此外��,對于醫(yī)院外部的數(shù)據(jù)���,特別是以紙質(zhì)形式記錄的量表數(shù)據(jù)���,研究人員可通過掃描的方式將其集成到系統(tǒng)中���,并自動填入e CRF。對于院外的隨訪數(shù)據(jù)��,包括錄音和視頻等音視頻數(shù)據(jù)�����,也可上傳到系統(tǒng)中�����,以支持?jǐn)?shù)據(jù)的追溯和維護(hù)���。
6.2 數(shù)據(jù)采集過程的質(zhì)量控制
數(shù)據(jù)采集過程的質(zhì)量控制包括6個方面:(1)檢查研究者文件夾,確認(rèn)倫理批件包含與系統(tǒng)使用相關(guān)的信息��。系統(tǒng)搭建工程師提供藥物臨床試驗質(zhì)量管理規(guī)范(good clinical practice,GCP)培訓(xùn)證書和《健康保險流通與責(zé)任法案》(Health Insurance Portability and Accountability Act,HIPAA)合規(guī)性培訓(xùn)證書�����,項目組成員提供系統(tǒng)使用的培訓(xùn)記錄。系統(tǒng)操作手冊和系統(tǒng)3Q驗證[安裝驗證(installation qualification,IQ)��、操作驗證(operation qualification,OQ)以及性能驗證(performance qualification,PQ)服務(wù)]文檔完整��。(2)通過詢問項目組成員��,了解到其通過獨立賬戶和密碼訪問系統(tǒng)��,各賬戶角色由權(quán)限中心管理員統(tǒng)一分配�����,登錄信息和角色更新可在系統(tǒng)后臺查看��,確保各角色的模塊�����、權(quán)限和項目與任務(wù)授權(quán)表一致�����。(3)核查系統(tǒng)數(shù)據(jù)庫�����,僅保留患者住院ID和姓氏的部分信息,例如“ID304503��,王”���。(4)驗證源數(shù)據(jù)的來源和采集方法��,核查源數(shù)據(jù)的采集時間滿足研究要求��。(5)驗證系統(tǒng)提取的數(shù)據(jù)與患者的檢驗報告源文件的一致性���,系統(tǒng)抓取的數(shù)據(jù)完整度在97.1%~100.0%范圍內(nèi)��,精確度在91.4%~100.0%范圍內(nèi)���。(6)對上傳到系統(tǒng)的手術(shù)跟臺視頻和核磁共振圖像的源文件進(jìn)行驗證���,核查軟骨修復(fù)組織的磁共振觀察評分(magnetic resonance observation of cartilage repair tissue,MOCART)的溯源記錄完整。
7�����、基于ESDR工作目標(biāo)場景需求進(jìn)行審核查驗的關(guān)注要點
根據(jù)數(shù)據(jù)監(jiān)管的工作目標(biāo)���,數(shù)據(jù)的審核查驗包括從源數(shù)據(jù)產(chǎn)生到形成最終研究數(shù)據(jù)庫的整個過程��。從數(shù)據(jù)層面來看�����,該過程主要目的是核實申報提交數(shù)據(jù)采集方式的適用性��、數(shù)據(jù)的真實性���、與源數(shù)據(jù)的一致性以及數(shù)據(jù)獲取過程的合規(guī)性和質(zhì)量控制情況��。
ESDR的工作目標(biāo)場景主要是用于適應(yīng)多源數(shù)據(jù)��,特別是電子源數(shù)據(jù)的采集���、整合和輸出,下面對該目標(biāo)工作場景下需關(guān)注的審核要點及路徑進(jìn)行闡述��。
7.1 數(shù)據(jù)采集方式的適用性
在數(shù)據(jù)采集之前確認(rèn)目標(biāo)數(shù)據(jù)采集的方法符合實際應(yīng)用場景���,數(shù)據(jù)從采集到形成研究數(shù)據(jù)庫全流程性能完好��。需提供源數(shù)據(jù)來源��、采集方法確認(rèn)文件和PQ文檔��。
7.2 數(shù)據(jù)采集過程的合規(guī)性
數(shù)據(jù)采集過程的合規(guī)性主要包括數(shù)據(jù)安全��、數(shù)據(jù)隱私保護(hù)和倫理合規(guī)性等��。其中��,數(shù)據(jù)安全涵蓋數(shù)據(jù)采集���、傳輸�����、存儲的各個環(huán)節(jié)��,如數(shù)據(jù)有無訪問權(quán)限設(shè)置、加密保護(hù)��、防火墻設(shè)置���、數(shù)據(jù)存儲和容災(zāi)備份措施等��;數(shù)據(jù)的隱私保護(hù)���,關(guān)注數(shù)據(jù)的脫敏措施和實施結(jié)果�����,如研究數(shù)據(jù)庫中有無出現(xiàn)可識別身份的個人信息等�����;在研究實施前的倫理審批過程中�����,應(yīng)涵蓋對數(shù)據(jù)安全和隱私保護(hù)的相關(guān)內(nèi)容���,倫理獲批后才能正式開展研究。
7.3 人員的資質(zhì)和培訓(xùn)要求
ESDR工作流程涉及多個環(huán)節(jié)和多個操作者���,需關(guān)注操作者是否具有相應(yīng)技術(shù)工作的資質(zhì)和能力��,包括系統(tǒng)構(gòu)建者是否具有相應(yīng)資質(zhì)證書���,例如HIPAA合規(guī)性培訓(xùn)證書、GCP培訓(xùn)證書;系統(tǒng)使用者是否接受過相應(yīng)的培訓(xùn)�����,需提供培訓(xùn)記錄���,確保其能理解并嚴(yán)格遵守操作規(guī)范等�����。
7.4 數(shù)據(jù)采集過程的質(zhì)量保證體系
對質(zhì)量保證體系構(gòu)建進(jìn)行整體評估�����,有無指導(dǎo)質(zhì)量控制過程的標(biāo)準(zhǔn)操作流程�����、人員管理制度���、系統(tǒng)操作手冊��,采用數(shù)據(jù)系統(tǒng)是否經(jīng)過測試和驗證�����,系統(tǒng)3Q驗證文檔是否完整等。
7.5 數(shù)據(jù)治理各階段的審核要點
7.5.1 源數(shù)據(jù)提取過程
源數(shù)據(jù)提取過程主要需關(guān)注數(shù)據(jù)提取的完整性和準(zhǔn)確性�����,可通過該階段的系統(tǒng)質(zhì)控報告結(jié)合實際提取結(jié)果進(jìn)行驗證��。
源數(shù)據(jù)提取包含入組人群篩選和指標(biāo)數(shù)據(jù)篩選兩個方面��,源數(shù)據(jù)提取過程需要與方案以及數(shù)據(jù)治理計劃進(jìn)行比對�����,確保一致性��。
入組人群篩選主要審核是否依據(jù)納入排除標(biāo)準(zhǔn)進(jìn)行篩選�����,包括人口學(xué)信息范圍��,如年齡段���、性別�����;適應(yīng)癥的診斷���;排除的合并疾病等�����。要特別注意是否在事先定義的篩選指標(biāo)范圍內(nèi)��。
指標(biāo)數(shù)據(jù)篩選是否從事先定義的源數(shù)據(jù)來源(如出院診斷���、醫(yī)囑記錄等)中按照既定要求(如訪視窗范圍等)進(jìn)行篩選和提取。
7.5.2 數(shù)據(jù)清洗和轉(zhuǎn)換過程
結(jié)合數(shù)據(jù)治理計劃��,審核數(shù)據(jù)清洗���、去重和質(zhì)量控制的過程中有無相應(yīng)測試和驗證的系統(tǒng)質(zhì)控報告�����。
測試和驗證系統(tǒng)質(zhì)控報告檢查工作中需重點關(guān)注:(1)數(shù)據(jù)清洗轉(zhuǎn)換流程���。審核查驗數(shù)據(jù)清洗轉(zhuǎn)換過程中所采用的算法、規(guī)則和方法是否合理��,是否能夠保證數(shù)據(jù)的完整性和一致性���。若存在異常值或缺失數(shù)據(jù)和重復(fù)記錄�����,提醒研究者進(jìn)行檢查或更正���。(2)數(shù)據(jù)整合的可靠性。審查數(shù)據(jù)加載過程�����,確保多源數(shù)據(jù)的提取�����、轉(zhuǎn)換和加載過程的正確性和可靠性��。在涉及外源數(shù)據(jù)輸入整合時��,需關(guān)注數(shù)據(jù)傳輸協(xié)議內(nèi)容及數(shù)據(jù)鏈接的一致性比對是否按規(guī)定和標(biāo)準(zhǔn)執(zhí)行�����。
7.5.3 數(shù)據(jù)輸出過程
數(shù)據(jù)輸出過程主要關(guān)注:(1)審核數(shù)據(jù)準(zhǔn)確性、完整性和一致性��。核對關(guān)鍵指標(biāo)是否按數(shù)據(jù)提取計劃完整�����、準(zhǔn)確地進(jìn)行了提取�����,包括變量和變量值兩個方面��;數(shù)據(jù)缺失情況是否滿足預(yù)設(shè)要求�����,缺失比例和缺失機(jī)制是否與報告一致��。根據(jù)需求抽查部分?jǐn)?shù)據(jù)��,結(jié)合稽查軌跡進(jìn)行數(shù)據(jù)溯源�����,比對與核證副本數(shù)據(jù)以及源數(shù)據(jù)的一致性。(2)審核數(shù)據(jù)傳輸時間���。是否符合工作節(jié)點要求�����,比如是否發(fā)生了解鎖,如果是�����,是否有合理的解鎖原因���。(3)數(shù)據(jù)傳輸過程有無加密�����,各賬戶角色的權(quán)限設(shè)置�����。
8��、展 望
隨著科技的不斷進(jìn)步和臨床研究的不斷發(fā)展��,ESR技術(shù)有望成為臨床研究的重要趨勢和實踐標(biāo)準(zhǔn)�����。采用ESR技術(shù)將大幅提高臨床研究的效率和數(shù)據(jù)質(zhì)量��,促進(jìn)藥物研發(fā)和醫(yī)療器械創(chuàng)新的進(jìn)展��。ESR技術(shù)將完善個人信息保護(hù)技術(shù)應(yīng)用���,為基于研究項目的源數(shù)據(jù)提取方案提供支持��,并進(jìn)一步完善未來去中心化臨床研究所需的遠(yuǎn)程監(jiān)查技術(shù)的實施模式�����。在收集RWD方面�����,最優(yōu)選的采集模式是在回顧性研究結(jié)果的基礎(chǔ)上進(jìn)一步設(shè)計前瞻性研究項目進(jìn)行采集���,該方法能夠顯著提升數(shù)據(jù)的完整性與準(zhǔn)確性。通過在臨床試驗項目中應(yīng)用電子源數(shù)據(jù)管理,可以遵循最新的ICH E6(R3)指南�����,確保臨床試驗的設(shè)計能夠充分保障參與者的權(quán)益��、安全和健康��。同時�����,這也有助于確保試驗結(jié)果的可靠性��,實施Qb D理念�����,保障臨床試驗過程中的實施流程和風(fēng)險管理策略與所收集數(shù)據(jù)的重要性相匹配��,使試驗參與者的安全性和數(shù)據(jù)可靠性的風(fēng)險得到妥善應(yīng)對��。研究團(tuán)隊將通過進(jìn)一步探索和創(chuàng)新來推動基于ESDR研究模式在臨床RWD研究中的應(yīng)用���,為臨床研究的質(zhì)量和效率提升貢獻(xiàn)更多的典型案例和解決方案。同時,研究團(tuán)隊與監(jiān)管機(jī)構(gòu)的緊密合作將推動電子源數(shù)據(jù)管理的發(fā)展和創(chuàng)新�����,輔助監(jiān)管機(jī)構(gòu)更好地對臨床研究進(jìn)行審核和查驗�����。
引用本文
姚晨,王斌,朱賽楠,鄭姣,賴俊愷,朱歡,丁月琴.基于真實世界研究項目電子源數(shù)據(jù)存儲庫的審核查驗路徑和要點研究[J].中國食品藥品監(jiān)管,2023(10):68-80.