FDA官網(wǎng)中一個有關(guān)藥物開發(fā)報告的實例���,用以說明申請人如何實施質(zhì)量源于設(shè)計(QbD)。 該實例的目的是說明ANDA申請人在其仿制藥開發(fā)過程中實施QbD時�,可使用的藥物開發(fā)研究的類型,同時促進探討OGD在審評中如何使用該信息�����。
本文主要概述了制劑處方開發(fā)的變更風險關(guān)鍵要點和處方開發(fā)的案例1�。
2.2 Drug Product 制劑
2.2.1 Formulation Development 處方開發(fā)
2.2.1.1 Initial Risk Assessment of the Formulation Variables 處方變量的初始風險評估
在該處方開發(fā)的初始風險評估中,還未建立詳細的生產(chǎn)工藝���。因此�,假定對于每個 變更的處方屬性�����,將建立優(yōu)化的生產(chǎn)工藝來評估風險�����。
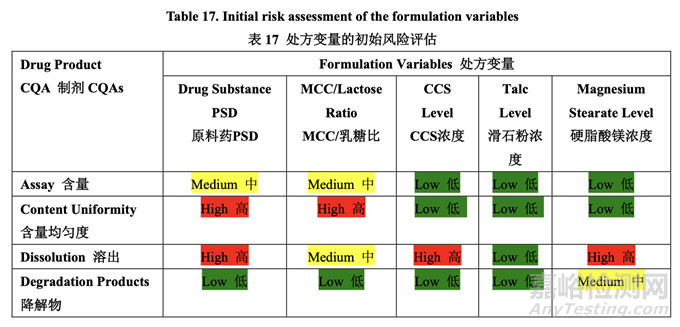
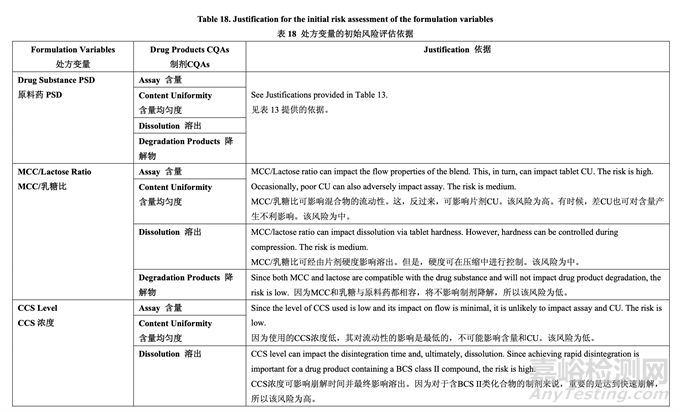
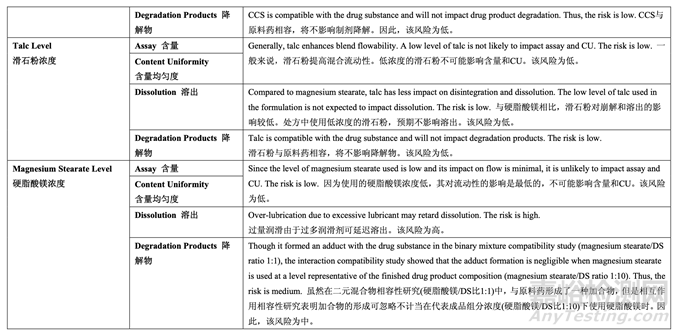
處方變量的初始風險評估結(jié)果見表 17�,風險分配的依據(jù)見表 18���。
2.2.1.2 Drug Substance Particle Size Selection for Product Development
用于產(chǎn)品開發(fā)的原料藥粒徑選擇
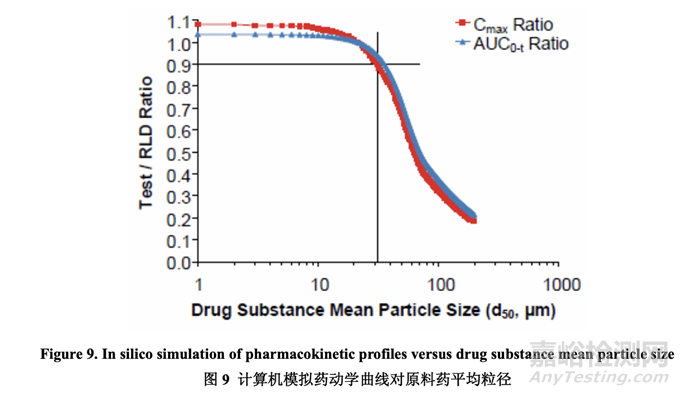
一般來說,對于板狀形態(tài)和粒徑在微米范圍內(nèi)的原料藥,較大粒徑的原料藥可提高生產(chǎn)性因 為其流動性較好�。但是,對于像 acetriptan 的 BCS II 類化合物�����,較大粒徑的原料藥可顯著減 少溶出,對體內(nèi)性能產(chǎn)生消極影響�����。為確定用于進一步研究的適宜原料藥粒度分布范圍�����,進 行了計算機模擬以估計原料藥平均粒徑 d50 對受試制劑和 RLD 間的 Cmax 比和 AUC 比的影 響���。5 預定義的選擇標準是產(chǎn)生 Cmax 比和 AUC 比為 0.9~1.11 的平均粒徑�����。d50 范圍從 1 μm 至 200 μm 的模擬結(jié)果以圖表表示�,見圖 9�����。數(shù)據(jù)表明 d50 為 30 μm 或以下符合預定義標準�, 顯示出對藥動學曲線有限的影響當與 RLD 比較時。
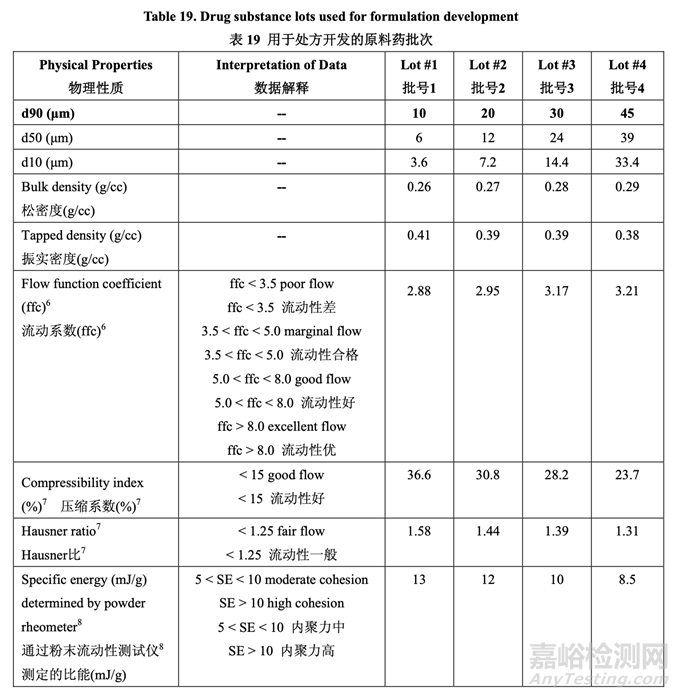
基于模擬結(jié)果���,選擇不同粒度分布的原料藥 4 個批次用于處方開發(fā)�。最終的目的是測試中試 PK 研究中的處方以最終確定用于工業(yè)化的原料藥粒度分布���。評估了原料藥 4 個批次的物理 性質(zhì)和流動性并總結(jié)在表 19 中�。在該開發(fā)報告中���,d90 用于描述原料藥粒度分布�。Acetriptan 的d90分別為10 μm, 20 μm, 30 μm和45 μm分別對應于d50為6 μm, 12 μm, 24 μm和39 μm。
2.2.1.3 Process Selection 工藝選擇
當d90在10~45 μm范圍內(nèi)時�,acetriptan具有內(nèi)聚性并顯示出差流動性���,如壓縮系數(shù)���,Hausner 比���,流動系數(shù)和比能所表明。物料的流動性差可產(chǎn)生具有重量差異和含量差異高的片劑���,由 于原料藥在混合物中的不均勻分布���,不均勻松密度并最終導致壓片機上的膜腔填料不均勻�����。
Acetriptan差流動性排除了處方高載藥量的可能性,支持使用與RLD類似的載藥量(10%)�。 Initially, direct compression of the blend was performed. The blend uniformity (BU) percent relative standard deviation (% RSD) was higher than 6% and the tablet content uniformity % RSD was even higher. Therefore, direct compression was considered an unacceptable process for this formulation.
開始,對混合物進行了直壓���?����;旌衔锞鶆蚨?BU)相對標準偏差百分率(% RSD)高于6���,片劑 含量均勻度% RSD更高�。因此���,該處方的直壓工藝被認為是不可接受的���。
排除了濕法制粒由于干燥中原料藥的潛在熱降解,基于強降解研究結(jié)果�����。也排除了使用有機 溶劑的濕法制粒因為要求避免涉及的環(huán)??紤]�。對于碾壓干法制粒,原料藥的粉末顆粒和填 充劑在高壓下聚集形成帶狀物�����,然后在壓縮(壓片)前�����,通過粉碎分解產(chǎn)生顆粒���。可最大限度 減少藥物顆粒分離的風險�����。通過控制顆粒的粒度分布和流動性�,可降低片劑含量均勻度差的 風險�。因此,選擇碾壓干法制粒作為制劑進一步開發(fā)計劃的工藝���。
2.2.1.4 Formulation Development Study #1 處方開發(fā)研究#1
在因素間無潛在相互作用的情況下�,單變量法(即單次單因素(OFAT))是可接受的。 因為這經(jīng)常是未知的�,所以經(jīng)常使用多元統(tǒng)計設(shè)計(即實驗設(shè)計(DOE))并用市售可用的統(tǒng)計 軟件評估結(jié)果。當計劃DOE時���,普遍使用序貫策略���。起初���,篩選DOE可用于縮小初始風險 評估中確定為一些關(guān)鍵因素的大量的因素名單。然后�����,表征DOE可用于理解主要作用和這些 關(guān)鍵因素間的潛在相互作用。當中心點包含在2水平析因DOE中時�,檢驗曲率效應是否顯著 是可能的�����。通過從校正模型的回歸模型中分離出曲率項來進行數(shù)據(jù)分析�。如果曲率顯著,則 應增加至反應面DOE設(shè)計以估計二次項�。另一方面,如果曲率不顯著�����,則校正模型和不校正 模型是類似的���。最后���,經(jīng)驗證的DOE可用于研究系統(tǒng)的耐用性�����,通過預期在常規(guī)生產(chǎn)中遇到 的范圍內(nèi)�,變更已確定的關(guān)鍵因素�����。
隨機化�,分組和重復是統(tǒng)計實驗設(shè)計的3個基本原則�����。通過對實驗進行適宜隨機化�����,可能存 在的不可控因素可“達到平均數(shù)”���。分組是將試驗單位分為彼此類似的群(組)���。分組降低了 差異在群間的已知但無關(guān)來源,因此在研究中估計差異來源的精密度更高�。重復可估計純試 驗誤差以確定數(shù)據(jù)中觀察到的差異是否具有真實統(tǒng)計學差異���。
在該模擬例子中,我們未包含每個DOE的ANOVA結(jié)果�。實際上,請注意ANOVA結(jié)果應附有 所有的DOE數(shù)據(jù)分析���,特別是如果討論了關(guān)于模型項意義的結(jié)論���。對于所有的DOE數(shù)據(jù)分析�,選擇常用的α=0.05以區(qū)分顯著因素和非顯著因素���。
重要的是任何實驗設(shè)計具有足夠的功效以保證得出的結(jié)論是有意義的�。可通過計算信噪比來 估計功效���。如果功效低于預期水平�,則某些補救措施可用于增加功效�,例如,通過加入更多 批次�����,增加信號或減少系統(tǒng)噪音�����。請參閱 ICH 要點考慮文件���,關(guān)于藥政提交建議的 DOE 記 錄水平的指南���。
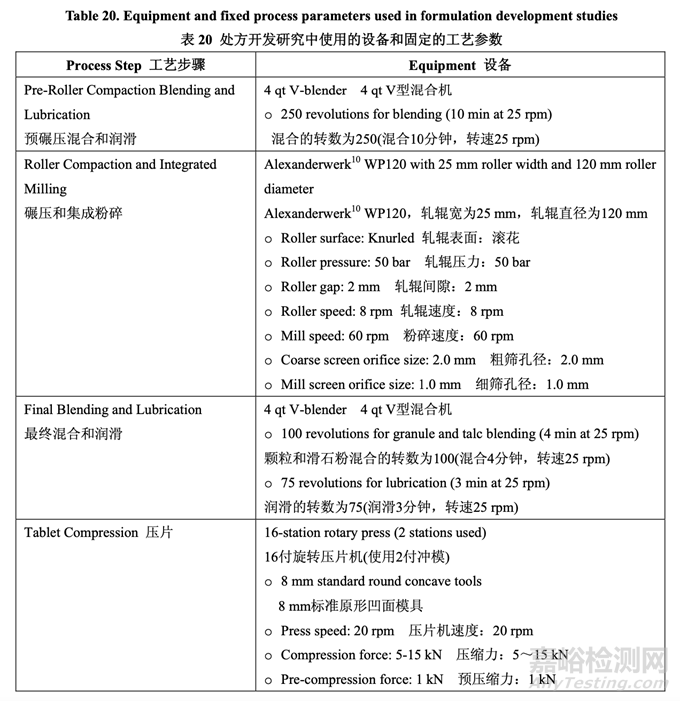
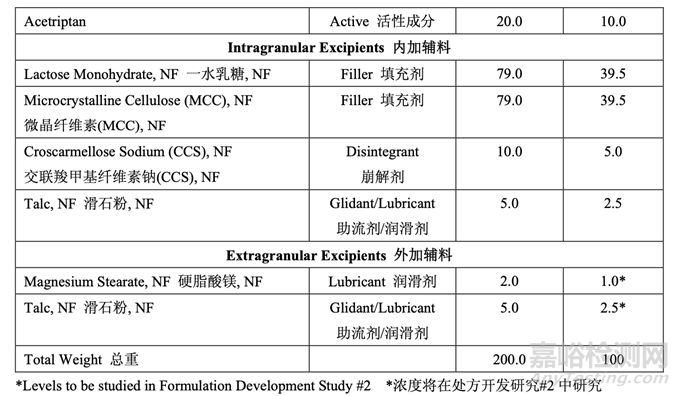
處方開發(fā)集中于初始風險評估中確定的高風險處方變量的評估�,如表 17 所示。開發(fā)在 2 個 階段進行�。第一個處方研究評估了原料藥粒度分布,MCC/乳糖比和崩解劑濃度對制劑 CQAs 的影響�����。進行第二個處方研究以理解處方中外加硬脂酸鎂和滑石粉濃度對產(chǎn)品質(zhì)量和生產(chǎn)性 的影響�。在實驗室規(guī)模(1.0 kg, 5000 單位)下進行了處方開發(fā)研究�����。表 20 詳細說明了這些研 究中使用的設(shè)備和相關(guān)的工藝參數(shù)���。
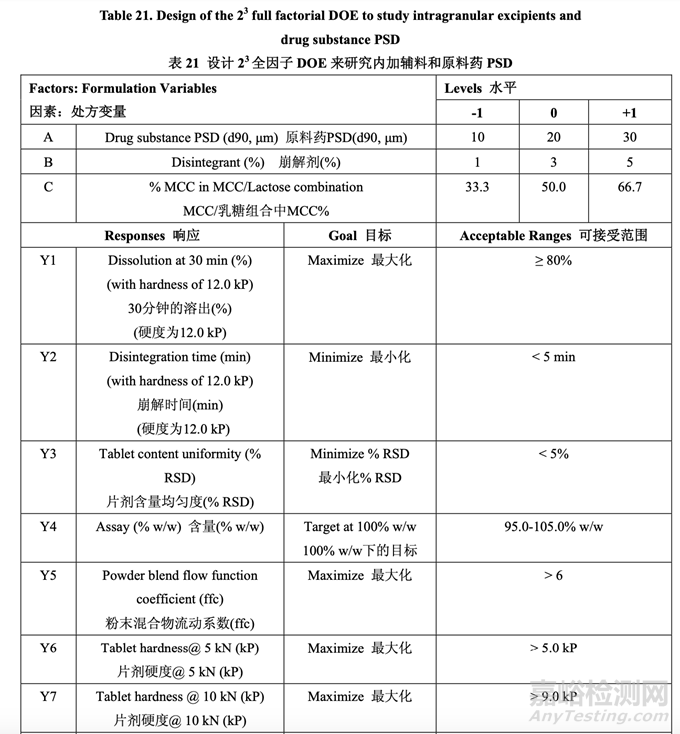
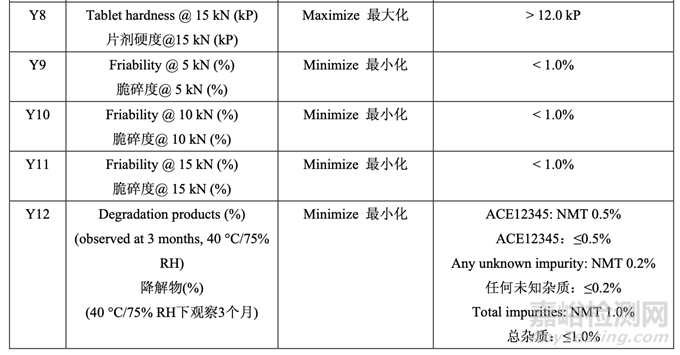
處方開發(fā)研究#1的目的是選擇MCC/乳糖比和崩解劑濃度并理解這些變量是否與原料藥粒度 分布存在相互作用���。該研究也試圖建立擬定處方的耐用性。3中心點的23全因子實驗設(shè)計 (DOE)用于研究這3個處方因素對表21所列響應變量的影響�。
這些原料藥 批的特征見表 19 并基于 2.2.1.2 節(jié)討論的計算機模擬結(jié)果而進行選擇。
以內(nèi)加方式加入崩解劑(交聯(lián)羧甲基纖維素鈉)�,研究的濃度范圍從 1%至 5%。這些濃度與RLD 處方中估計的濃度一致���,都在藥用輔料手冊推薦的范圍內(nèi)���。11
選擇用于處方研究的MCC/乳糖比是基于之前批準的使用碾壓生產(chǎn)的產(chǎn)品(ANDA 123456和 ANDA 456123)的經(jīng)驗。通過分配值為33.3%, 50.0%和66.7%分別對應于1:2, 1:1和2:1�,MCC/ 乳糖比隨MCC/乳糖二元填充劑組合中MCC百分比而轉(zhuǎn)換為連續(xù)數(shù)字變量�����。
仿制藥處方的載藥量固定為 10%�����,基于 RLD 標簽�����,規(guī)格和片重�。對于該研究,內(nèi)加和外加 滑石粉濃度都固定為2.5%�����。外加硬脂酸鎂濃度固定為1%�?��;酆陀仓徭V濃度都與RLD 處方中觀察到的濃度一致并與藥用輔料手冊公布的建議一致���。 使用的片重恒定為 200.0 mg,調(diào)整填充劑數(shù)量以達到目標重量�。
表 21 總結(jié)了研究的因素和響應�����。對于每批�����,以幾種壓縮力(僅顯示 5 kN, 10 kN 和 15 kN 的數(shù) 據(jù))壓縮混合物以得到壓縮曲線�����。使用該曲線�����,調(diào)整壓縮力來壓縮片劑達到崩解和溶出檢查 的目標硬度�。
為研究片劑目標硬度 12.0 kP (允許的范圍為 11.0~13.0 kP)下的片劑溶出,調(diào)整了壓縮力�����。 選擇片劑目標硬度 12.0 kP 以研究處方變量對溶出的影響因為高硬度預計是溶出的最壞情 況���。如果在固定壓縮力下研究溶出�,則結(jié)果可能受片劑硬度影響的混淆。
在碾壓(Y6)前���,使用環(huán)剪儀測量粉末的流動系數(shù)(ffc)�����。根據(jù)文獻�����,以下規(guī)則用于判斷粉末的 相對流動性:
ffc<3.5poor ffc<3.5 差
3.5<ffc<5.0marginal 5.0<ffc<8.0good
ffc > 8.0 excellent
3.5<ffc<5.0 合格 5.0<ffc<8.0 好
ffc > 8.0 優(yōu)
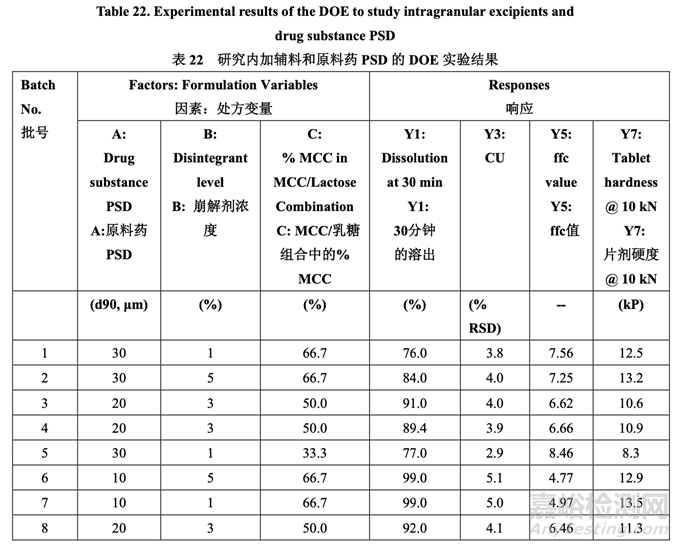
以 10 kN (Y1, Y3, Y5 和 Y7,其他響應未顯示)壓縮的溶出���,含量均勻度�����,粉末混合物流動系數(shù) 和片劑硬度的實驗結(jié)果見表 22�。
Significant factors for tablet dissolution (at 30 min) 片劑溶出(30分鐘)的顯著因素
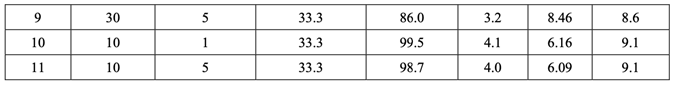
最初,使用 FDA 推薦的方法檢查溶出���。所有批顯示出快速和類似于 RLD 的溶出(30 分鐘內(nèi) 溶出> 90%)�����。然后使用內(nèi)部溶出方法再次檢查所有批(具體見 1.4 節(jié))���。結(jié)果見表 22�。因為中 心點包括在 DOE 中�����,所以使用校正模型檢驗曲率效應的意義。方差分析(ANOVA)結(jié)果見表 23�����。
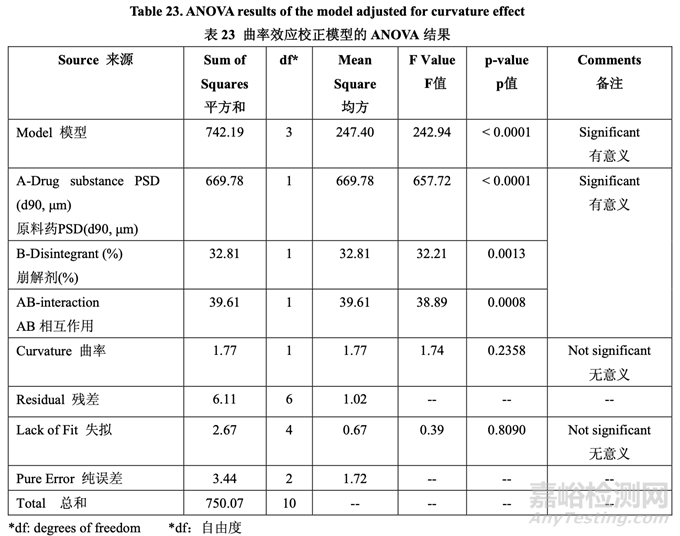
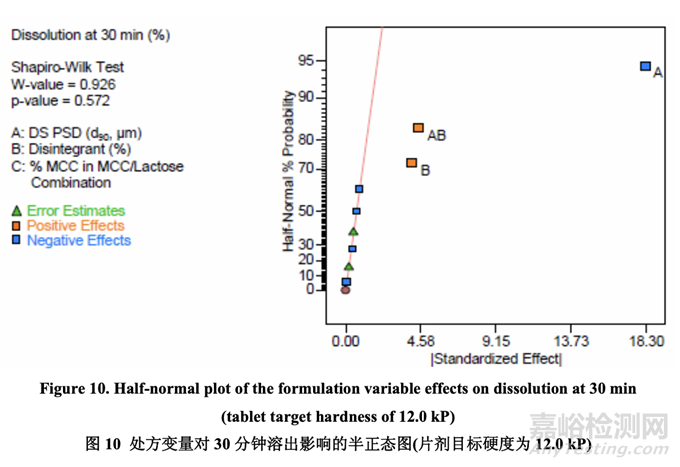
如表 23 所示���,溶出的曲率效應無意義;因此���,使用所有數(shù)據(jù)(包括中心點)來擬合因素模型 系數(shù)。如以下半正態(tài)圖(圖 10)和未校正模型的 ANOVA 結(jié)果(表 24)所示�����,影響片劑溶出的顯 著因素是 A (原料藥 PSD), B (崩解劑濃度)和 AB (原料藥 PSD 和內(nèi)加崩解劑濃度間的相互作用)�����。
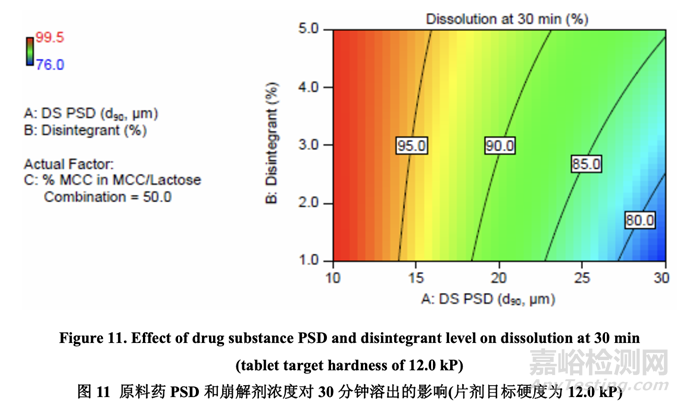
圖 11 顯示了原料藥 PSD 和崩解劑濃度對 30 分鐘時溶出的影響���。溶出隨原料藥 PSD 增加而 減少。另一方面�,溶出隨崩解劑濃度增加而增加。用較大的原料藥 PSD�,崩解劑濃度對溶 出的影響大于用較小的原料藥 PSD�。
Significant factors for tablet disintegration time 片劑崩解時間的顯著因素
崩解劑濃度是影響片劑崩解的唯一具有統(tǒng)計學意義的因素���。但是���,所有批顯示在不到4分鐘 內(nèi)快速崩解���。
Significant factors for tablet assay 片劑含量的顯著因素
所有批顯示出可接受含量(范圍為98.3~101.2%),位于質(zhì)量標準限度內(nèi)(95.0~105.0% w/w)���, 無因素顯示出對片劑含量具有顯著影響�����。
Significant factors for tablet content uniformity (%RSD) 片劑含量均勻度(%RSD)的顯著因素
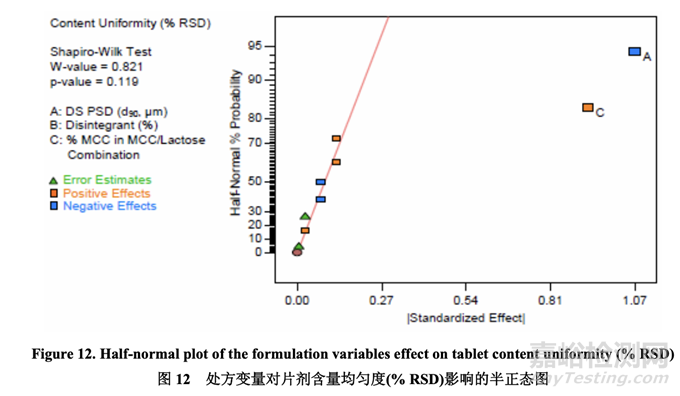
數(shù)據(jù)分析表明曲率效應對于片劑含量均勻度不顯著�����。如半正態(tài)圖(圖 12)所示���,影響片劑含量 均勻度的顯著因素是 A (原料藥 PSD) 和 C (MCC/乳糖組合中的% MCC)�。
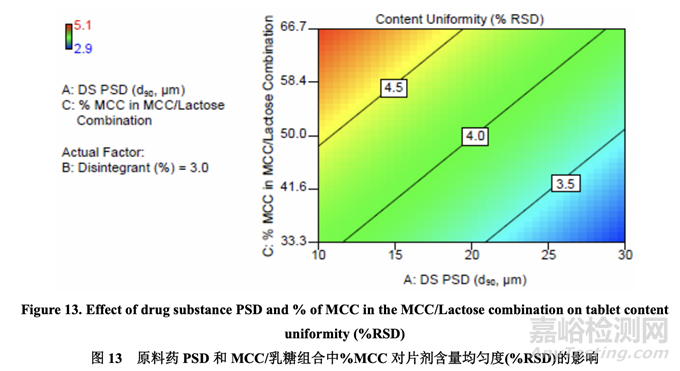
圖13顯示了原料藥PSD和MCC/乳糖組合中的% MCC對片劑含量均勻度的影響���。% RSD 隨原料藥 PSD 增加而減少。另一方面�,% RSD 隨 MCC/乳糖組合中的% MCC 增加而增加, 可能是因為 MCC 的纖維顆粒形狀與乳糖的球形顆粒形狀一樣不具有流動性�����。
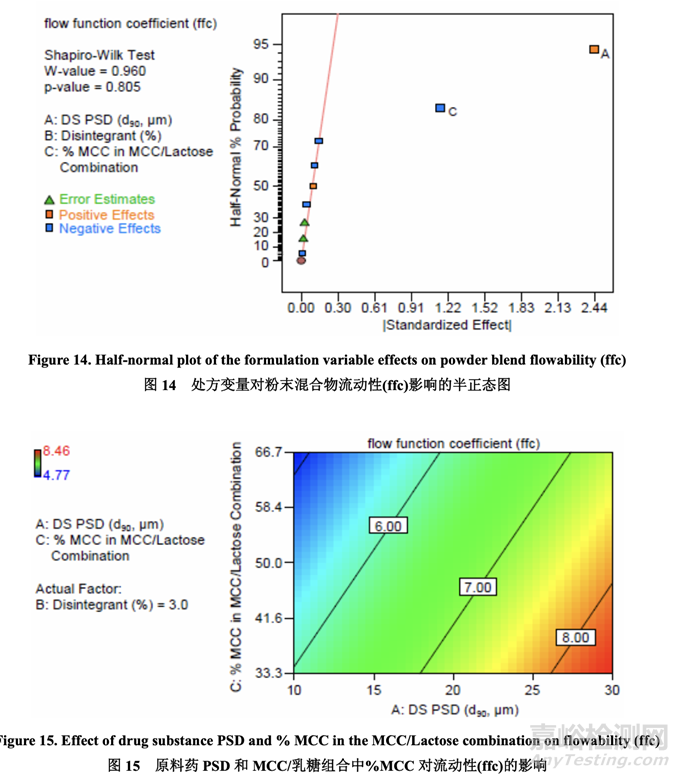
Significant factors for powder blend flowability 粉末混合物流動性的顯著因素
使用環(huán)剪儀測定每個樣品的預碾壓混合和潤滑步驟中粉末混合物的流動性(以 ffc 值表示)�����。 然后記錄每個樣品的 ffc�����。如半正態(tài)圖(圖 14)所示���,影響粉末混合物流動性的顯著因素是 A (原 料藥 PSD) 和 C (MCC/乳糖組合中的% MCC)���。原料藥 PSD 和 MCC/乳糖組合中的% MCC 對粉末混合物流動性的影響如圖 15 所示。粉末混合物流動性隨原料藥 PSD 增加而增加���,隨 MCC/乳糖組合中的% MCC 減少而增加�。
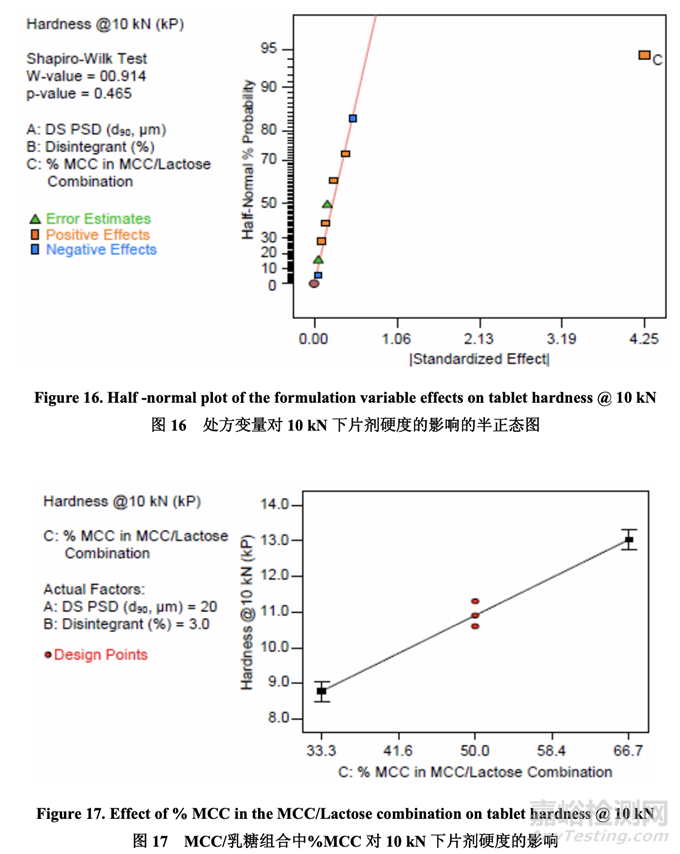
Significant factors for tablet hardness 片劑硬度的顯著因素
每個 DOE 批在 5 kN, 10 kN 和 15 kN 下壓制以評估其可壓性�����。半正態(tài)圖(圖 16)顯示�,當使用 10 kN 壓縮力時,唯一影響片劑硬度的顯著因素是 C (MCC/乳糖組合中的% MCC)�。壓縮力 為 5 kN 和 15 kN 可觀察到類似的關(guān)系(數(shù)據(jù)未顯示)。如圖 17 所示�����,在給定壓縮力下�����,片劑 硬度隨 MCC/乳糖組合中的% MCC 增加而增加�����。
Significant factors for tablet friability 片劑脆碎度的顯著因素
在5 kN, 10 kN和15 kN下壓制的所有片劑顯示出良好的脆碎度(片劑硬度范圍為5.0~12.0 kP 的重量損失< 0.2%)�����,研究范圍內(nèi)的3個處方變量未顯示出對片劑脆碎度有統(tǒng)計學意義的影 響�����。
Significant factors for tablet stability (degradation products) 片劑穩(wěn)定性(降解物)的顯著因素
40 °C/75% RH下�,將所有實驗批置于穩(wěn)定箱中的敞口容器中3個月,定期取樣并分析�����。降解 物ACE 12345���,單個未知雜質(zhì)和總雜質(zhì)都分別低于質(zhì)量標準限度0.5%, 0.2%和1.0%�����。處方變 量未顯示出對降解物有統(tǒng)計學意義的影響�����。
Summary of Formulation Development Study #1 處方開發(fā)研究#1的總結(jié)
Acetriptan PSD對片劑溶出�,含量均勻度和粉末混合物流動性有顯著影響。原料藥PSD較小 可提高溶出;但是�,它對片劑含量均勻度和混合物流動性產(chǎn)生消極影響�����。
內(nèi)加崩解劑濃度顯示出對片劑溶出有顯著影響�����,由于其與原料藥PSD的相互作用。崩解劑濃 度對溶出具有較大的影響當原料藥PSD較大時���。
MCC/乳糖組合中的% MCC對粉末混合物流動性�,片劑含量均勻度和片劑硬度有顯著影響�。 增加% MCC可增加片劑硬度但減少了粉末混合物流動性并對片劑含量均勻度產(chǎn)生消極影 響,證據(jù)是% RSD增加了�����。為平衡混合物流動性和片劑硬度�,選擇用于暫定的處方為MCC/ 乳糖組合中的50% MCC(即1:1比)�。
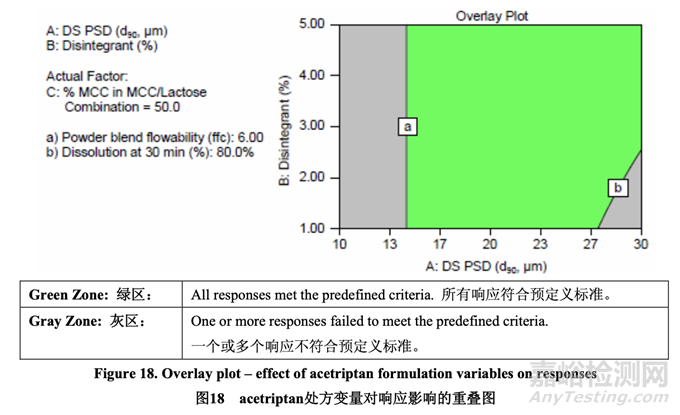
因為研究的任何響應未觀察到曲率效應�����,以及使用無重疊項的全因子DOE確定了主效應和交 換效應�����,所以無需進一步研究來優(yōu)化內(nèi)加輔料。DOE模型用于建立處方變量的可接受范圍。 圖18顯示了所有響應的重疊圖���。綠區(qū)表明所有響應都同時實現(xiàn)了�。
為容納可能最大的原料藥PSD并避免在溶出可能不合格的綠區(qū)邊緣操作�,選擇5%交聯(lián)羧甲 基纖維素鈉用于暫定處方。用所選的該崩解劑濃度�����,原料藥d90的可接受范圍為14~30 μm���。 d90低于14 μm顯示出流動性不適宜,導致片劑的含量均勻度不合格�,當在處方開發(fā)中使用固 定的生產(chǎn)工藝時。因此���,在預碾壓混合和潤滑工藝開發(fā)中進一步研究了原料藥PSD���。
為理解原料藥PSD對體內(nèi)性能的影響并確定仍可能生物等效的粒徑上限,中試BE研究中研 究了d90為20 μm, 30 μm和45 μm(相當于d50分別為12 μm, 24 μm和39 μm)的原料藥(見1.4節(jié))�。
在處方開發(fā)研究#1 結(jié)束時���,暫定了內(nèi)加輔料的濃度,如表 25 所示�。處方開發(fā)研究#2 進一步 研究了外加助流劑和潤滑劑�。
參考文獻:
Example QbD IR Tablet Module 3 Quality 3.2.P.2 Pharmaceutical Development�����,F(xiàn)DA�,2012.