FDA官網(wǎng)中一個(gè)有關(guān)藥物開發(fā)報(bào)告的實(shí)例�����,用以說(shuō)明申請(qǐng)人如何實(shí)施質(zhì)量源于設(shè)計(jì)(QbD)。 該實(shí)例的目的是說(shuō)明ANDA申請(qǐng)人在其仿制藥開發(fā)過(guò)程中實(shí)施QbD時(shí)���,可使用的藥物開發(fā)研究的類型�����,同時(shí)促進(jìn)探討OGD在審評(píng)中如何使用該信息��。
本文主要概述了處方開發(fā)的案例2��。
2.2.1.5 Formulation Development Study #2 處方開發(fā)研究#2
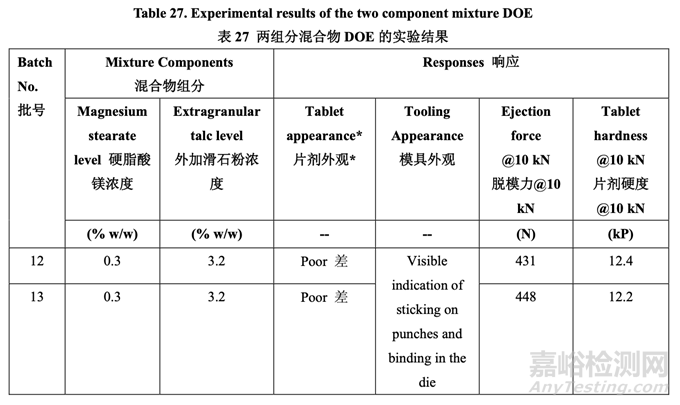
基于處方開發(fā)研究#1 的結(jié)果���,暫定了內(nèi)加輔料濃度�����。但是���,硬脂酸鎂在二元輔料相容性研 究中與 acetriptan 形成加合物有關(guān)(見(jiàn) 2.1.1.2 節(jié))。該研究的目的是找出用于壓片所需的外加 硬脂酸鎂最小濃度并評(píng)估增加滑石粉是否可彌補(bǔ)硬脂酸鎂的減少��。處方開發(fā)研究#1 使用的 外加硬脂酸鎂濃度為 1.0%���。藥用輔料手冊(cè)中推薦的最小濃度為 0.25%��。因此���,在 0.3%~ 0.9%范圍內(nèi)研究外加硬脂酸鎂濃度?����;蹪舛认鄳?yīng)地調(diào)整以保持使用兩組分混合物 DOE 的總外加助流劑和潤(rùn)滑劑為 3.5%�����。
使用表 20 所列的碾壓工藝參數(shù)生產(chǎn)了一批 5.0 kg 的顆粒。使用表 25 所示的處方制作顆粒�����。 然后該批顆粒分為 6 個(gè)亞批次���,按照表 27 所示的組分加入不同數(shù)量的硬脂酸鎂和滑石粉�����。 使用10 kN壓縮力將最終混合物壓制成片��。固定壓縮力(10 kN)下的片劑外觀��,模具外觀, 片劑脫模力和硬度的實(shí)驗(yàn)結(jié)果(Y1, Y2, Y3 和 Y4, 其他響應(yīng)未顯示)見(jiàn)表 27�����。
Tablet and tooling appearance 片劑和模具外觀
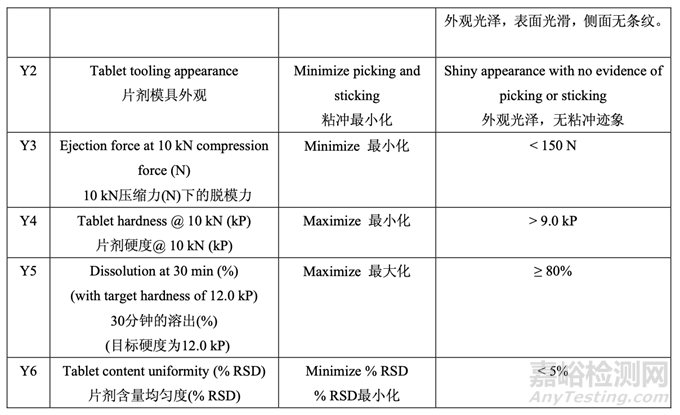
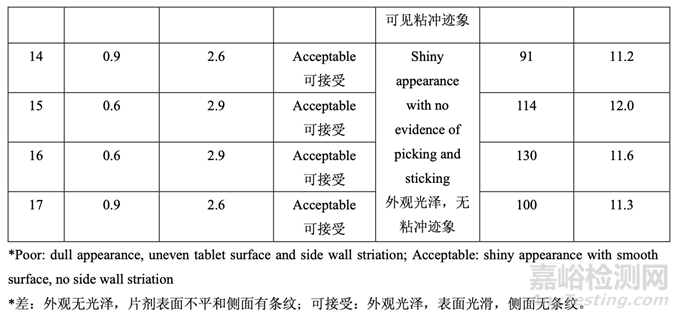
用 0.3%硬脂酸鎂�����,觀察到顯著與壓縮相關(guān)的問(wèn)題,如片劑粘沖和側(cè)面條紋��。但是�����,用 0.6% 或更高的硬脂酸鎂���,片劑外觀優(yōu)美�����,未顯示出粘附或粘連片劑模具�����。
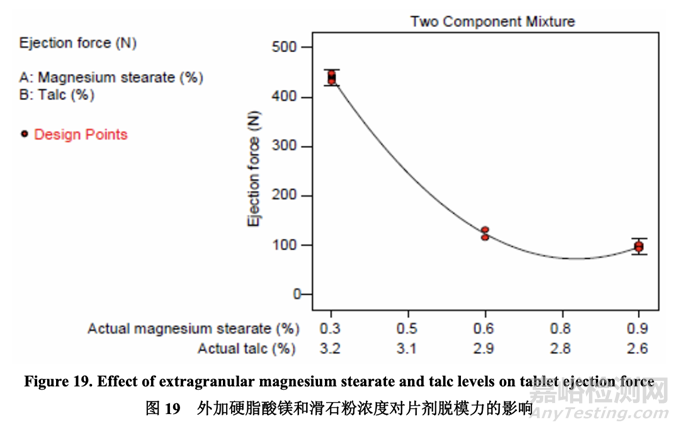
Ejection force 脫模力
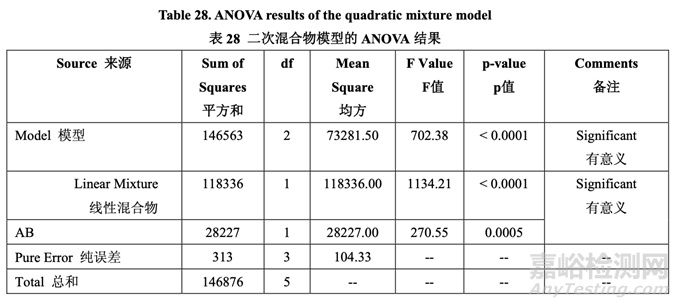
表28提供的ANOVA結(jié)果表明線性混合物組分和二次項(xiàng)(AB)是顯著的��。圖19顯示了混合物 組分對(duì)脫模力的影響�����。
用0.3%硬脂酸鎂�����,觀察到顯著較高的脫模力:脫模力隨硬脂酸鎂增加而減少;但是�����,一旦 濃度為0.6%~0.9%��,則影響可忽略不計(jì)���。
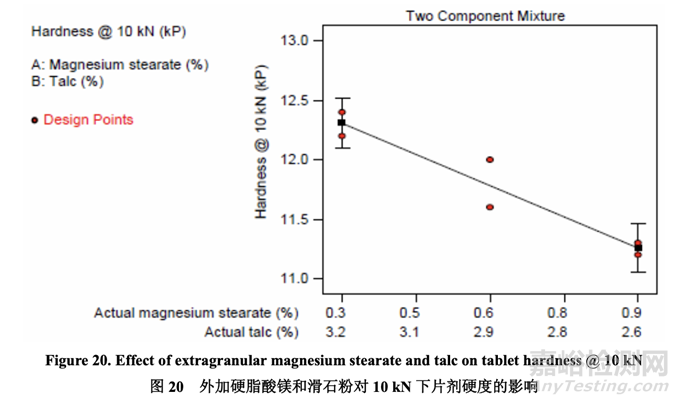
Tablet Hardness 片劑硬度
圖 20 說(shuō)明了混合物組分對(duì)片劑硬度的影響���。壓縮力固定為 10 kN 下,觀察到片劑硬度隨硬 脂酸鎂增加而減少���。
Dissolution and Content Uniformity 溶出和含量均勻度
所有片劑��,即使硬度為12.0 kP的片劑��,顯示出可接受的溶出(> 85%���,30 min)���。含量均勻度 不是問(wèn)題當(dāng)每批的% RSD<3%時(shí)�����。因此���,硬脂酸鎂和滑石粉在研究的范圍內(nèi)顯示出對(duì)片劑溶 出和含量均勻度無(wú)任何顯著影響�����。
Summary of Formulation Development Study #2 處方開發(fā)研究#2的總結(jié)
基于處方開發(fā)研究#2 的結(jié)果��,外加硬脂酸鎂和滑石粉濃度分別固定為 0.6%和 2.9%�����。
2.2.1.6 Formulation Development Conclusions 處方開發(fā)結(jié)論
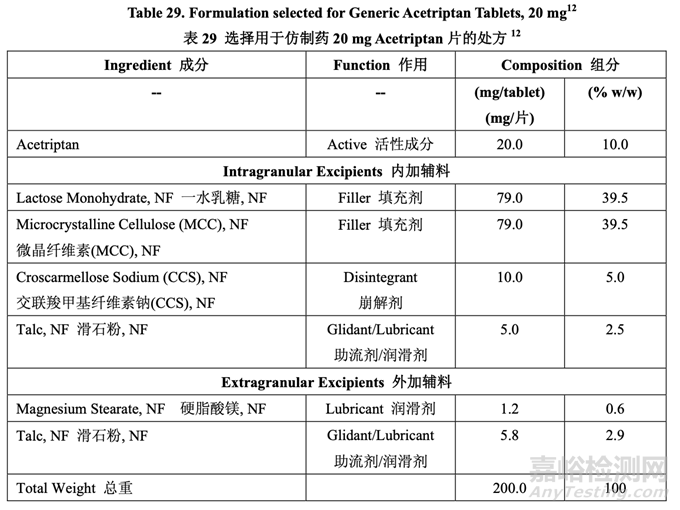
基于處方開發(fā)研究#1 和#2���,最終確定了處方組分。第一個(gè)研究最終確定了 MCC/乳糖比和崩 解劑濃度�����。第二個(gè)研究中�����,得出的結(jié)論是處方中需要最低濃度的硬脂酸鎂以防止粘沖。通過(guò) 與滑石粉一起使用來(lái)降低處方中硬脂酸鎂濃度�����。仿制藥 20 mg Acetriptan 片的最終處方見(jiàn)表 29��。
2.2.1.7 Updated Risk Assessment of the Formulation Variables 更新的處方變量風(fēng)險(xiǎn)評(píng)估
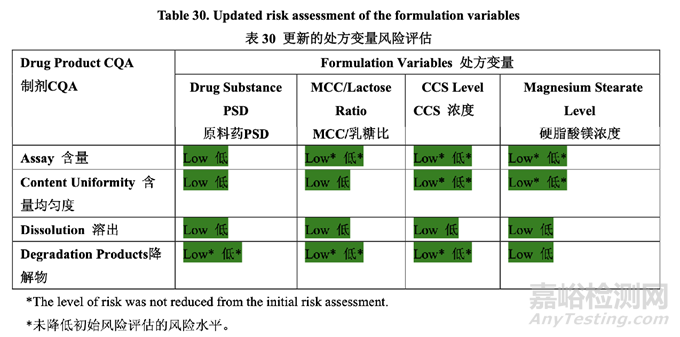
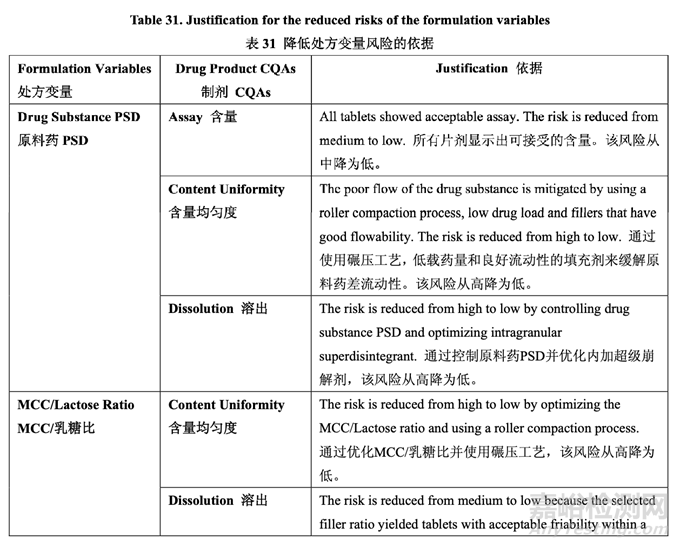
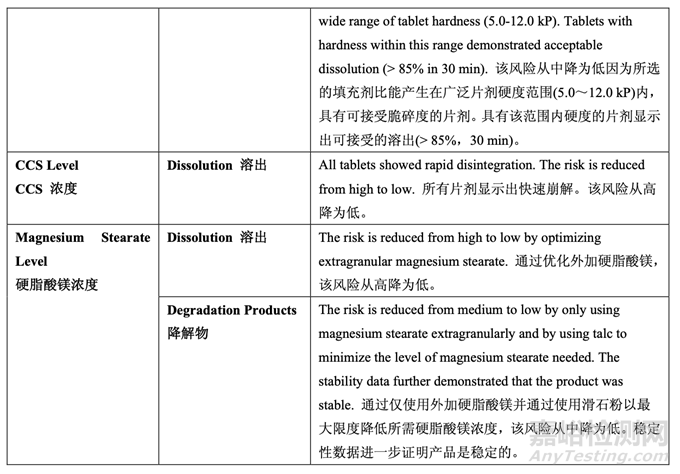
確定了高風(fēng)險(xiǎn)處方變量的可接受范圍并包括在控制策略中���?�;谔幏介_發(fā)研究的結(jié)果��,更新 了處方變量的風(fēng)險(xiǎn)評(píng)估���,見(jiàn)表 30,依據(jù)見(jiàn)表 31��。
2.2.2 Overages 過(guò)量投料
在仿制藥20 mg Acetriptan片處方中未使用過(guò)量投料
2.2.3 Physicochemical and Biological Properties理化和生物學(xué)性質(zhì)
對(duì)于溶出開發(fā)方法的討論和中試生物等效性研究的結(jié)果��,請(qǐng)參閱 1.4 節(jié)��。
參考文獻(xiàn):
Example QbD IR Tablet Module 3 Quality 3.2.P.2 Pharmaceutical Development��,F(xiàn)DA���,2012.