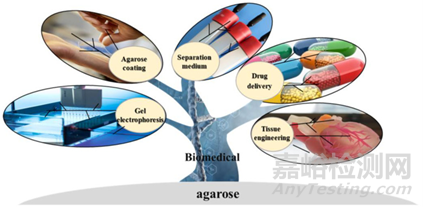
瓊脂糖作為一種具有優(yōu)異生物相容性的天然來源多糖,在生物醫(yī)藥領(lǐng)域中可以作為一種良好的載藥/控釋材料�����。目前,采用生物/物理/化學(xué)修飾方法�����,改變瓊脂糖的分子結(jié)構(gòu)可以獲得良好的性能擴(kuò)展��。瓊脂糖基的生物材料可以應(yīng)用于藥物遞送�����、組織工程�����、分離和包被敷料等一系列領(lǐng)域�����。
圖1:瓊脂糖基生物材料在生物醫(yī)藥領(lǐng)域中的應(yīng)用前景
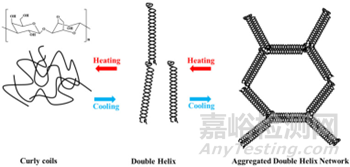
瓊脂糖是從紅藻中提取的一種線性天然多糖�����,分子量在80-140kDa之間���。在溫度90℃以上時(shí)�����,瓊脂糖結(jié)構(gòu)單元之間的氫鍵斷裂��,瓊脂糖分散到水中形成透明溶液���;當(dāng)溫度降至30-40°C時(shí)���,瓊脂糖的分子鏈通過氫鍵交織在一起,形成緊密排列形成凝膠的雙螺旋結(jié)構(gòu)���。
圖2:瓊脂糖的結(jié)構(gòu)和其形成膠凝的機(jī)制示意圖
天然基質(zhì)的藥物遞送載體�����,如殼聚糖���、纖維素和淀粉等廣泛受到人們的關(guān)注���。殼聚糖存在需要在酸性介質(zhì)中溶解��、孔徑均一性較難控制等問題���,纖維素存在水溶性和熱塑性差問題�����,淀粉水溶很高而難用于藥物緩釋中�����,且存在機(jī)械性能差的問題��。瓊脂具有相當(dāng)?shù)恼硰椇蜔崴苄?����,非常適合用于控制藥物的釋放���。
化藥
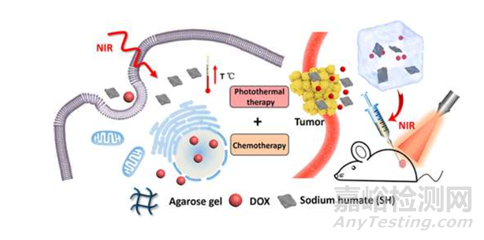
以癌癥應(yīng)用為例�����,腫瘤它不僅僅是一個(gè)腫塊���,是由腫瘤細(xì)胞所組成���,腫瘤細(xì)胞被包括免疫細(xì)胞�����、腫瘤干細(xì)胞在內(nèi)的一系列基質(zhì)所包圍�����?�;?����、放療和手術(shù)這些常見的治療方法往往具有包括劑量高��、副作用大和特異性差在內(nèi)的諸多缺點(diǎn)�����?����;诰酆衔锇邢蜻f送藥物體系(水凝膠�����、納米顆粒等)可以最大化解決上述問題�����。
圖3:腐植酸鈉(sodium humate)和阿霉素(doxorubicin)的組合可注射熱響應(yīng)瓊脂糖水凝膠技術(shù)�����,誘導(dǎo)化療和光熱治療
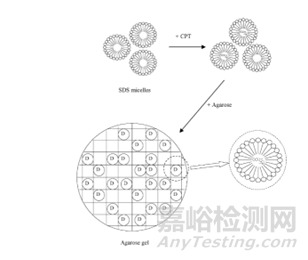
水凝膠一般是高度親水的�����,而許多化療藥物往往具有疏水性���,那么怎么來解決這個(gè)問題呢��?表面活性劑(吐溫80�����、泊洛沙姆和十二烷基硫酸鈉)這些兩親性物質(zhì)的加入可以使得藥物在水凝膠中得到良好分布�����。
圖4:十二烷基硫酸鈉(SDS)提高了瓊脂中喜樹堿(CPT)的負(fù)載能力示意圖
核酸藥物
核酸治療藥物包括基于DNA修飾的DNA藥物(例如基于病毒載體的體內(nèi)基因治療藥物��、體外基因治療藥物��、裸質(zhì)粒藥物等)與RNA藥物(例如反義寡核苷酸藥物(ASO)�����、siRNA藥物和mRNA基因治療等)��,這些藥物的體內(nèi)降解,靶向差��,細(xì)胞的攝取吸收是值得注意問題�����。
目前比較成熟的遞送系統(tǒng)為GalNAC(N-乙酰半乳糖胺)遞送系統(tǒng)和LNP��。GalNAc是去唾液酸糖蛋白受體(ASGPR)的高親和力靶向配體�����,ASGPR是一種內(nèi)吞性受體,在肝細(xì)胞的膜表面上高度特異性地表達(dá)�����。ASGPR和網(wǎng)格蛋白介導(dǎo)的內(nèi)吞作用可以有效地將GalNAc從細(xì)胞表面轉(zhuǎn)運(yùn)至細(xì)胞質(zhì)�����。2018年LNP首次作為siRNA載體出現(xiàn)在人們視野中�����,因新冠疫情作為疫苗載體而被人們熟知�����。目前�����,F(xiàn)DA批準(zhǔn)上市的核酸藥物及其遞送系統(tǒng)中未見任何凝膠輔料。
表1:FDA批準(zhǔn)上市的核酸藥物及其遞送系統(tǒng)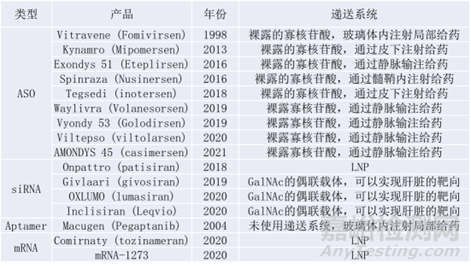
那么��,凝膠或者說瓊脂糖基生物材料真的不適用于核酸藥物嗎?已有研究表明���,瓊脂糖納米載體可用于遞送核酸(DNA)�����。
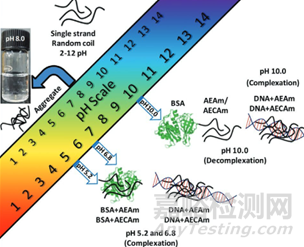
圖5:pH敏感的氨基酸修飾的瓊脂糖納米載體用于遞送核酸(DNA)�����。其中�����,AEAm和AECAm為修飾后的瓊脂糖���,藥物在酸性條件結(jié)合,堿性條件釋放
蛋白類藥物
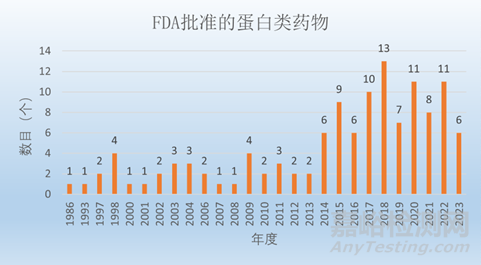
蛋白質(zhì)類藥物在過去的幾十年里有了顯著的發(fā)展�����,并在醫(yī)學(xué)的許多領(lǐng)域發(fā)揮了重要作用���。1986年鼠源單抗 Orthoclone OKT3 (防止腎臟移植后的宿主排斥)是第一個(gè)被美國FDA批準(zhǔn)的蛋白類藥物��,至今已有200款左右的蛋白類(單抗���、多抗和ADC)藥物上市。目前���,上述蛋白類藥物為注射給藥為主。
圖6:FDA批準(zhǔn)上市的蛋白類藥物(數(shù)據(jù)截止2023年上半年)
蛋白質(zhì)療法通常需要在很長一段時(shí)間內(nèi)重復(fù)給藥���。蛋白質(zhì)的不穩(wěn)定性是開發(fā)其控制和持續(xù)釋放系統(tǒng)的主要障礙��。許多系統(tǒng)(脂質(zhì)體�����、膠束等)以期望將蛋白藥物進(jìn)行體內(nèi)遞送�����,但是往往也避免不了網(wǎng)狀內(nèi)皮系統(tǒng)的捕獲�����。聚合制劑常見于原位凝膠制劑輔料,聚合物如PLGA的降解會(huì)釋放酸性副產(chǎn)物(乳酸和乙醇酸)而誘導(dǎo)炎癥�����,降低產(chǎn)品功效���。針對蛋白藥物,PLGA羧酸端基的存在可以與被封裝蛋白的正電荷相互作用��,改變甚至阻止其釋放��;而且治療性蛋白暴露在酸性pH下會(huì)誘導(dǎo)其聚集或影響其活性�����。(不可否認(rèn)的是,PLGA許多凝膠制劑的領(lǐng)頭羊�����,在藥物遞送系統(tǒng)體系下具有廣闊的市場前景)
表2:FDA批準(zhǔn)上市的原位凝膠藥物
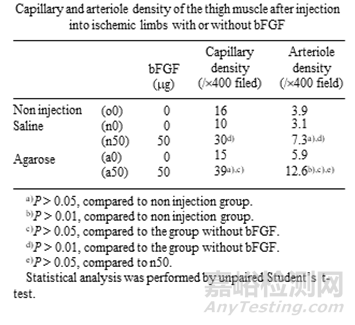
實(shí)際上�����,很早以前就已經(jīng)有人開發(fā)和表征蛋白質(zhì)類注射藥物在瓊脂糖水凝膠中的載藥系統(tǒng)��。成纖維細(xì)胞生長因子(bFGF)是通常用于組織再生或血管生成的生長因子之一,Moribe K 等人通過乳化/凝膠化的方法制備了瓊脂糖凝膠顆粒作為bFGF的緩釋載體或儲(chǔ)庫��,且bFGF的瓊脂糖水凝膠顆粒增強(qiáng)了血管生成功效��。
表3:bFGF的瓊脂糖水凝膠顆粒增強(qiáng)了血管生成功效
瓊脂糖基材料在藥物遞送中具有初始爆發(fā)釋放而不是持續(xù)控釋階段問題,瓊脂糖基材料的功能化來改造藥物遞送體系���,可以解決其在緩釋/受控體系應(yīng)用中受限的問題��。
圖7:多層功能化瓊脂糖基水凝膠控制蛋白釋放
細(xì)胞類藥物
瓊脂糖很少用于細(xì)胞移植�����,但是它們可以保護(hù)細(xì)胞免受惡劣生理?xiàng)l件的影響的潛在益處��。含有瓊脂基生物材料的3D培養(yǎng)提供了模擬各種生理相關(guān)的情況�����,并且可以在臨床前試驗(yàn)中最小化動(dòng)物模型的使用���。
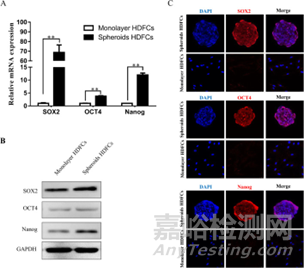
圖8:基于瓊脂糖的球狀體培養(yǎng)在體外增強(qiáng)了人牙泡細(xì)胞(HDFC)的干性。注:Sox2���、Oct4 和Nanog 是維持干細(xì)胞多能性和干性的重要轉(zhuǎn)錄因子
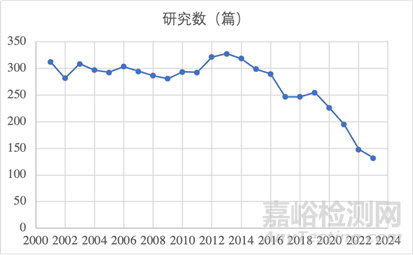
圖9: Pubmed以“((drug) OR (delivery)) AND (agarose)”為關(guān)鍵搜索到的文章篇數(shù)
以研究數(shù)來看��,瓊脂糖基凝膠遞送研究熱度在減(圖9)�����,但瓊脂糖基生物材料因其獨(dú)特的理化性質(zhì)而顯示出巨大的應(yīng)用潛力���,特別是在藥物遞送的研究中��。但是不可否認(rèn)的是瓊脂糖基生物材料存在降解速率慢�����、溶解溫度高�����、某些藥物的吸附/解吸速度慢等問題�����。當(dāng)然,同其他天然基質(zhì)類似�����,經(jīng)過修飾后的瓊脂會(huì)具有更出色的藥物遞送應(yīng)用���,瓊脂糖基生物材料以及改良的瓊脂糖基生物材料的實(shí)際應(yīng)用仍還有很長一段路要走���。
Reference
1. https://doi.org/10.1016/j.ejps.2005.02.013.
2. https://doi.org/ 10.1021/acsbiomaterials.8b01147.
3. https://doi.org/10.1002/macp.201900201.
4. https://doi.org/10.3109/10837459709022618.
5. https://doi.org/10.1080/10837450802309661.
6. https://doi.org/10.1016/j.carbpol.2013.12.069
7. https://doi.org/10.1007/s11626-021-00591-5
8. https://doi.org/10.3390/md21050299