在新加坡市場銷售您的醫(yī)療器械產(chǎn)品之前,您需要在新加坡HSA取得產(chǎn)品的注冊�。
1、簡介
新加坡的醫(yī)療器械注冊由HSA(Health Sciences Authority )相關(guān)部門負(fù)責(zé)�����。
當(dāng)?shù)貓?zhí)行的主要法規(guī)為《Health Products Act 2007》�����,《 Health Products (Medical Devices) Regulations 2010》等�����。另外作為東盟ASEAN成員國���,新加坡也會參考東盟的相關(guān)法規(guī)。
首先新加坡以外的生產(chǎn)商需要指定授權(quán)在新加坡本地的代理公司作為持證人(License Holder)�����,提交注冊文件�,與當(dāng)局溝通 ���,以及對上市后等活動負(fù)責(zé)���。
注冊申請可以在線通過MEDICS(Medical Device Information and Communication System)進(jìn)行提交。當(dāng)局批準(zhǔn)后���,會列入SMDR(Singapore Medical Device Register)數(shù)據(jù)庫�。
2�、產(chǎn)品風(fēng)險(xiǎn)等級分類
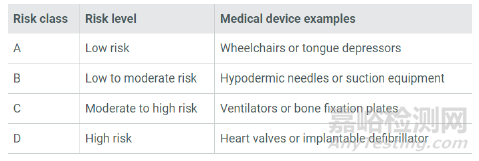
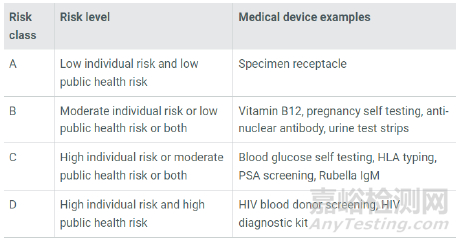
醫(yī)療器械的風(fēng)險(xiǎn)分類取決于產(chǎn)品的設(shè)計(jì)和預(yù)期用途�。新加坡將醫(yī)療器械(包括IVD)根據(jù)風(fēng)險(xiǎn)由低至高分為A���、B���、C、D四類�����。A類風(fēng)險(xiǎn)最低���,D類風(fēng)險(xiǎn)最高。
MD
IVD
3�����、注冊路徑
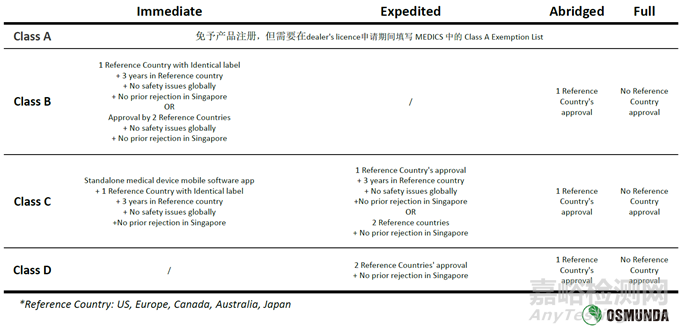
新加坡當(dāng)局認(rèn)可的參考國家(Reference Country)為美國�����、加拿大���、澳大利亞���、日本以及歐盟。
根據(jù)產(chǎn)品風(fēng)險(xiǎn)分類以及該產(chǎn)品在參考國家的上市情況�����,總共有四種不同的注冊路徑:Immediate���、Expedited、Abridged以及Full�����??傮w上來說���,同一產(chǎn)品在越多的參考國家獲得上市許可�����,則在新加坡注冊的流程越簡單快捷�。
對于一些創(chuàng)新性產(chǎn)品�,在一定條件下新加坡當(dāng)局也可提供優(yōu)先個(gè)案審核���,也會加快約25%的審批時(shí)間�����。
4�、技術(shù)要求
新加坡當(dāng)局對于注冊技術(shù)文件的要求基于東盟ASEAN CSDT(Common Submission Dossier Template)�����,例如符合性聲明(Declaration of Conformity)�����、產(chǎn)品的描述�、產(chǎn)品標(biāo)簽�����、風(fēng)險(xiǎn)分析�、臨床評價(jià)報(bào)告(Clinical Evaluation Report)、質(zhì)量管理體系(QMS)相關(guān)文件等�����。不同風(fēng)險(xiǎn)分類和不同注冊路徑所需的技術(shù)文件不同�����。
對于質(zhì)量管理體系���,新加坡當(dāng)局可以接受ISO13485、MDSAP�����、美國當(dāng)局的審核(Conformity to US FDA Quality System Regulation)���、或日本當(dāng)局的審核(Japan MHLW Ordinance 169)。
5���、官方審批時(shí)間
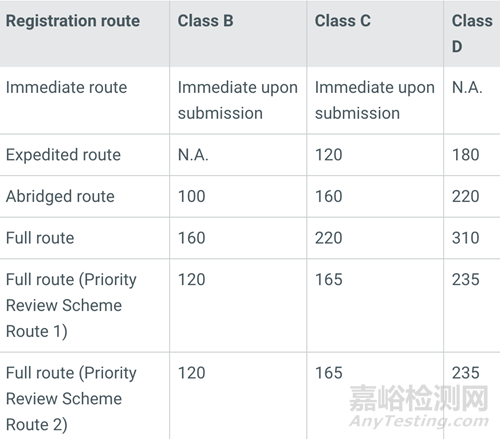
不同分類及不同注冊路徑所需要的時(shí)間及費(fèi)用不同�。例如A類產(chǎn)品可以免予注冊,時(shí)間最短�、費(fèi)用也最低�。而對于高風(fēng)險(xiǎn)產(chǎn)品,注冊時(shí)間可能需要200-300天�,官方費(fèi)用根據(jù)注冊的路徑不同大約需要1-2萬美元���。
同一生產(chǎn)商的相同產(chǎn)品、或需要共同使用的產(chǎn)品�,可以以Grouping形式提交注冊,從而來節(jié)約時(shí)間和費(fèi)用成本�。