由于解剖組織的復(fù)雜和分層結(jié)構(gòu)���,建立多組織耳廓移植來治療小耳畸形是一個(gè)挑戰(zhàn)���。為此,蘇黎世聯(lián)邦理工學(xué)院Marcy Zenobi-Wong及其團(tuán)隊(duì)提出了一種利用洗脫瓊脂糖模具進(jìn)行異質(zhì)��、多層和人體規(guī)模的組織移植的3D生物制造的新型鑄造技術(shù)���。這些模具通過將瓊脂糖鑄造到定制的3D打印容器中生成��,稱為元模�����,優(yōu)化以促進(jìn)基于幾何和拓?fù)浼s束的水凝膠鑄造過程���。鑄造產(chǎn)生高分辨率(50 μm),并允許在移植上鑄造進(jìn)一步的水凝膠層���。多層耳廓結(jié)構(gòu)是在由透明質(zhì)酸-海藻酸鹽雙網(wǎng)絡(luò)和相鄰的明膠基真皮層組成的軟骨核心上制造的��。通過各層之間殘余官能團(tuán)的正交物理和酶交聯(lián)來實(shí)現(xiàn)相鄰層之間的鍵合�����。為每一層都成為軟骨和預(yù)血管化的真皮組織優(yōu)化了材料組成和培養(yǎng)時(shí)間��。為了證明這種技術(shù)在人類大小移植物的生物制造中的可伸縮性���,鑄造了雙層人類大小的耳朵�����?����?偟膩碚f�����,這種新鑄造技術(shù)為復(fù)雜組織移植物的制造提供了一種很有前途的方法��,克服了其他傳統(tǒng)生物制造方法的局限性。
相關(guān)研究?jī)?nèi)容以“Biofabrication of Heterogeneous, Multi-Layered, and Human-Scale Tissue Transplants Using Eluting Mold Casting”為題于2023年10月28日發(fā)表在《Advanced Healthcare Materials》��。
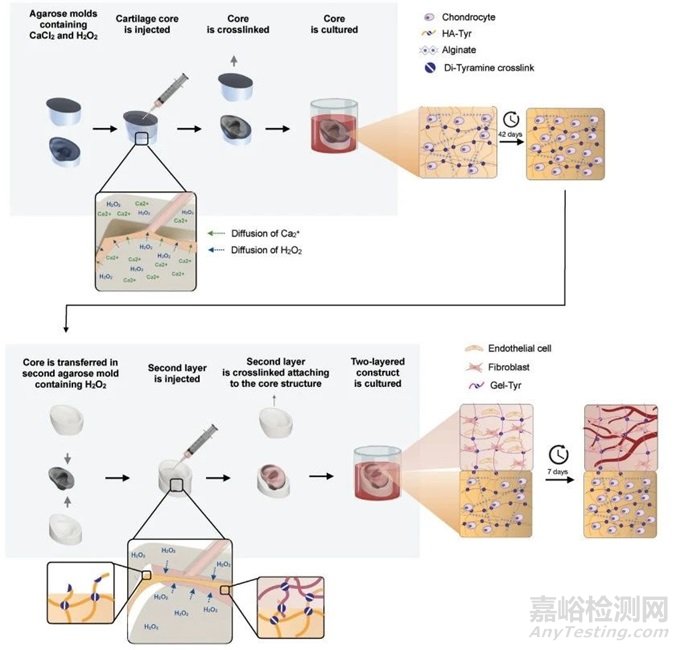
圖1 實(shí)驗(yàn)概述
本研究介紹了一種新的鑄造技術(shù),用于生物制造非均勻雙層結(jié)構(gòu)�����,包括無血管軟骨核心和預(yù)血管化的真皮層�����。所提出的技術(shù)基于使用3D DLP打印的元模具生成多部分瓊脂糖模具���。使用低濃度的瓊脂糖(3% w/v)制備瓊脂糖模具���,并預(yù)裝氯化鈣(CaCl2)和過氧化氫(H2O2),分別用于海藻酸鹽的離子交聯(lián)和酪胺修飾的透明質(zhì)酸和明膠-水凝膠的共價(jià)交聯(lián)�����。隨后將細(xì)胞水凝膠前體溶液澆鑄到連續(xù)的瓊脂糖模具中��,可以精確地生成多層水凝膠���。為了展示這種技術(shù)的可擴(kuò)展性和潛力�����,本研究制作了一個(gè)雙層的�����、人體大小的耳移植手術(shù)(圖1)�����。耳廓軟骨的核心結(jié)構(gòu)是通過將人耳廓軟骨細(xì)胞封裝在由高分子量透明質(zhì)酸酪胺(HA-Tyr)和海藻酸鹽(Alg)制成的水凝膠中而產(chǎn)生的�����。通過將HUVECs和原代人真皮成纖維細(xì)胞包裹在明膠酪胺(Gel-Tyr)水凝膠中形成模擬真皮層���。這種生物正交策略維持透明軟骨的無血管特性��,同時(shí)也支持鄰近真皮組織層的微毛細(xì)血管網(wǎng)絡(luò)的發(fā)展���。生產(chǎn)針對(duì)患者的模具設(shè)計(jì)可能性和這種技術(shù)的多層和可擴(kuò)展的方法,使洗脫模具成為制造具有廣泛細(xì)胞密度的人體大小的組織和器官的一個(gè)有吸引力的解決方案�����。
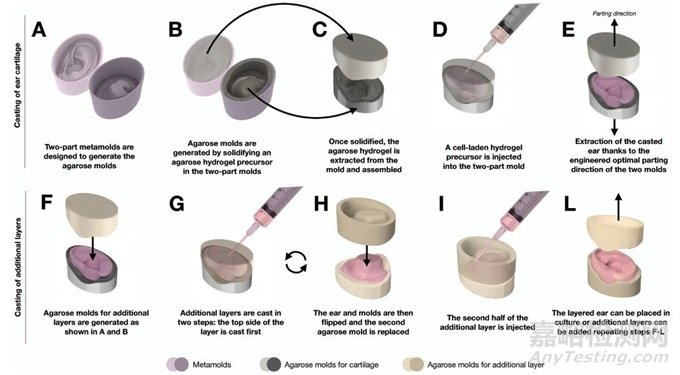
圖2 模具的制作
找到最佳的去除方向后生成一組稱為元模的塑料模具(圖2A)��,其中注入熔融的瓊脂糖聚合物溶液并冷卻到室溫���,以制造一個(gè)瓊脂糖模具(圖2B)��。接下來�����,從元模中提取瓊脂糖模具并進(jìn)行組裝(圖2C)���。使用注射器將充滿細(xì)胞的水凝膠前體溶液注入到組裝好的模具中(圖2D)。根據(jù)模具設(shè)計(jì)�����,兩個(gè)模具可以很容易地分離�����,以顯示鑄造植入物(圖2E)���。隨后的圖層可以用同樣的方法添加到植入體中(圖2F-L):對(duì)新層重復(fù)這個(gè)過程��,從頂部開始���,分離方向保持不變�����。為了鑄造該層的第二部分��,去掉底部模具���,換上一個(gè)新模具,并重復(fù)這個(gè)過程(圖2F-L)��。
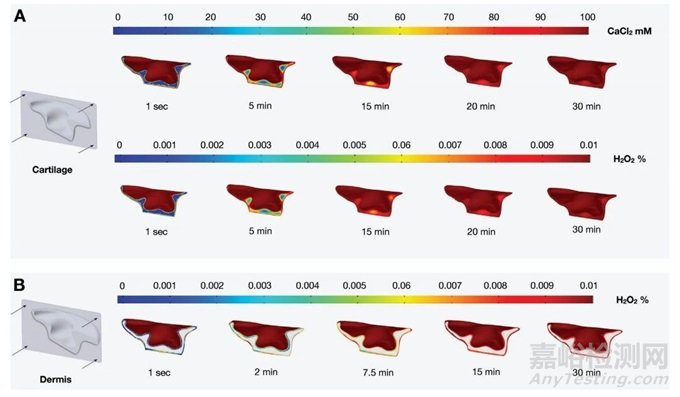
圖3 模擬100 mMCaCl2和0.01%H2O2從瓊脂糖模具擴(kuò)散到鑄造水凝膠中的有限元分析
為了估計(jì)每一層交聯(lián)所需的時(shí)間���,在COMSOL多物理學(xué)中建立了有限元分析(FEA)模擬(圖3)��。圖3A分別顯示100 mMCaCl2和0.01%H2O2隨時(shí)間的擴(kuò)散情況���。模擬估計(jì),100 mMCaCl2完全擴(kuò)散到鑄型軟骨結(jié)構(gòu)的時(shí)間為30 min�����,0.01%H2O2的時(shí)間為20 min��。圖3B顯示了對(duì)第二層鑄造的相同模擬。在這種情況下��,鑄造材料的交聯(lián)只需要H2O2��。
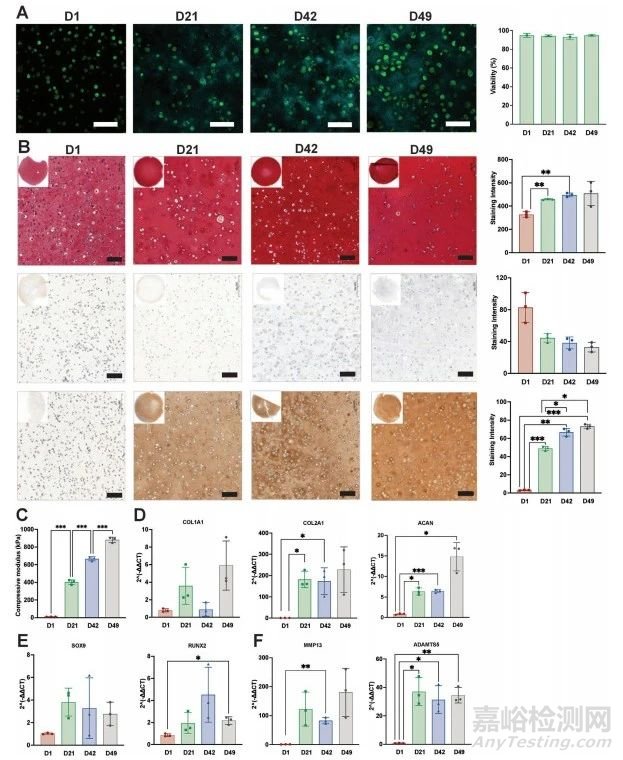
圖4 軟骨對(duì)照組的體外特性研究
圖4A��、B顯示了條件2與30×106細(xì)胞mL−1在49天內(nèi)的軟骨生成潛能���。在所有時(shí)間點(diǎn),細(xì)胞保持超過93%的活力(圖4C)�����。使用基于免疫組織學(xué)染色的強(qiáng)度定量���,可以對(duì)樣本中糖胺聚糖(GAGs)和膠原的沉積進(jìn)行半定量評(píng)估(圖4D)�����。壓縮測(cè)試顯示���,在49天的培養(yǎng)期間,樣品的剛度穩(wěn)定且顯著增加(圖4E)���。RT-qPCR數(shù)據(jù)證實(shí)�����,I型膠原(COL1A1)基因的表達(dá)在選定的時(shí)間點(diǎn)上沒有顯著增加(圖4F)�����。相反�����,軟骨細(xì)胞外基質(zhì)(ECM)的標(biāo)志基因II型膠原(COL2A1)和聚集蛋白聚糖(ACAN)隨著時(shí)間的推移表現(xiàn)出顯著上調(diào)(圖4F)��。
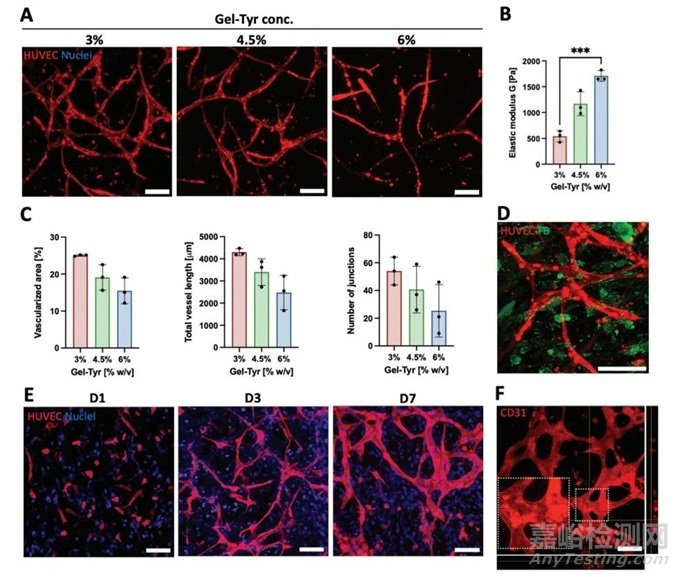
圖5 血管化真皮控制的體外特性研究
3%和4.5%的條件允許在3D基質(zhì)中實(shí)現(xiàn)血管網(wǎng)絡(luò)的快速發(fā)展(圖5A)��。不受限的壓縮測(cè)量結(jié)果顯示��,隨著聚合物含量的增加��,彈性模量持續(xù)增加���,在6%的Gel-Tyr條件下���,其彈性模量為1709±102Pa(圖5B)���。在3%和6%的Gel-Tyr條件下,血管化面積和總血管長(zhǎng)度有顯著差異(圖5C)���。使用CD90(Thy-1)/CD31共染色證實(shí)CD90+成纖維細(xì)胞和微毛細(xì)血管的共定位(圖5D)��。長(zhǎng)期的構(gòu)建培養(yǎng)導(dǎo)致高度互聯(lián)的毛細(xì)血管網(wǎng)絡(luò)形成(圖5E)��。7天后,管腔形成清晰可見(圖5F)��。
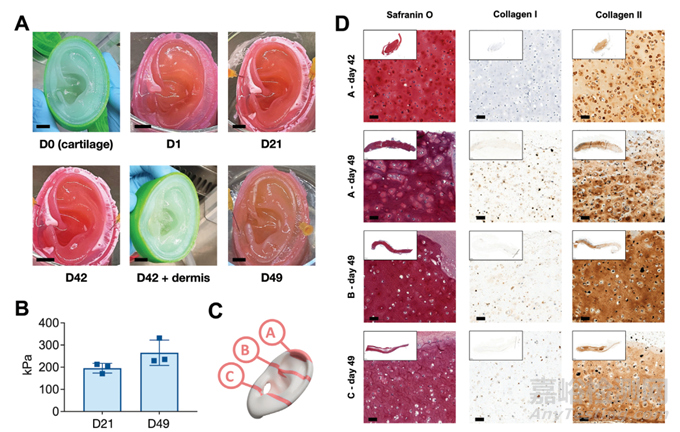
圖6 人形多層耳的鑄造
為了展示元模技術(shù)的可擴(kuò)展性和潛力�����,制作了一種兩層的�����、人體大小的耳移植技術(shù)��。從耳廓軟骨核心開始�����,從內(nèi)到外鑄造(圖6A)。交聯(lián)是由CaCl2和H2O2從瓊脂糖模具擴(kuò)散到注入的聚合物溶液中���,持續(xù)30 min后引發(fā)的(圖6A)�����。在這兩個(gè)步驟之間��,通過允許H2O2從瓊脂糖模具中擴(kuò)散�����,使聚合物溶液交聯(lián)15 min(圖6A)���。最后,丟棄頂部瓊脂糖模具���,而底部瓊脂糖模具在培養(yǎng)過程中作為多層結(jié)構(gòu)的靜息表面(圖6A)���。如圖6A所示,由于瓊脂糖模具��,在整個(gè)49天的培養(yǎng)期間觀察到良好的形狀保留,因?yàn)榄傊悄>咴谄鋭偠容^低的初始時(shí)間點(diǎn)支撐多層耳的懸垂��。在最后的時(shí)間點(diǎn)�����,使用手術(shù)刀在軟骨和真皮層的界面進(jìn)行一個(gè)精確的切口��,以評(píng)估軟骨核心壓縮模量的增加(圖6B)���。在最后的時(shí)間點(diǎn)�����,使用組織學(xué)分析評(píng)估來自成熟耳結(jié)構(gòu)不同部位的3個(gè)區(qū)域(圖6C)。如圖6D所示�����,所產(chǎn)生的軟骨質(zhì)量最佳�����,GAGs和II型膠原染色強(qiáng)��,而I型膠原染色缺失。
綜上所述�����,本研究采用一種基于先進(jìn)鑄造策略的新型生物制造方法��,采用洗脫模具制造大型組織移植�����。與傳統(tǒng)鑄造方法相比�����,該方法能夠生物制造更復(fù)雜的結(jié)構(gòu)��,包括由不同材料和細(xì)胞類型組成的不同層���。由于沒有嚴(yán)格的流變學(xué)要求���,這種新的生物制造方法允許使用廣泛的生物材料。不同的材料和單元類型可以以分層的方式組合���,獨(dú)立于所選擇的設(shè)計(jì)��。這項(xiàng)工作中為這項(xiàng)技術(shù)提供了概念證明��,使用兩種不同的水凝膠和多種細(xì)胞類型的生物制造人類大小的負(fù)載細(xì)胞結(jié)構(gòu)�����。未來的工作將集中于對(duì)鑄造后的每一層進(jìn)行更密集的表征���,以及改善如此大結(jié)構(gòu)的培養(yǎng)條件���,以減輕通過瓊脂糖模具的擴(kuò)散極限的影響。這可以使用定制的塑料網(wǎng)格支撐來實(shí)現(xiàn)��,以保留結(jié)構(gòu)而不引入物理屏障�����。
文章來源:https://doi.org/10.1002/adfm.202305651