今日頭條
天港醫(yī)諾創(chuàng)新靶點單抗獲批臨床����。天港醫(yī)諾自研新型免疫檢查點單抗藥物TGI-5獲FDA臨床許可��。TGI-5能夠同時恢復NK細胞和T細胞的抗癌免疫功能��。在臨床前研究中����,該抗體在肝癌�、結(jié)直腸癌、黑色素瘤等動物模型中表現(xiàn)出強大的抗腫瘤活性����;TGI-5聯(lián)合PD-1療法也具有協(xié)同抗癌潛力����。目前,國內(nèi)外尚無同靶點的產(chǎn)品獲批上市�。
國內(nèi)藥訊
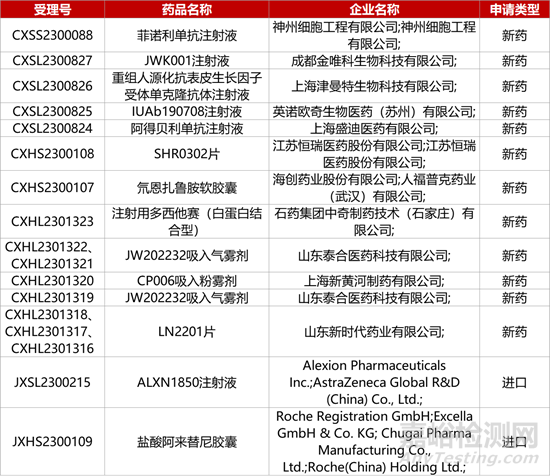
1.恒瑞JAK1抑制劑新適應癥報產(chǎn)��。恒瑞1類化藥SHR0302片的上市申請獲CDE受理�,推測申報的適應癥為“用于類風濕關節(jié)炎的治療”��。SHR0302是一款JAK1抑制劑����,可通過抑制JAK1信號傳導發(fā)揮抗炎和抑制免疫的生物學效應�。此前,SHR0302已向CDE遞交用于治療中重度特應性皮炎(AD)和活動性強直性脊柱炎(AS)的新藥申請�。
2.神州細胞PD-1單抗報產(chǎn)。神州細胞旗下神州細胞工程開發(fā)的PD-1單抗菲諾利單抗注射液(SCT-I10A)的上市申請獲CDE受理����,用于治療頭頸部鱗狀細胞癌。目前�,該產(chǎn)品已開展多項臨床試驗����,其中包括一線治療復發(fā)性和/或轉(zhuǎn)移性頭頸部鱗狀細胞癌的Ⅲ期臨床研究、一線治療晚期肝細胞癌的Ⅱ/Ⅲ期試驗����、二線治療晚期肺鱗癌的Ⅲ期臨床研究等�。
3.亞虹膀胱癌診斷顯影劑中國報產(chǎn)。亞虹醫(yī)藥與PhotocureASA聯(lián)合開發(fā)的5.1類化藥“灌注用鹽酸氨酮戊酸己酯”的上市申請獲CDE受理����,應用于膀胱癌診斷和管理��。APL-1706是一款顯影劑類藥物����,聯(lián)合使用APL-1706和藍光膀胱鏡(BLC)作為非肌層浸潤性膀胱癌(NMIBC)管理的方法已被納入全球?qū)<夜沧R指南。在III期臨床中��,與標準白光膀胱鏡(WLC)相比��,APL-1706聯(lián)合BLC額外檢出一個或多個膀胱癌病灶的患者比例達到43.3%(p<0.0001)����。
4.濟民可信KRAS抑制劑擬納入突破性品種�。濟民可信KRAS抑制劑JMKX001899(JMKX1899)片獲CDE擬納入突破性治療品種��,用于治療KRAS G12C突變的晚期或轉(zhuǎn)移性非小細胞肺癌��。JMKX1899通過與KRAS(G12C)結(jié)合以抑制下游通路的激活�,抑制胞外調(diào)節(jié)蛋白激酶(ERK)磷酸化�,阻止腫瘤細胞的增殖和生長,促進細胞凋亡����。2021年11月,濟民可信已將JMKX1899的大中華區(qū)以外的獨家權益授予滬亞生物國際����。
5.羅氏CD20/3雙抗擬納入優(yōu)先審評。羅氏CD20/CD3雙特異性抗體RO7030816獲CDE擬納入優(yōu)先審評��,用于三線及以上治療復發(fā)或難治性濾泡性淋巴瘤(FL)�。Lunsumio(RO7030816)是全球首個獲批的CD20/CD3雙抗����,可為這類復發(fā)或難治性FL患者提供一種無化療、現(xiàn)貨型的新免疫治療選擇��;該產(chǎn)品通過靜脈輸注給藥����,可應用于門診����。在Ⅱ期GO29781研究中,RO7030816達到80%的客觀緩解率��。
6.泰諾麥博破傷風抗體擬納入優(yōu)先審評��。泰諾麥博自主研發(fā)的重組抗破傷風毒素(TT)天然全人源單抗TNM002注射液獲CDE擬納入優(yōu)先審評�,用于被動免疫預防成人破傷風感染。該產(chǎn)品無需額外皮試����,給藥12小時及超過100天后的“末次訪視”時�,血藥濃度均超過“破傷風保護效價”�。此前,該產(chǎn)品已被CDE納入突破性治療品種�。去年8月�,F(xiàn)DA授予TNM002快速通道資格。
7.上海醫(yī)藥溶瘤病毒獲批實體瘤臨床����。上海醫(yī)藥從亦諾微醫(yī)藥引進的“T3011皰疹病毒注射液”獲國家藥監(jiān)局臨床試驗默示許可��,擬開發(fā)用于晚期實體瘤的治療��。T3011是基于對野生HSV-I型皰疹病毒骨架的全新設計開發(fā)�,確保病毒在腫瘤細胞內(nèi)擁有強勁的復制能力的同時,在正常細胞內(nèi)復制能力得到抑制��,實現(xiàn)最優(yōu)減毒效果��。上海醫(yī)藥擁有該產(chǎn)品在大中華區(qū)的獨家開發(fā)和商業(yè)化權益。
國際藥訊
1.Karuna公司精神分裂癥新藥報NDA��。Karuna公司口服M1/M4型毒蕈堿型乙酰膽堿受體激動劑KarXT(xanomeline-trospium)的上市申請獲FDA受理�,用于治療成人精神分裂癥��,PDUFA日期為明年9月26日����。在EMERGENT系列研究中��,KarXT均達到主要終點��,KarXT治療患者的陽性和陰性綜合征量表 (PANSS) 總分的降低較安慰劑均具有統(tǒng)計學顯著性�。再鼎醫(yī)藥擁有該新藥在大中華區(qū)的獨家權益�。
2.艾伯維c-Met靶向ADC肺癌Ⅱ期臨床積極。艾伯維靶向c-Met的ADC新藥telisotuzumab-vedotin(Teliso-V)治療c-Met過表達����、EGFR野生型��、晚期/轉(zhuǎn)移性非鱗狀非小細胞肺癌(NSCLC)的Ⅱ期LUMINOSITY試驗結(jié)果積極����。在c-Met高度表達和中度表達的患者中�,獨立中心審評(ICR)評估的緩解率分別為35%和23%����,中位緩解持續(xù)時間分別為9個月和7.2個月,中位總生存期分別為14.6個月和14.2個月�。Teliso-V總體耐受性良好��。
3.眼用貝伐珠單抗擬明年重報BLA�。基于與FDA在A類會議中的溝通結(jié)果��,Outlook公司宣布其貝伐珠單抗眼用制劑ONS-5010將開展一項為期3個月的非劣效性研究����,評估ONS-5010與雷珠單抗治療初治濕性年齡相關性黃斑變性(wAMD)患者的療效和安全性�。Outlook公司計劃在2024年年底前重新提交ONS-5010用于治療wAMD的BLA。原研貝伐珠單抗(Avastin)是羅氏開發(fā)的一種抗VEGF-A單抗����,目前只適用于腫瘤患者�。
4.BI超5億美元布局難治性癌癥新靶點��。勃林格殷格翰與Phenomic AI公司將利用后者scTx單細胞轉(zhuǎn)錄組學平臺和靶標識別和間質(zhì)生物學方面的專長,合作開發(fā)靶向富含間質(zhì)(stroma rich)癌癥的候選療法����。根據(jù)協(xié)議,Phenomic負責靶點的發(fā)現(xiàn)并驗證�,將獲得900萬美元的前期和近期付款,超過5億美元的臨床��、監(jiān)管和商業(yè)里程碑付款��;勃林格殷格翰將負責所有非臨床和臨床開發(fā)��,以及相關癌癥療法的商業(yè)化�。
5.RASP抑制劑干眼癥NDA遭拒�。Aldeyra公司小分子反應性醛類物質(zhì)(RASP)抑制劑Reproxalap滴眼液用于治療干眼癥的上市申請(NDA)收到FDA的完整回復函(CRL)�。FDA要求該公司至少補充一項額外的充分且對照良好的研究,以證明該產(chǎn)品對干眼癥的眼部癥狀有積極的治療效果��。目前����,Aldeyra已提交一項干燥眼室交叉臨床試驗(擬議試驗)的特殊方案評估(SPA)。預計可在2024年上半年獲得關鍵結(jié)果����。
6.FDA調(diào)查CAR-T治療患者繼發(fā)性癌癥風險。FDA生物制劑部門將開展對CAR-T細胞療法的繼發(fā)性癌癥風險的進一步調(diào)查�。自2017年首批CAR-T療法以來,F(xiàn)DA收到19例來自臨床試驗和上市后不良事件(AE)報告�。報告顯示��,接受CD19�、BCMA靶點的自體CAR-T治療的部分患者出現(xiàn)T細胞惡性腫瘤的嚴重風險,甚至造成一些嚴重的患者住院或死亡����。報告涉及的六款產(chǎn)品包括吉利德Yescarta和Tecartus��,諾華Kymriah�,百時美施貴寶Breyanzi和Abecma和傳奇生物Carvykti�。
醫(yī)藥熱點
1.阿斯利康肺癌事業(yè)部一把手換人�。根據(jù)多家媒體報道,阿斯利康中國副總裁����、腫瘤肺癌事業(yè)部負責人劉明由于個人發(fā)展原因��,決定離開阿斯利康中國����。阿斯利康中國官網(wǎng)已無法查找到劉明的相關信息����。原輝瑞疫苗事業(yè)部總經(jīng)理張凌燕將于12月1日加入阿斯利康��,擔任中國區(qū)副總裁����、腫瘤肺癌事業(yè)部負責人。
2.快走可降低患Ⅱ型糖尿病風險�。伊朗塞姆南醫(yī)學與衛(wèi)生服務大學研究人員最新發(fā)表在《英國運動醫(yī)學雜志》網(wǎng)站上的一項最新研究顯示�,無論步行時間有多長,與步速低于3公里/小時的人相比�,平均或正常步速為3—5公里/小時的人患Ⅱ型糖尿病的風險降低15%。同樣����,以5—6公里/小時的速度快走����,Ⅱ型糖尿病的風險降低24%�。快走或以超過6公里/小時的速度大步行走��,風險降低約39%��,相當于每100人中Ⅱ型糖尿病病例減少2.24例��。
評審動態(tài)
1. CDE新藥受理情況(11月30日)
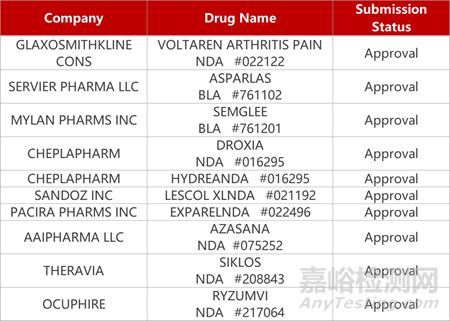
2. FDA新藥獲批情況(北美11月29日)