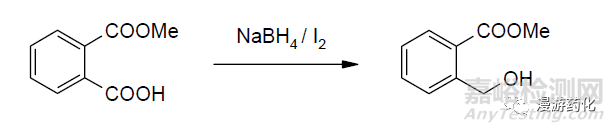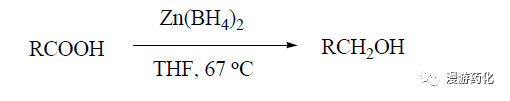羧酸及羧酸酯的還原是有機化學(xué)中的一類重要反應(yīng),有著廣泛的用途���。羧酸酯一般來說比較容易還原成伯醇��,常用方法為氫化鋁鋰����、硼氫化鈉�����、硼氫化鋰等����。而羧酸的活性比羧酸酯低得多����,是種較難還原的物質(zhì)�����,常用氫化鋁鋰作為還原劑���。但是,氫化鋁鋰作為還原劑���,選擇性較差��,容易將底物種其它官能團還原掉��。硼烷還原也是一種還原羧酸的重要方法�����,對于脂肪酸和多數(shù)芳香酸有很好的還原效果���,但對于某些芳香酸來說反應(yīng)速度很慢甚至不反應(yīng)。近來���,羧酸及羧酸酯的還原研究有了迅速發(fā)展�,不斷有新的還原方法被發(fā)現(xiàn)。本文結(jié)合本實驗室近幾個月來進行的多種羧酸及羧酸酯的還原��,對一些羧酸及羧酸酯的還原體系作一簡單概括����。
1. 羧酸酯的還原
羧酸酯一般來說比較容易還原成伯醇,常用方法為氫化鋁鋰���、硼氫化鈉��、硼氫化鋰等����,也可以用Na-EtOH 體系���,但是后者目前只是在工業(yè)上廣泛應(yīng)用����,實驗室中已經(jīng)很少采用����。
1.1 氫化鋁鋰還原羧酸酯成醇
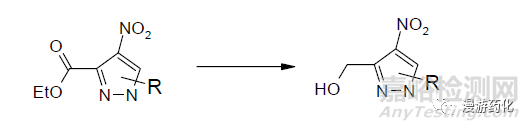
氫化鋁鋰是還原羧酸酯的常用試劑�����。但是,該試劑能還原多種官能團��,因此選擇性較差�����。但可以通過降低反應(yīng)溫度���、加入無水AlCl3�����、用烷基或烷氧基取代氫化鋁鋰的氫原子等方法降低氫化鋁鋰的還原能力�,從而實現(xiàn)選擇性還原����。實驗中我們遇到一個如下的雜環(huán)進行還原。用NaBH4�����、LiBH4 進行還原�,原料很快反應(yīng)完了�����,但是雜環(huán)同時也被還原了���,降低溫度則不反應(yīng)。嘗試將酯水解成酸后用BH3·Me2S 進行還原����,回流很久也不反應(yīng)。后來嘗試用LiAlH4 在零下20 度時進行還原���,取得了比較理想的效果���,雜環(huán)和硝基都得到了保留,只有酯基被還原���。
1.2 硼氫化鈉還原羧酸酯成醇
NaBH4 還原羧酸酯是我們常用的方法����,因為該反應(yīng)操作簡單而且比較安全��,對無水條件要求不是很苛刻���,活性高的底物幾個小時即可反應(yīng)徹底��。但由于硼氫化鈉還原性不夠強�����,有些活性較低的底物室溫下過夜也只能反應(yīng)一部分��,這時就需要加熱回流�����。
1.3 NaBH4/I2����、NaBH4/AlCl3����、NaBH4/ZnCl2 體系還原羧酸酯成醇
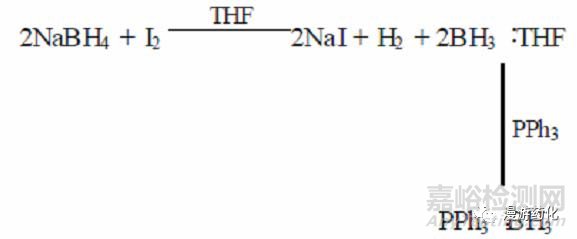
單純使用NaBH4 還原酯的效果較差,但是加入單質(zhì)碘或Lewis 酸如AlCl3�����、ZnCl2�����、BF3 后可使NaBH4 的還原能力大大提高,甚至某些活性較低的酯也可以順利還原�。Bhaskar 等發(fā)現(xiàn),如0℃時把I2 加入到硼氫化鈉的四氫呋喃溶液中���,反應(yīng)2.5h 之后加入羧酸酯�,很容易將酯還原成醇��,產(chǎn)率達85 %~98 %����。研究者通過向反應(yīng)體系內(nèi)加入Ph3P 以捕捉BH3 的方法指出,按此加入順序所進行的反應(yīng)中真正起還原作用的是硼烷:
此外�����, NaBH4/I2 體系還能成功地還原酰胺和腈�����。
1.4 硼氫化鋰還原羧酸酯成醇
一般來說���,硼氫化鋰和硼氫化鈉的還原能力和底物適應(yīng)范圍差不多���。但是我們在實驗中遇到一底物,使用硼氫化鈉還原時氯原子很快就水解了���,即使在無水溶劑中氯原子也是很快就掉�;使用LiAlH4 在低溫下還原���,反應(yīng)很雜�����。后來嘗試用硼氫化鋰進行還原����,取得了較好的結(jié)果�。但是反應(yīng)時間不能太長,不等原料反應(yīng)完就要淬滅處理��,否則氯原子也會逐漸水解�����。
2. 羧酸的還原
羧酸比羧酸酯活性低得多。常用的還原方法為氫化鋁鋰�、硼烷、硼氫化鈉�、硼氫化鉀等。
2.1 氫化鋁鋰還原羧酸成醇
氫化鋁鋰可以還原羧酸成醇���,對于多數(shù)底物來說產(chǎn)率較高��,是還原羧酸最常見的方法�。但是����,氫化鋁鋰作為還原劑選擇性較差,往往是羧基和其它官能團都被還原���;另一方面��,氫化鋁鋰價格昂貴�����,對試劑的無水處理要求非常嚴格�����,使其實際應(yīng)用尤其是工業(yè)化應(yīng)用中受到限制��。由于羧基活性較低����,在零下20 度以下用LiAlH4 還原羧基時反應(yīng)很慢甚至不反應(yīng),所以一般不用降低反應(yīng)溫度的方法來避免還原其他基團�����。
2.2 硼烷還原羧酸成醇
硼烷是一種較強的還原劑�����,室溫下即可把多數(shù)羧酸還原成醇�����,而且具有較好的選擇性��?�?刂婆鹜榈挠昧坎⒃诘蜏叵路磻?yīng)���,可以避免還原分子中的氰基和酯基���。硼烷對于脂肪酸和多數(shù)芳香酸有很好的還原效果,但對于某些芳香酸來說反應(yīng)速度很慢甚至不反應(yīng)�。例如在1.1 中提到的那個底物,水解后得到的羧酸用過量的BH3·Me2S 在無水THF中回流6 小時也不發(fā)生反應(yīng)�����。
另外��,硼烷還非常容易還原醛�����、酮���、環(huán)氧化物及內(nèi)酯等��,但還原酯的反應(yīng)比較緩慢���,對芳香酸酯幾乎不發(fā)生反應(yīng),同樣條件下不能還原酰氯��、硝基化合物及砜���。
2.3 NaBH4/I2 體系還原羧酸酯成醇
硼氫化鈉一般只能還原醛���、酮�����、酰鹵和內(nèi)酯�����,很難還原羧酸�����。但其與碘組成的還原體系卻是還原羧酸的優(yōu)良試劑。Bhaskar 等研究了通常的一元酸�����、α, β-不飽和酸�����、羧酸酯以及二元酸與NaBH4/I2 體系的還原反應(yīng)���。實驗操作時把硼氫化鈉加入到羧酸中�����,待體系放出氫氣后再加入碘��。結(jié)果表明�����,上述一元酸被還原的產(chǎn)率均很高�����,達到92 %~98 % ; α, β-不飽和酸經(jīng)還原可得相應(yīng)的α, β-不飽和醇�����,雙鍵不被還原����;羧基和酯基共存時只有羧基被還原,即使二者取代位置距離很近時也是如此����。
2.4 Zn(BH4)2 還原羧酸酯成醇
大多數(shù)金屬硼化物不能直接還原羧酸���,需加入其它試劑如AlCl3、I2 等以提高其還原性��。然而�����,Zn(BH4)2 作為一種溫和還原劑�����,很容易把脂肪酸和芳香酸還原成醇�����。整個反應(yīng)只需化學(xué)計量的硼氫化鋅即可完成�����,醇的產(chǎn)率達80 %~95 %���。反應(yīng)式如下:
羧酸與硼氫化鋅反應(yīng),首先生成酰氧基硼氫化物中間體�,硼氫化鋅能將此中間體還原成醇���,因此能將羧酸順利還原成醇。羧酸分子中有溴�、氯、硝基等官能團時�,這些基團不發(fā)生反應(yīng),但碳碳雙鍵要發(fā)生硼氫化反應(yīng)�����。
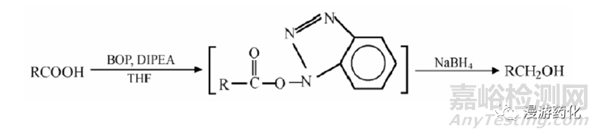
2.5 NaBH4/BOP 體系還原羧酸酯成醇
羧基較難還原�����,因此將羧酸還原成醇的另一途徑是把羧酸先轉(zhuǎn)化成其他活潑衍生物���,然后再用硼氫化鈉還原���。1998 年McGeary 報道了用BOP、DIPEA 和硼氫化鈉一步將羧酸還原成醇的反應(yīng)����。通過對一系列羧酸還原反應(yīng)的研究發(fā)現(xiàn),該體系還原能力很強,對脂肪酸�����、芳香酸以及高位阻酸(如金剛烷基甲酸)都能高產(chǎn)率地使其還原��。-NO2�、-CN、-COOR���、-X��、-N3 等基團對此試劑都很穩(wěn)定����。但對肉桂酸的還原表明����,與羧基共軛的雙鍵將被部分還原。該反應(yīng)的可能機理是��,羧酸先與BOP 試劑和DIPEA 反應(yīng)生成活性羧酸酯��,后者與NaBH4 反應(yīng)迅速生成相應(yīng)的醇:
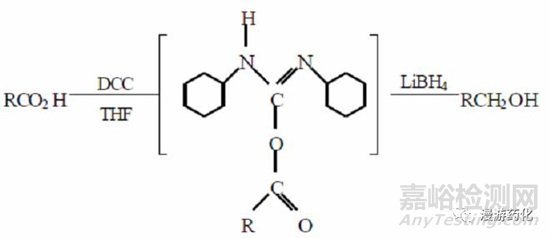
2.6 DCC/LiBH4 體系
DCC/LiBH4 體系還原羧酸的機制與NaBH4/BOP 體系的機制類似��,DCC 首先與羧酸反應(yīng)產(chǎn)生一個活潑中間體�����,后者被LiBH4 迅速還原成醇����。
研究表明,該反應(yīng)迅速�����,產(chǎn)率較高(43 %~78 %)��。還原時與羧基共存的其它官能團如-Br����、-C=C-、-NH2���、-NO2 等均不受影響��。