導(dǎo)語:本篇內(nèi)容為學(xué)習(xí)總結(jié)��,源自審評(píng)三部劉文博老師關(guān)于《醫(yī)美類植入性醫(yī)療器械的技術(shù)審評(píng)進(jìn)展》的培訓(xùn)���。包括背景、醫(yī)美植入器械的品種及產(chǎn)品概況�����、審評(píng)過程中的關(guān)鍵問題及進(jìn)展���、醫(yī)美產(chǎn)品的技術(shù)審評(píng)趨勢(shì)和展望進(jìn)行了介紹���。本文主要針對(duì)醫(yī)美植入性器械分類及注冊(cè)情況,以及對(duì)安全有效性評(píng)價(jià)關(guān)鍵問題解析進(jìn)行學(xué)習(xí)總結(jié)�����。
第一部分:醫(yī)美植入性醫(yī)療器械分類及注冊(cè)情況概述
公元前1223年��,古埃及的法老拉美西斯二世因鼻子過大�����,死后將骨骼植入鼻子,這可能是最早的醫(yī)療美容案例��,但并非應(yīng)用于活體人體���。公元前600年���,我國春秋時(shí)期已有醫(yī)生將患者臉頰和額頭皮膚移植。根據(jù)《肘后備急方》記載��,早在古時(shí)我國已有用雞蛋清治療面部瘢痕的方法��。
一戰(zhàn)期間�����,英國醫(yī)生為受傷士兵實(shí)施面部修復(fù)手術(shù)�����。自90年代至今���,醫(yī)療美容市場(chǎng)陸續(xù)推出微整形產(chǎn)品,如1992年全球首款醫(yī)美級(jí)產(chǎn)品、激光脫毛設(shè)備以及玻尿酸等��。近年來���,玻尿酸產(chǎn)品已廣泛應(yīng)用于國內(nèi)外市場(chǎng)��,多家企業(yè)成功申報(bào)并獲得注冊(cè)證書�����。
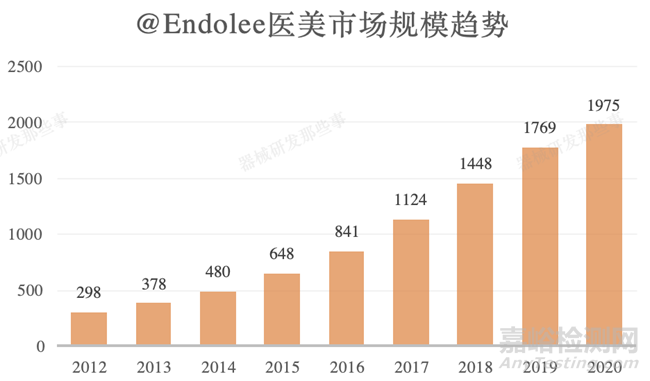
我們國家在2018年已經(jīng)躍升為了世界第二大的醫(yī)美的市場(chǎng)���,我國2012年到2020年醫(yī)美市場(chǎng)容量298億元增張至1978億元,2020年的容量是2012年的6.6倍���,復(fù)合增長(zhǎng)率23.4%���。可見我國醫(yī)美市場(chǎng)需求巨大��。根據(jù)我國藥監(jiān)局的醫(yī)療器械分類目錄���,這類產(chǎn)品主要?dú)w類為13-09類(外科和整形外科)���。
按照分類編碼分為13-09-01(無源植入器械-整形及普通外科植入物-整形填充材料)�����、13-09-02(無源植入器械-整形及普通外科植入物-整形用注射填充物)�����、13-09-03(無源植入器械-整形及普通外科植入物-乳房植入物)���、13-09-10(無源植入器械-整形及普通外科植入物-軟組織擴(kuò)張器)、13-09-00(無源植入器械-整形及普通外科植入物-面部埋植線/提拉線)四大類�����。其中13-09-02比較復(fù)雜一些��,主要分為:
單一作用成分:透明質(zhì)酸鈉凝膠���、膠原蛋白
含可吸收微球:聚乳酸PLA��、聚己內(nèi)酯PCL���、左旋乳酸-乙二醇共聚物
含不可吸收微球:甲基丙烯酸甲酯PMMA��、聚乙烯醇PVA
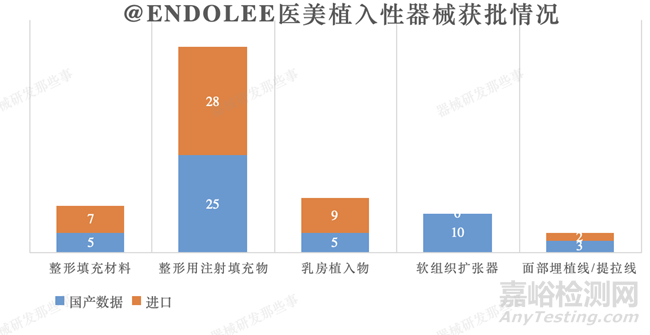
截止到培訓(xùn)時(shí)間2021年9月,其中�����,13-09-01(無源植入器械-整形及普通外科植入物-整形填充材料)產(chǎn)品一般采用聚四氟乙烯��、硅橡膠��、高密度聚乙烯等材料��,國內(nèi)批準(zhǔn)了5個(gè)產(chǎn)品(上海4個(gè)�����,廣州1個(gè))���,另有7個(gè)進(jìn)口產(chǎn)品(美國3個(gè)���,韓國3個(gè),巴西1個(gè))��。整形用注射填充物�����,目前已有25個(gè)國產(chǎn)產(chǎn)品和28個(gè)進(jìn)口產(chǎn)品獲得批準(zhǔn)上市。乳房植入物獲批國內(nèi)5個(gè)�����,進(jìn)口9個(gè)���;軟組織擴(kuò)張器國內(nèi)10個(gè)��;面部埋植線/提拉線國內(nèi)3個(gè)�����,進(jìn)口2個(gè)��。
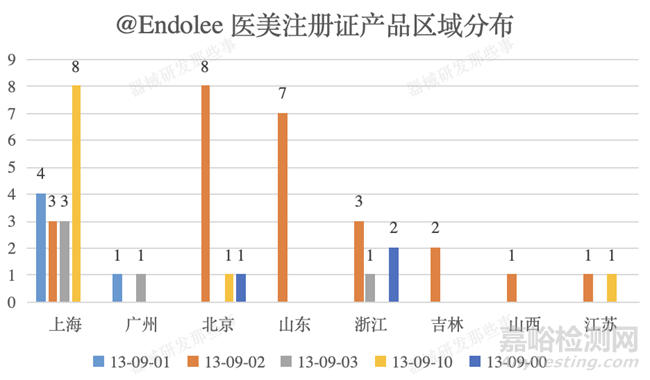
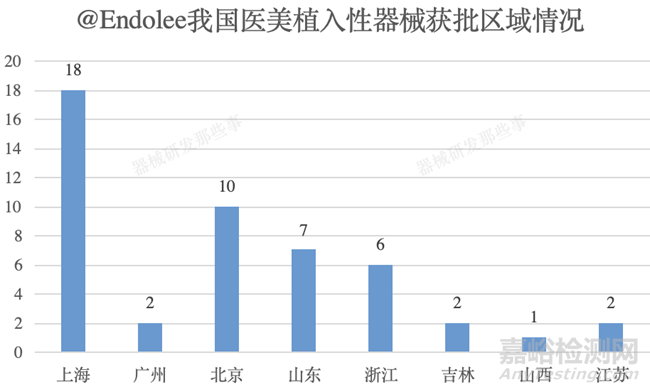
截止培訓(xùn)時(shí)間�����,國產(chǎn)醫(yī)美類植入性器械共計(jì)獲批48個(gè)�����,同時(shí)不難發(fā)現(xiàn)國內(nèi)主要集中在上海(18個(gè))��、北京(10個(gè))���、山東(7個(gè))和浙江(6個(gè))等地。
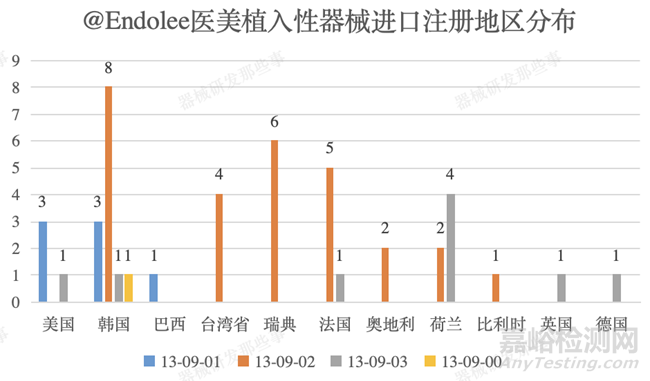
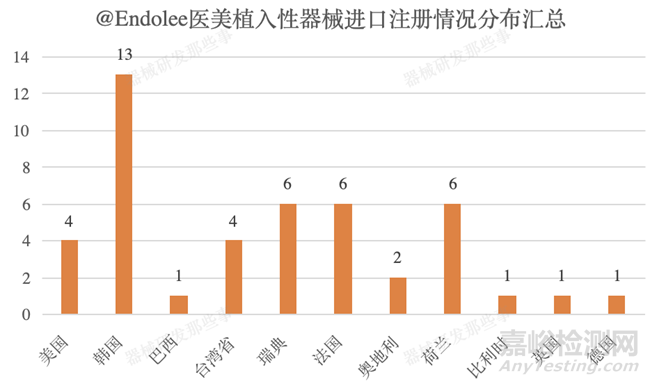
截止培訓(xùn)時(shí)間(2021年9月)醫(yī)美植入性器械進(jìn)口注冊(cè)共計(jì)獲批45個(gè)���,主要集中在韓國(13個(gè))、瑞典(6個(gè))���、法國(6個(gè))���、荷蘭(6個(gè))、美國(4個(gè))及臺(tái)灣?�。?個(gè))�����。
第二部分:醫(yī)美植入性醫(yī)療器械安全有效性評(píng)價(jià)關(guān)鍵問題解析
在接下來的內(nèi)容中���,我將重點(diǎn)介紹近年來器審中心審評(píng)的醫(yī)美類產(chǎn)品的安全和性能評(píng)價(jià)的關(guān)鍵問題��,并對(duì)此進(jìn)行探討�����。在此之前我們首先看下相關(guān)的醫(yī)療器械指導(dǎo)原則或國家行業(yè)標(biāo)準(zhǔn)【在公眾號(hào)內(nèi)容回復(fù) 醫(yī)美 獲得醫(yī)美相關(guān)指導(dǎo)原則或標(biāo)準(zhǔn)包(11個(gè)文件)】���,主要包括:
醫(yī)療器械指導(dǎo)原則或?qū)徳u(píng)要點(diǎn)
乳房植入體產(chǎn)品注冊(cè)技術(shù)審查指導(dǎo)原則
透明質(zhì)酸鈉類面部注射填充材料注冊(cè)技術(shù)審查指導(dǎo)原則
透明質(zhì)酸鈉類面部注射填充材料臨床試驗(yàn)指導(dǎo)原則
整形用面部植入假體注冊(cè)技術(shù)審查指導(dǎo)原則
整形美容用重組人源化膠原蛋白注射材料技術(shù)審評(píng)要點(diǎn)
相關(guān)國家標(biāo)準(zhǔn)/行業(yè)標(biāo)準(zhǔn)
YY 0647/ISO 14607 無源外科植入物 乳房植入物的專用要求
YY0334 硅橡膠外科植入物通用要求
YY/T 0484 外科植入物雙組分加成型硫化硅橡膠
YY 0954 無源外科植入物I型膠原蛋白植入劑
YY/T 0962 整形手術(shù)用交聯(lián)透明質(zhì)酸鈉凝膠
YY/T 1888-2023 重組人源化膠原蛋白
YY/T 1555.2-2018 硅凝膠填充乳房植入物專用要求 硅凝膠填充物性能要求 第2部分:可浸提物質(zhì)限量要求
YY/T 1555.1-2017 硅凝膠填充乳房植入物專用要求 硅凝膠填充物性能要求 第1部分:易揮發(fā)性物質(zhì)限量要求
首先��,第一個(gè)關(guān)鍵問題就是關(guān)于注射植入劑產(chǎn)品的使用范圍的擴(kuò)充���。長(zhǎng)期以來,這類產(chǎn)品的使用范圍僅局限于單一的皺紋矯正等���,這主要是因?yàn)樽⑸湔蔚尼t(yī)生對(duì)產(chǎn)品超適用范圍的靈活應(yīng)用�����,以及申請(qǐng)人沒有動(dòng)力去申報(bào)更多的使用范圍。舉例如下:
鼻唇溝皺紋 舉例:注射用修飾透明質(zhì)酸鈉凝膠
注冊(cè)證號(hào):國械注準(zhǔn)20173463254
適用范圍:該產(chǎn)品適用于面部真皮組織中層至深層注射以糾正中重度鼻唇溝皺褶���。
額部皺紋 舉例:重組III型人源化膠原蛋白凍干纖維
注冊(cè)證號(hào):國械注準(zhǔn)20213130488
適用范圍:用于面部真皮組織填充以糾正額部動(dòng)力性紋(包括眉間紋 額頭紋和魚尾紋)�����。
頸部皺紋 舉例:注射用透明質(zhì)酸鈉復(fù)合溶液
注冊(cè)證號(hào):國械注準(zhǔn)20163461804
適用范圍:該產(chǎn)品用于皮內(nèi)真皮層注射填充,以糾正頸部中重度皺紋��。
改善面部輪廊-中面部 舉例:注射用修飾透明質(zhì)酸鈉凝膠
注冊(cè)證號(hào):國械注進(jìn)20203130098
適用范圍:適用于注射到皮下至骨膜上層用于矯正中面部。
隆鼻 舉例:整形用膠原和PMMA皮下植入物系統(tǒng)
注冊(cè)證號(hào):國食藥監(jiān)械(進(jìn))字2012第3460540號(hào)(更)
適用范圍:該產(chǎn)品用于注射到真皮深層以糾正鼻唇溝紋���,或填充到骨膜外層以進(jìn)行(鼻骨段)隆鼻���。
改善手部外觀 舉例:注射用交聯(lián)透明質(zhì)酸鈉凝膠
注冊(cè)證號(hào):國械注進(jìn)20193130625
適用范范圍:該產(chǎn)品適用于18歲以上手背部需要增加組織容量的人群��,用于手背部真皮層���,最佳為真皮深層的注射,以改善手部皮膚外觀���。
豐唇舉例:含利多卡因注射用交聯(lián)透明質(zhì)酸鈉凝膠
注冊(cè)證號(hào):國械注進(jìn)20213130109
一適用范國:該產(chǎn)品通過注射至唇紅體和唇紅緣的唇粘膜��、真皮淺層或中層,以矯正唇部不對(duì)稱���,輪廊畸形和容積缺陷等結(jié)構(gòu)缺陷��。
然而�����,近年來��,隨著我國對(duì)醫(yī)美類醫(yī)療器械的規(guī)范使用�����,以及資本的推動(dòng),越來越多的產(chǎn)品開始申報(bào)更多的使用范圍�����。例如��,審評(píng)的產(chǎn)品中���,有的用于糾正唇部皺紋,有的用于矯正額部皺紋��,有的用于填充中面部容量缺失和輪廓缺陷,有的用于隆鼻和手部外觀改善等���。
截止2021年9月國內(nèi)未批準(zhǔn)的適用范圍:
面部年輕化:補(bǔ)水、緊致 ��;抗衰 ���;提亮膚色
面部增容整形:額部增容(天庭飽滿) ���;頦部增容(下巴)
隆胸�����、豐臀
頭皮維護(hù)��、脫發(fā)
私密整形
在審評(píng)以及產(chǎn)品設(shè)計(jì)開發(fā)過程中,需要關(guān)注產(chǎn)品的安全性��、有效性�����、質(zhì)量可控性等多個(gè)方面,確保產(chǎn)品的安全性和有效性�����。對(duì)于使用范圍擴(kuò)充的產(chǎn)品���,我們需要重新評(píng)估其安全性、有效性以及質(zhì)量可控性�����,確保其在新的使用范圍下的安全性和有效性���。
除了產(chǎn)品的使用范圍擴(kuò)充,我們還需要關(guān)注其他類型的產(chǎn)品���,如含有可吸收聚酯微球凝膠的產(chǎn)品(主要特點(diǎn)為:可吸收聚酯微球降解速率較慢��,可延長(zhǎng)鎮(zhèn)充效果)。獲批的幾個(gè)產(chǎn)品注冊(cè)證號(hào)分別為:國械注準(zhǔn)20213130460�����、國械注進(jìn)20213130100、國械注準(zhǔn)20213130276��。這類產(chǎn)品在市場(chǎng)上引起了很大的關(guān)注���,被稱為“少女針”或“童顏針”。
在審評(píng)或設(shè)計(jì)開發(fā)過程中�����,我們需要關(guān)注其成分���、降解周期及代謝途徑、凝膠粒徑分布�����、微球粒徑分布��、微球材料親疏水性能���、表面穩(wěn)定性(微球懸浮和均勻分散均勻性和穩(wěn)定性研究)���、微球吸水性���、填充劑復(fù)溶�����、組織相容性等多個(gè)方面��,確保產(chǎn)品的安全性和有效性���。
此外,我們還需要關(guān)注乳房植入體的界面性大細(xì)胞淋巴瘤問題��。對(duì)于這類產(chǎn)品�����,我們需要提供關(guān)于BIA-ALCL的風(fēng)險(xiǎn)分析和防范措施相關(guān)的資料��,并在產(chǎn)品上市或延續(xù)注冊(cè)時(shí)提供相關(guān)的質(zhì)量分析報(bào)告���,加強(qiáng)遠(yuǎn)期臨床隨訪��,搜集相關(guān)信息,進(jìn)行風(fēng)險(xiǎn)收益評(píng)價(jià)�����。具體建議如下:
乳房植入體大細(xì)胞淋巴瘤向題:間變性大細(xì)胞淋巴瘤BIA-ALCL關(guān)注點(diǎn)
建議申請(qǐng)人提供關(guān)于BIA-ALCL的風(fēng)險(xiǎn)分析和防范措施相關(guān)資料���。
建議申請(qǐng)人在說明書中增加BIA-ALCL的相關(guān)警示信息,在所提供研究資料基礎(chǔ)上按照YY 0647的要求明確乳房植入體預(yù)期壽命的信息�����,
在產(chǎn)品境外上市臨床隨訪數(shù)據(jù)或延續(xù)注冊(cè)產(chǎn)品質(zhì)量分析報(bào)告的審評(píng)中需關(guān)注BIA-ALCL相關(guān)不良事件和投訴信息�����。
建議申請(qǐng)人上市后持續(xù)加強(qiáng)遠(yuǎn)期的臨床隨訪�����,收集BIA-ALCL數(shù)據(jù),并隨時(shí)進(jìn)行風(fēng)險(xiǎn) 受益評(píng)價(jià)��。
鑒于目前的臨床數(shù)據(jù)顯示使用毛面植入體BIA-ALCL發(fā)病率更高��,因此在審評(píng)中需考慮植入體表面特性對(duì)于產(chǎn)品安全性評(píng)價(jià)的影響���,包括:
(1)在生物相容性評(píng)價(jià)中,建議申請(qǐng)人將植入體表面特性作為重要的考慮因素對(duì)所選取樣品的代表性進(jìn)行充分論證��,尤其是植入��、免疫毒性��、生殖毒性���、慢性毒性、致癌等項(xiàng)目���。鑒于BIA-ALCL發(fā)病機(jī)理尚不明確�����,暫不宜強(qiáng)制要求對(duì)不同表面的產(chǎn)品分別試驗(yàn)��,建議申請(qǐng)人按照GB/T 16886原則予以評(píng)價(jià);
(2) 應(yīng)對(duì)不同表面特性的植入體分別臨床評(píng)價(jià)。
結(jié)束語:綜上本篇學(xué)習(xí)總結(jié)�����,總的來說��,在審評(píng)醫(yī)美類產(chǎn)品時(shí)�����,我們需要關(guān)注產(chǎn)品的安全性�����、有效性���、質(zhì)量可控性等多個(gè)方面��,以確保產(chǎn)品的安全性和有效性��。同時(shí),我們也需要關(guān)注產(chǎn)品的使用范圍��、新型材料以及與其他醫(yī)療器械的兼容性等問題��,以滿足市場(chǎng)需求和保護(hù)患者權(quán)益��。