摘要 目的:查找注射劑和滴眼劑生產(chǎn)的關(guān)鍵控制點(diǎn)�����,制定預(yù)防措施�����,為注射劑和滴眼劑提供良好的質(zhì)控保障。方法:調(diào)研兩家醫(yī)藥企業(yè)�����,采用危害分析和關(guān)鍵控制點(diǎn)法�����、失敗模式影響分析等風(fēng)險(xiǎn)管理工具,查找生產(chǎn)過程的風(fēng)險(xiǎn)點(diǎn)�����,開展風(fēng)險(xiǎn)評估和風(fēng)險(xiǎn)控制�����,制定預(yù)防措施�����。結(jié)果:對風(fēng)險(xiǎn)系數(shù)處于高風(fēng)險(xiǎn)和中等風(fēng)險(xiǎn)水平的風(fēng)險(xiǎn)源采取控制措施后�����,各風(fēng)險(xiǎn)點(diǎn)的風(fēng)險(xiǎn)等級有所降低。結(jié)論:注射劑和滴眼劑原輔包須與制劑的生產(chǎn)環(huán)境相匹配�����,生產(chǎn)監(jiān)測的全面化與規(guī)范化有待提升�����。
2017年國家食品藥品監(jiān)督管理總局頒布《總局關(guān)于調(diào)整原料藥、藥用輔料和藥包材審評審批事項(xiàng)的公告》(2017年第146號)�����,將原料藥�����、輔料�����、藥包材與藥品制劑進(jìn)行關(guān)聯(lián)審評�����,進(jìn)一步體現(xiàn)原輔包在制劑研發(fā)�����、生產(chǎn)全過程中的重要價(jià)值�����。
對生產(chǎn)環(huán)境的潔凈需求在醫(yī)藥企業(yè)的生產(chǎn)中占有核心的地位,其潔凈效果直接影響產(chǎn)品的質(zhì)量�����。隨著監(jiān)管理念對生產(chǎn)過程控制的重視及2010年版《藥品生產(chǎn)質(zhì)量管理規(guī)范》(Good Manufacturing Practice of Medical Products�����,GMP)的實(shí)施�����,我國對藥品及其原輔包材料生產(chǎn)潔凈車間環(huán)境指標(biāo)的確認(rèn)和驗(yàn)證要求越來越高�����。為更有效地控制潔凈室的環(huán)境,需在潔凈室監(jiān)控中引入質(zhì)量風(fēng)險(xiǎn)評估和管理的理念�����,利用日常監(jiān)測數(shù)據(jù)進(jìn)行污染與風(fēng)險(xiǎn)預(yù)測�����。但在實(shí)際生產(chǎn)中,多數(shù)原輔包生產(chǎn)企業(yè)對其產(chǎn)品的質(zhì)量控制尚停留在產(chǎn)品檢驗(yàn)階段�����,對其產(chǎn)品及生產(chǎn)環(huán)境的監(jiān)控還未引入質(zhì)量風(fēng)險(xiǎn)評估和管理的理念�����。
質(zhì)量風(fēng)險(xiǎn)管理在各行各業(yè)的設(shè)計(jì)及生產(chǎn)管理過程中應(yīng)用廣泛并取得了良好效果�����。在制藥行業(yè),最早由美國食品藥品管理局(Food and Drug Administration�����,F(xiàn)DA)于2002年提出;2005年�����,人用藥物注冊技術(shù)要求國際協(xié)調(diào)會(huì)(ICH)發(fā)布Q9質(zhì)量風(fēng)險(xiǎn)管理指南�����,指出應(yīng)在藥品的全生命周期內(nèi)對藥品質(zhì)量風(fēng)險(xiǎn)進(jìn)行評估�����、控制�����、溝通和審核;我國2010年版《藥品生產(chǎn)質(zhì)量管理規(guī)范》(GMP)引入了質(zhì)量風(fēng)險(xiǎn)管理理念�����。已有研究將質(zhì)量風(fēng)險(xiǎn)管理的方法應(yīng)用在口服固體制劑[1]�����、注射劑[2-5]以及滴眼劑[6]等的生產(chǎn)管控和生產(chǎn)環(huán)境的風(fēng)險(xiǎn)評估中[7-9],但目前尚未見針對無菌制劑輔料和藥包材生產(chǎn)環(huán)境的研究�����。
本研究以風(fēng)險(xiǎn)較高的注射劑和滴眼劑為研究對象�����,采用風(fēng)險(xiǎn)評估管理工具——危害分析和關(guān)鍵控制點(diǎn)(Hazard Analysis and Critical Control Points�����,HACCP)、失敗模式影響分析(Failure Mode Effects Analysis�����,F(xiàn)MEA)�����,對注射劑�����、滴眼劑及原輔包生產(chǎn)工藝各環(huán)節(jié)的環(huán)境進(jìn)行風(fēng)險(xiǎn)識(shí)別�����、分析和評價(jià)�����,查找關(guān)鍵控制點(diǎn)�����,制定預(yù)防措施�����,為類似無菌制劑提供良好的質(zhì)控保障。
1�����、研究方法
1.1 質(zhì)量風(fēng)險(xiǎn)管理過程
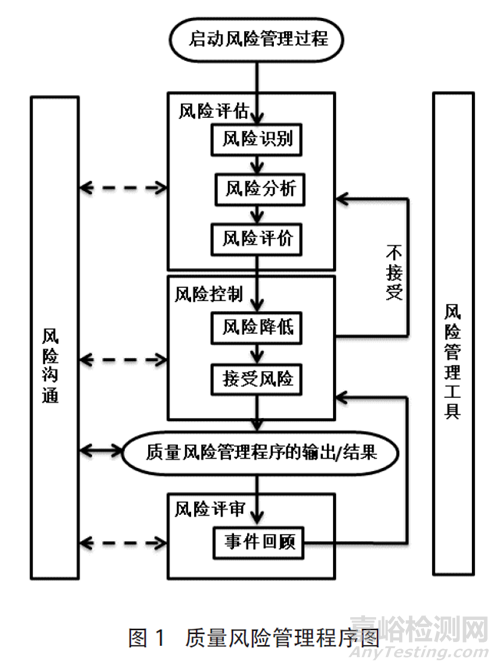
典型的質(zhì)量風(fēng)險(xiǎn)管理程序見圖1�����,風(fēng)險(xiǎn)管理程序啟動(dòng)后,主要分為以下幾部分進(jìn)行[10]�����。
1)風(fēng)險(xiǎn)評估 風(fēng)險(xiǎn)評估包括三方面的內(nèi)容:風(fēng)險(xiǎn)識(shí)別�����、風(fēng)險(xiǎn)分析和風(fēng)險(xiǎn)評價(jià)�����。風(fēng)險(xiǎn)識(shí)別-找出容易出錯(cuò)的地方(風(fēng)險(xiǎn)點(diǎn));風(fēng)險(xiǎn)分析-分析風(fēng)險(xiǎn)發(fā)生的危害及危害發(fā)生的幾率�����,可進(jìn)行定性或定量評估�����;風(fēng)險(xiǎn)評價(jià)-評價(jià)危害的嚴(yán)重性�����,得出風(fēng)險(xiǎn)級別。
2)風(fēng)險(xiǎn)控制 研究用何種方式來降低或消除風(fēng)險(xiǎn)�����,以及風(fēng)險(xiǎn)降低后是否達(dá)到可接受的水平�����。
3)風(fēng)險(xiǎn)溝通與審核 在整個(gè)風(fēng)險(xiǎn)管理流程的任意環(huán)節(jié)均可作出決定,可以返回上一步收集更多信息�����,對風(fēng)險(xiǎn)模型進(jìn)行調(diào)整�����,或根據(jù)信息終止風(fēng)險(xiǎn)管理流程。
1.2 風(fēng)險(xiǎn)管理工具
本研究使用的風(fēng)險(xiǎn)管理工具有:
1)危害分析和關(guān)鍵控制點(diǎn)(HACCP)
HACCP是一種用于保證產(chǎn)品可靠性和安全性的預(yù)防性工具�����,對過程的每一步進(jìn)行監(jiān)視和控制�����,以降低危害發(fā)生的概率�����。
2)失敗模式影響分析(FMEA)
FMEA是在產(chǎn)品和過程設(shè)計(jì)階段,對各個(gè)工序進(jìn)行分析�����,找出所有潛在失效模式�����,并分析其可能的后果,從而預(yù)先采取必要措施�����,以提高產(chǎn)品質(zhì)量和可靠性�����。
應(yīng)用FMEA的步驟如下:第一,對產(chǎn)品及其生產(chǎn)過程進(jìn)行分析�����;第二�����,列出產(chǎn)品潛在的失效因素,估計(jì)失效發(fā)生的頻率�����、嚴(yán)重度及可檢測水平�����,并按照評估得分,計(jì)算風(fēng)險(xiǎn)系數(shù)(Risk Priority Number�����,RPN)�����;第三�����,進(jìn)行問題的總體評估�����,提出改正的措施及控制失效發(fā)生的方案。
2�����、研究過程
實(shí)地調(diào)研和現(xiàn)場監(jiān)測A和B兩家制藥公司的生產(chǎn)車間潔凈環(huán)境。通過座談�����、問卷等方式收集生產(chǎn)管控相關(guān)資料�����,綜合潔凈環(huán)境調(diào)研和現(xiàn)場監(jiān)測的內(nèi)容�����,采用HACCP�����,查找注射劑�����、滴眼劑及其原輔包材料生產(chǎn)環(huán)境的風(fēng)險(xiǎn)點(diǎn)�����,進(jìn)而采用FMEA進(jìn)行風(fēng)險(xiǎn)評估和風(fēng)險(xiǎn)控制。
2.1 滴眼劑及其原輔包材料的生產(chǎn)環(huán)境調(diào)研分析
滴眼劑是由藥物與適宜輔料制成的供滴入眼內(nèi)的無菌液體制劑[11]�����。滴眼劑的制備工藝主要有三種:一是采用吹灌封一體機(jī)進(jìn)行制瓶-灌藥-封口過程�����;二是用無菌滴眼劑瓶進(jìn)行無菌灌裝�����;三是外購內(nèi)包材,對其進(jìn)行洗-烘-滅處理后進(jìn)行無菌灌裝[12]�����。吹灌封技術(shù)在2010年被寫入我國GMP[13]�����,目前許多滴眼劑生產(chǎn)企業(yè)采用該技術(shù)生產(chǎn)滴眼劑[14]�����。
內(nèi)包材和注射用水是滴眼劑生產(chǎn)過程兩個(gè)需要重點(diǎn)關(guān)注的風(fēng)險(xiǎn)要素�����。滴眼劑的內(nèi)包材即滴眼劑瓶�����,材質(zhì)多為低密度聚乙烯�����、聚丙烯�����、聚氯乙烯�����、聚酯類等[12]�����,在高溫下易變形�����,多采用無菌工藝制備[15]�����。配制滴眼液需使用注射用水�����。注射用水的制備工藝:以純化水為原水,經(jīng)多效蒸餾水機(jī)處理�����,形成純化蒸汽�����,純化蒸汽經(jīng)冷凝成為注射用水�����,進(jìn)入儲(chǔ)罐供使用[16]�����。
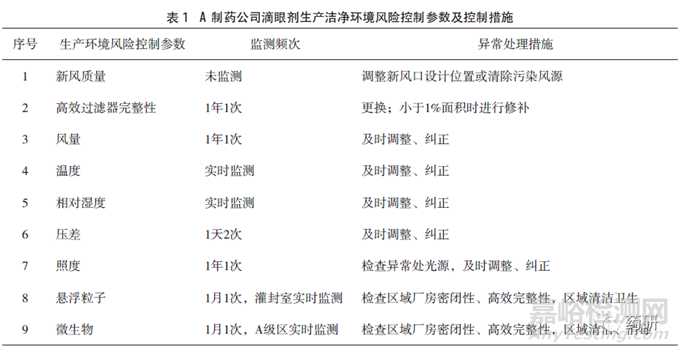
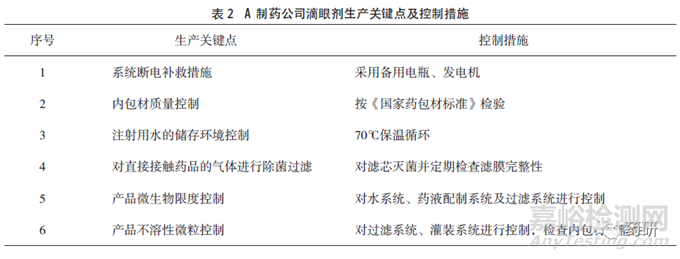
A制藥公司有多條生產(chǎn)滴眼劑的吹灌封生產(chǎn)線�����,注冊批準(zhǔn)工藝中生產(chǎn)車間的潔凈級別要求為C+A級,日常監(jiān)測可達(dá)到規(guī)定級別�����,每年對潔凈環(huán)境控制參數(shù)進(jìn)行一次驗(yàn)證�����。通過調(diào)查獲得的該企業(yè)產(chǎn)品生產(chǎn)潔凈環(huán)境風(fēng)險(xiǎn)控制參數(shù)及措施見表1�����,生產(chǎn)關(guān)鍵點(diǎn)及控制措施見表2�����。調(diào)研過程發(fā)現(xiàn)生產(chǎn)車間內(nèi)微生物監(jiān)測數(shù)值較高的區(qū)域?yàn)槿?物流區(qū)域及清洗區(qū)域�����,車間控制微生物的措施有高溫高壓融化粒料�����,除菌過濾直接接觸藥品的氣體�����,蒸汽滅菌每批產(chǎn)品生產(chǎn)使用的濾芯并檢查濾膜完整性�����。
2.2 注射劑及其原輔包材料的生產(chǎn)環(huán)境調(diào)研分析
注射劑指原料藥物或與適宜的輔料制成的供注入體內(nèi)的無菌制劑�����。注射劑直接入血�����,起效迅速,屬于高風(fēng)險(xiǎn)劑型[4]�����。注射劑最受關(guān)注的質(zhì)量問題是可見異物[2]�����,帶有可見異物的注射劑一旦被注入人體,會(huì)給患者帶來難以預(yù)知的安全隱患[17-18]�����。注射劑作為高風(fēng)險(xiǎn)產(chǎn)品,生產(chǎn)過程控制要求高�����,對廠房環(huán)境和設(shè)備的運(yùn)行�����、操作有著嚴(yán)格要求[19]。注射劑是典型的最終滅菌工藝生產(chǎn)的無菌制劑�����,生產(chǎn)中無菌保證和對可見異物的控制是較大挑戰(zhàn)�����。
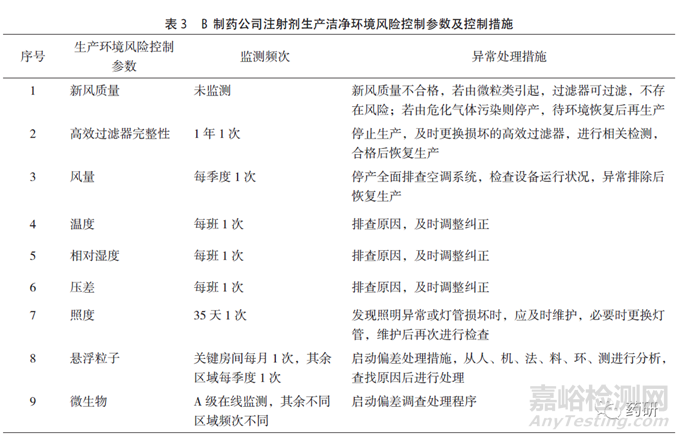
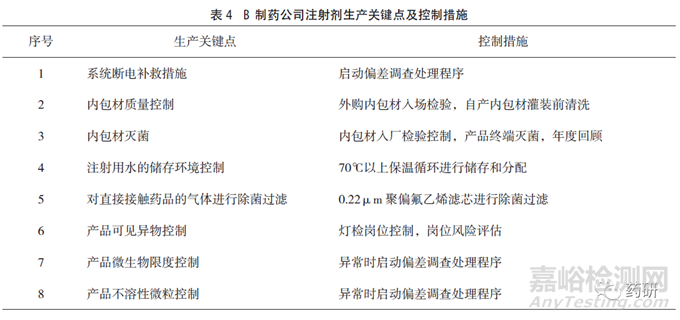
B制藥公司具有多條注射液產(chǎn)品線�����,其注冊批準(zhǔn)工藝中生產(chǎn)車間的潔凈級別要求為C+A級�����,日常監(jiān)測可達(dá)到規(guī)定級別�����,對空調(diào)系統(tǒng)的再驗(yàn)證周期為2年�����,每年定期評估�����,其生產(chǎn)環(huán)境風(fēng)險(xiǎn)控制參數(shù)及措施見表3�����。車間生產(chǎn)線安裝有粒子自動(dòng)監(jiān)測系統(tǒng)�����,微生物控制建立有相應(yīng)標(biāo)準(zhǔn)。其他生產(chǎn)關(guān)鍵點(diǎn)和控制措施見表4�����。
2.3 注射劑�����、滴眼劑及其原輔包材料的生產(chǎn)環(huán)境風(fēng)險(xiǎn)管理
對于生產(chǎn)過程中關(guān)鍵控制點(diǎn)的確定,采用世界衛(wèi)生組織(World Health Organization�����,WHO)食品法典委員會(huì)推薦的關(guān)鍵控制點(diǎn)判斷樹[20]�����。通過對注射劑�����、滴眼劑及其內(nèi)包材和原輔料生產(chǎn)的工藝流程進(jìn)行危害分析,結(jié)合實(shí)地檢測與調(diào)研發(fā)現(xiàn)的問題�����,判斷出生產(chǎn)過程每一步驟中存在的潛在危害�����,對危害的嚴(yán)重程度和可能性進(jìn)行分析�����、評價(jià),確定風(fēng)險(xiǎn)關(guān)鍵控制點(diǎn)。
接下來運(yùn)用FMEA方法�����,對風(fēng)險(xiǎn)源的嚴(yán)重性�����、可能性和可檢測性進(jìn)行分析和評估�����,并按照評估得分�����,計(jì)算RPN。評定標(biāo)準(zhǔn)分別見表5�����、表6和表7。
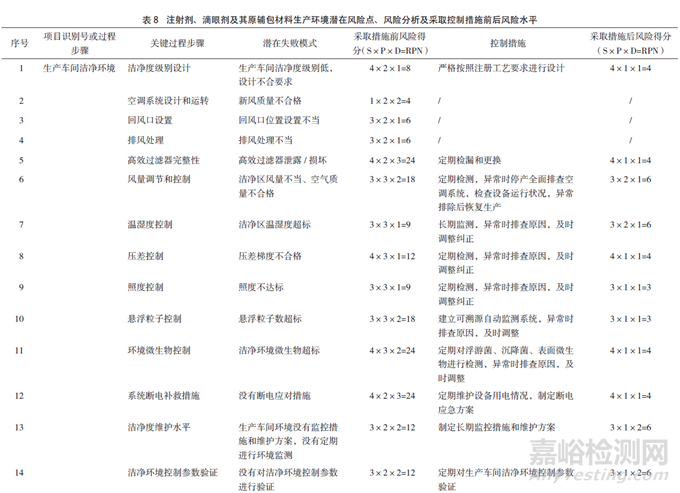
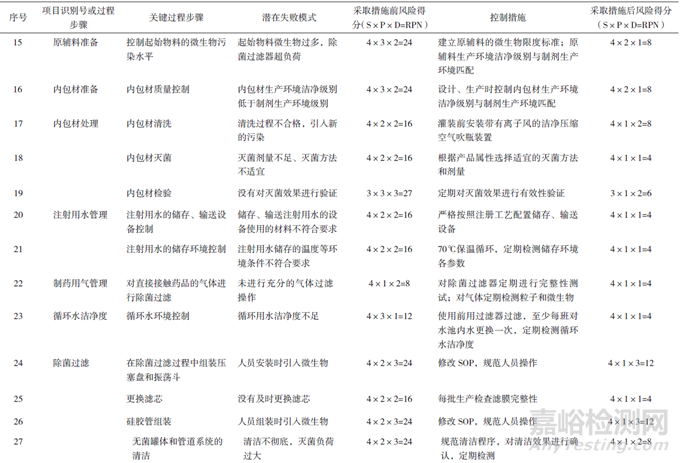
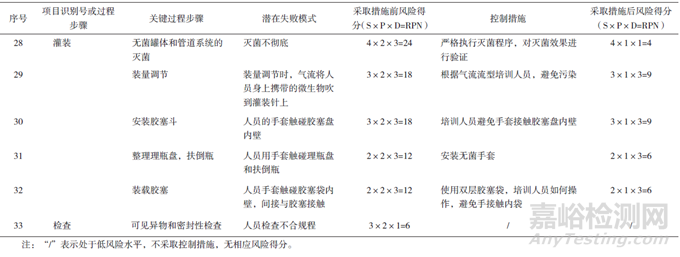
RPN為嚴(yán)重性(對產(chǎn)品質(zhì)量的影響程度)�����、可能性(風(fēng)險(xiǎn)產(chǎn)生的可能性程度)和可檢測性(潛在風(fēng)險(xiǎn)造成危害前,對其發(fā)生的可能性進(jìn)行監(jiān)測)三者的乘積。當(dāng)RPN>16時(shí)�����,風(fēng)險(xiǎn)等級為高風(fēng)險(xiǎn)水平�����;當(dāng)8≤RPN≤16時(shí)�����,為中等水平�����;當(dāng)RPN<8時(shí)�����,為低風(fēng)險(xiǎn)水平。對注射劑、滴眼劑及其原輔包材料的生產(chǎn)環(huán)境評估結(jié)果見表8。
風(fēng)險(xiǎn)分析可知�����,生產(chǎn)潔凈環(huán)境各關(guān)鍵過程步驟中�����,風(fēng)險(xiǎn)等級比較高的有高效過濾器完整性�����、風(fēng)量調(diào)節(jié)和控制�����、環(huán)境微生物以及懸浮粒子的控制等�����。生產(chǎn)潔凈車間若沒有斷電應(yīng)對措施�����,危害較大�����,因?yàn)楦咝到y(tǒng)全部靠電力維持。潔凈車間在設(shè)計(jì)時(shí)通常能夠根據(jù)產(chǎn)品屬性選擇符合GMP要求的潔凈度級別以及溫濕度、照度等參數(shù)的風(fēng)險(xiǎn)等級處于中等風(fēng)險(xiǎn)水平�����。生產(chǎn)車間潔凈環(huán)境控制參數(shù)的驗(yàn)證,以及擬定可行的監(jiān)控措施和維護(hù)方案同樣是比較重要的方面�����,若沒有相應(yīng)措施�����,生產(chǎn)車間潔凈環(huán)境難以長期維持穩(wěn)態(tài)�����。
在原輔包準(zhǔn)備方面,若不控制起始原輔料和包裝材料的微生物水平,或控制措施不到位�����,如內(nèi)包材的清洗、滅菌及滅菌效果驗(yàn)證沒有配套規(guī)定方案�����,會(huì)使最終產(chǎn)品染菌�����,風(fēng)險(xiǎn)較高。結(jié)合生產(chǎn)工藝對可能引入微生物的風(fēng)險(xiǎn)點(diǎn)進(jìn)行分析�����,注射用水和制藥用氣的儲(chǔ)存�����、運(yùn)送環(huán)境都需要嚴(yán)格管控�����,除菌過濾及灌裝等步驟都包含高風(fēng)險(xiǎn)操作�����,也需要嚴(yán)格控制。
接下來對風(fēng)險(xiǎn)系數(shù)處于高風(fēng)險(xiǎn)和中等風(fēng)險(xiǎn)水平的風(fēng)險(xiǎn)源擬定控制措施�����,并對其進(jìn)行控制后的再評估,分析風(fēng)險(xiǎn)接受水平(表8)�����。采取控制措施后�����,各風(fēng)險(xiǎn)點(diǎn)的風(fēng)險(xiǎn)等級均有所降低,生產(chǎn)車間潔凈環(huán)境方面,需要按照注冊工藝要求進(jìn)行總體設(shè)計(jì),對潔凈環(huán)境各參數(shù)定期驗(yàn)證�����,制定監(jiān)控措施及預(yù)警和糾偏機(jī)制�����,并設(shè)立風(fēng)險(xiǎn)預(yù)案�����,遇到異常及時(shí)排查糾正�����。原輔料生產(chǎn)環(huán)境需要同制劑生產(chǎn)環(huán)境相匹配�����,制劑生產(chǎn)也需要對原輔材料及包裝材料進(jìn)行檢驗(yàn)及質(zhì)量控制。生產(chǎn)各環(huán)節(jié)尤其是容易引入微生物的風(fēng)險(xiǎn)點(diǎn)要格外重視�����,嚴(yán)格規(guī)范各步驟�����,制定監(jiān)控措施和維護(hù)方案�����,注射劑、滴眼劑及其原輔包材料生產(chǎn)環(huán)境風(fēng)險(xiǎn)水平將得到降低并達(dá)到可接受的水平。
3�����、討論
3.1 原輔包生產(chǎn)環(huán)境須與制劑的生產(chǎn)環(huán)境相匹配
原料藥、輔料、藥包材與藥品制劑關(guān)聯(lián)審評審批�����,要求原輔包的生產(chǎn)環(huán)境與制劑的生產(chǎn)環(huán)境相匹配,滿足制劑的需求�����。目前我國還未有相關(guān)標(biāo)準(zhǔn)或規(guī)范明確規(guī)定藥用輔料生產(chǎn)環(huán)境的潔凈度�����,許多藥用輔料生產(chǎn)企業(yè)尚未建立在潔凈環(huán)境中生產(chǎn)藥用輔料的理念,即使生產(chǎn)車間為潔凈環(huán)境,也難以與藥物劑型要求相匹配�����。例如�����,注射劑生產(chǎn)企業(yè)采購輔料時(shí)�����,應(yīng)采購C級生產(chǎn)環(huán)境下生產(chǎn)的輔料�����,但市面上的輔料多在D級環(huán)境下生產(chǎn)�����。在關(guān)聯(lián)審評審批的背景下�����,有必要建立健全針對藥用原輔料生產(chǎn)環(huán)境潔凈度要求的相應(yīng)標(biāo)準(zhǔn)�����,督促藥用原輔料生產(chǎn)廠家提高生產(chǎn)環(huán)境潔凈級別,使藥用原輔料生產(chǎn)的潔凈環(huán)境與制劑生產(chǎn)相匹配�����。
3.2 生產(chǎn)潔凈環(huán)境監(jiān)測需要全面化與規(guī)范化
懸浮粒子與微生物是潔凈環(huán)境的兩個(gè)重要參數(shù)�����,風(fēng)險(xiǎn)分析中亦發(fā)現(xiàn)二者處于高風(fēng)險(xiǎn)等級�����。國內(nèi)外GMP明確要求對懸浮粒子進(jìn)行動(dòng)態(tài)監(jiān)測�����。對于無菌制劑生產(chǎn)的A級環(huán)境,懸浮粒子應(yīng)設(shè)置在線實(shí)時(shí)自動(dòng)監(jiān)測系統(tǒng)�����,對于不同潔凈環(huán)境級別的關(guān)鍵房間�����,應(yīng)做定期監(jiān)測�����。國內(nèi)外GMP要求對微生物制定嚴(yán)格的監(jiān)控方案�����,定期監(jiān)測不同潔凈級別房間的浮游菌�����、沉降菌�����、表面接觸菌�����。調(diào)研過程中發(fā)現(xiàn)微生物監(jiān)測數(shù)值較高的房間為人流、物流區(qū)域以及清洗區(qū)域,如洗手、更衣室等�����,該類房間潔凈級別較低�����。風(fēng)險(xiǎn)分析過程顯示�����,人員潔凈服攜帶的微生物存在被氣流吹至無菌生產(chǎn)線的風(fēng)險(xiǎn)�����,因此不能忽視潔凈級別較低房間的微生物控制�����。另外,潔凈環(huán)境懸浮粒子和微生物的監(jiān)控都應(yīng)當(dāng)制定應(yīng)急處理方案�����,若發(fā)現(xiàn)異常�����,及時(shí)啟動(dòng)偏差處理措施�����,排查原因后處理�����。
風(fēng)量調(diào)節(jié)和控制對于潔凈環(huán)境也是一個(gè)高風(fēng)險(xiǎn)點(diǎn)�����,潔凈區(qū)風(fēng)量不當(dāng)或空氣質(zhì)量不合格容易在無菌制劑的生產(chǎn)過程引入微生物�����,嚴(yán)重影響產(chǎn)品質(zhì)量。對風(fēng)量應(yīng)當(dāng)定期監(jiān)測,很多企業(yè)對于風(fēng)量的監(jiān)測是每季度一次�����,但監(jiān)測頻次應(yīng)盡可能增加�����,以隨時(shí)掌握風(fēng)量狀態(tài),出現(xiàn)異常時(shí)�����,應(yīng)立即停產(chǎn)對空調(diào)系統(tǒng)進(jìn)行全面排查�����,檢查系統(tǒng)設(shè)備的運(yùn)行情況�����、過濾器是否存在破損或堵塞等�����,待異常排除后再恢復(fù)生產(chǎn)。
溫濕度與壓差是潔凈環(huán)境比較常規(guī)的監(jiān)測項(xiàng)目�����,風(fēng)險(xiǎn)分析發(fā)現(xiàn)�����,該類指標(biāo)出現(xiàn)異常的可能性很大,生產(chǎn)過程(如配液時(shí)的高溫高濕操作)會(huì)導(dǎo)致環(huán)境溫濕度的波動(dòng)�����,應(yīng)設(shè)置實(shí)時(shí)監(jiān)控系統(tǒng)進(jìn)行長期監(jiān)測�����,異常波動(dòng)時(shí)由控制系統(tǒng)自動(dòng)進(jìn)行除濕降溫處理�����。壓差是保證氣流從潔凈等級高的區(qū)域流向潔凈等級低的區(qū)域的一個(gè)關(guān)鍵因素�����,對壓差梯度也應(yīng)實(shí)時(shí)監(jiān)測�����,并有相應(yīng)自控系統(tǒng)在出現(xiàn)異常時(shí)進(jìn)行風(fēng)險(xiǎn)提示,及時(shí)采取措施�����。
4�����、結(jié)論
在關(guān)聯(lián)審評審批的背景下�����,藥用原輔包必須在與制劑生產(chǎn)相匹配的環(huán)境下進(jìn)行生產(chǎn)�����,生產(chǎn)潔凈環(huán)境各參數(shù)的異常都會(huì)對產(chǎn)品質(zhì)量及用藥安全造成較大風(fēng)險(xiǎn)�����,需要對潔凈環(huán)境各參數(shù)制定嚴(yán)格且正確的監(jiān)測方案�����,以期為無菌制劑提供良好的質(zhì)控保障,保障人民用藥安全�����。