今日頭條
先聲USP1抑制劑獲批實(shí)體瘤臨床��。先聲藥業(yè)自主研發(fā)的泛素特異性肽酶1(USP1)小分子抑制劑SIM0501獲FDA臨床許可,擬開(kāi)展用于晚期實(shí)體瘤治療的臨床試驗(yàn)��。在臨床前研究中,SIM0501單藥或與PARPi聯(lián)合�����,均對(duì)HRD腫瘤有顯著的抗增殖活性��,且藥物安全性良好����。在中國(guó)����,國(guó)家藥監(jiān)局已在10月受理了SIM0501的新藥臨床試驗(yàn)申請(qǐng)��。
國(guó)內(nèi)藥訊
1.賽神Lp-PLA2抑制劑早期臨床積極����。賽神醫(yī)藥擬開(kāi)發(fā)用于治療阿爾茨海默病(AD)和其他神經(jīng)退行性疾病的Lp-PLA2小分子抑制劑SNP318��,在健康受試者中開(kāi)展的Ⅰ期臨床獲積極結(jié)果�����。初步數(shù)據(jù)顯示�����,SNP318在腦脊液(CSF)中有較好的分布��,可完全抑制人體外周和中樞神經(jīng)系統(tǒng)的靶點(diǎn)酶活性��;藥物耐受性良好��,未觀察到嚴(yán)重不良事件(SAEs)��。賽神醫(yī)藥計(jì)劃明年開(kāi)展評(píng)估治療AD的Ⅱ期臨床。
2.甘李口服GLP-1R激動(dòng)劑獲批臨床����。甘李藥業(yè)1類生物制品GZR18片獲國(guó)家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可�����,擬開(kāi)發(fā)用于治療2型糖尿病�����。GZR18是長(zhǎng)效GLP-1R激動(dòng)劑肽類藥物��,擬開(kāi)發(fā)用于成年患者的2型糖尿病(T2DM)的治療或肥胖/超重患者的體重管理��。根據(jù)公開(kāi)信息�����,該產(chǎn)品的注射制劑正在國(guó)內(nèi)開(kāi)展II期臨床��,評(píng)估與司美格魯肽(諾和泰)對(duì)比,每周注射一次治療2型糖尿病患者的效果����。
3.貝達(dá)引進(jìn)BiDAC降解劑獲批肺癌臨床����。C4 Therapeutics公司1類化藥CFT8919片獲國(guó)家藥監(jiān)局臨床試驗(yàn)?zāi)驹S可����,擬開(kāi)發(fā)用于治療攜帶EGFR突變的局晚期或晚期非小細(xì)胞肺癌(NSCLC)患者����。CFT8919是一種BiDAC降解劑����,已在臨床前研究中顯示出針對(duì)EGFR L858R驅(qū)動(dòng)的NSCLC體內(nèi)外模型的治療潛力����;同時(shí)對(duì)T790M或C797S突變的EGFR繼發(fā)耐藥突變有效。貝達(dá)藥業(yè)擁有CFT8919在大中華區(qū)開(kāi)發(fā)�����、制造和商業(yè)化權(quán)益�����。
4.和鉑撤回引進(jìn)FcRn抗體上市申請(qǐng)�����。和鉑醫(yī)藥從HanAll Biopharma引進(jìn)的FcRn抗體巴托利單抗(HBM9161)已在國(guó)內(nèi)撤回用于治療全身型重癥肌無(wú)力(gMG)的上市申請(qǐng)��。今年3月����,HBM9161已在治療gMG的關(guān)鍵III期臨床達(dá)到主要終點(diǎn)及關(guān)鍵次要終點(diǎn)�����?���;谂R床試驗(yàn)方案,和鉑醫(yī)藥正在進(jìn)行III期臨床的延期����,并收集其他長(zhǎng)期安全性數(shù)據(jù)����。該公司計(jì)劃將其他長(zhǎng)期安全性數(shù)據(jù)納入上市申請(qǐng)��,并于明年上半年重新提交其上市申請(qǐng)��。
5.和譽(yù)CSF-1R小分子抑制劑授權(quán)默克�����。和譽(yù)醫(yī)藥宣布已與德國(guó)默克就其臨床后期CSF-1R小分子抑制劑pimicotinib(ABSK021)達(dá)成獨(dú)家許可協(xié)議�����,授予后者在中國(guó)大陸��、香港��、澳門和臺(tái)灣地區(qū)針對(duì)pimicotinib就所有適應(yīng)癥進(jìn)行商業(yè)化的許可�����,和譽(yù)醫(yī)藥將保留在授權(quán)區(qū)域內(nèi)獨(dú)家開(kāi)發(fā)pimicotinib的權(quán)利。根據(jù)協(xié)議����,和譽(yù)醫(yī)藥將獲得7000萬(wàn)美元首付款��,如果德國(guó)默克行使全球商業(yè)化選擇權(quán)��,和譽(yù)醫(yī)藥還將獲得額外款項(xiàng)�����,交易總額可能高達(dá)6.055億美元��。
國(guó)際藥訊
1.NK-1受體拮抗劑美國(guó)報(bào)胃輕癱NDA����。Vanda公司神經(jīng)激肽-1(NK-1)受體拮抗劑tradipitant的新藥申請(qǐng)(NDA)獲FDA受理,用于治療胃輕癱��。PDUFA日期為明年9月18日。tradipitant可影響胃蠕動(dòng)過(guò)程����,并在負(fù)責(zé)惡心和嘔吐的腦區(qū)域直接影響神經(jīng)傳遞,從而起到治療胃輕癱癥狀的作用����。今年5月����,該新藥也在治療暈動(dòng)癥(尤指暈車)的III期Motion Syros研究獲得積極結(jié)果��。
2.長(zhǎng)效VEGF眼科新藥Ⅱ期臨床成功��。EyePoint公司VEGF受體阻斷劑EYP-1901治療濕性年齡相關(guān)性黃斑變性(AMD)的Ⅱ期臨床DAVIO 2達(dá)到所有主要終點(diǎn)和次要終點(diǎn)��。與aflibercept相比����,EYP-1901(2mg和3mg)治療患者的最佳矯正視力 (BCVA)(第28周和第32周合并)效果達(dá)到非劣效性標(biāo)準(zhǔn)(組間差為-0.3和-0.4個(gè)字母)����;患者治療負(fù)擔(dān)分別減少了89%和85%�����,近三分之二的眼睛在長(zhǎng)達(dá)六個(gè)月的時(shí)間內(nèi)無(wú)需額外治療�����。藥物安全性良好����。貝達(dá)藥業(yè)擁有EYP-1901的中國(guó)權(quán)益����。
3.Arcturus公司CFTR靶向藥獲孤兒藥資格����。FDA授予Arcturus 公司開(kāi)發(fā)擬用于治療囊性纖維化(CF)的候選藥物ARCT-032孤兒藥資格�����。ARCT-032利用Arcturus的LUNAR®脂質(zhì)氣溶膠平臺(tái)將囊性纖維化跨膜傳導(dǎo)調(diào)節(jié)因子(CFTR)信使RNA輸送到肺部����,并在肺部表達(dá)CFTR mRNA的功能拷貝以恢復(fù)CFTR的活性����,減輕導(dǎo)致進(jìn)行性肺部疾病的下游效應(yīng)����。該公司將在明年上半年公布ARCT-032治療CF的Ⅰb 期中期數(shù)據(jù)。
4.羅氏BTK抑制劑部分臨床被FDA暫停�����。羅氏口服BTK抑制劑fenebrutinib在治療復(fù)發(fā)性多發(fā)性硬化癥(RMS)的III期FENhance研究中觀察到藥物性肝損傷事件。有兩例患者接受治療后出現(xiàn)肝轉(zhuǎn)氨酶(肝酶)升高并伴有膽紅素升高�����,兩例患者均無(wú)癥狀����,停藥后指標(biāo)恢復(fù)正常����。目前��,F(xiàn)DA已暫停針對(duì)RMS的III期FENhance I試驗(yàn)在美國(guó)的新入組工作。在美國(guó)以外國(guó)家/地區(qū)的入組工作仍在繼續(xù)��。
5.阿斯利康布局“不可成藥”藥物賽道��。阿斯利康與Absci公司將利用后者創(chuàng)新生成性人工智能(AI)技術(shù)��,為特定的腫瘤靶標(biāo)開(kāi)發(fā)治療性候選抗體�����。Absci技術(shù)平臺(tái)通過(guò)測(cè)量數(shù)百萬(wàn)個(gè)蛋白質(zhì)-蛋白質(zhì)相互作用來(lái)生成專有數(shù)據(jù),以發(fā)現(xiàn)創(chuàng)新��、“不可成藥”藥物靶點(diǎn)來(lái)提高藥物成功開(kāi)發(fā)的可能性��。根據(jù)協(xié)議����,Absci將獲得預(yù)付款����、研發(fā)經(jīng)費(fèi)和里程碑款項(xiàng)等,總金額高達(dá)2.47億美元��。
6.創(chuàng)新細(xì)胞遞送基因藥物公司完成A輪融資�����。Cytonus公司宣布完成金額達(dá)1170萬(wàn)美元的A輪融資��,以用于開(kāi)發(fā)一種全新的藥物遞送方式����,通過(guò)改造細(xì)胞(cargocytes)作為脂質(zhì)納米顆粒的替代品,將編碼抗癌蛋白的mRNA療法遞送到腫瘤中�����,治療轉(zhuǎn)移性癌癥和中樞神經(jīng)系統(tǒng)(CNS)疾病。該公司還計(jì)劃將cargocytes應(yīng)用于溶瘤病毒����,開(kāi)發(fā)出能通過(guò)系統(tǒng)性注射給藥的溶瘤病毒療法。
醫(yī)藥熱點(diǎn)
1.上海“誕生” 脊柱健康個(gè)性化測(cè)量門診�����。為持續(xù)推動(dòng)脊柱健康管理的理念����,上海市第十人民醫(yī)院骨科探索性開(kāi)設(shè)的脊柱健康個(gè)性化測(cè)量門診正式開(kāi)診�����。在脊柱健康個(gè)性化測(cè)量門診��,醫(yī)生將為就診者測(cè)定與脊柱有關(guān)的數(shù)據(jù)并通過(guò)后臺(tái)AI數(shù)據(jù)庫(kù)測(cè)算�����,生成一張專屬的健康報(bào)告�����。在診斷的基礎(chǔ)上��,根據(jù)患者的睡眠習(xí)慣�����、工作學(xué)習(xí)場(chǎng)景�����、脊柱病變情況等提出個(gè)體化方案(比如:要睡多硬的床墊�����、要枕多高的枕頭�����、工作時(shí)的桌椅多高為宜等)。
2.中國(guó)醫(yī)學(xué)科學(xué)院血液病醫(yī)院互聯(lián)網(wǎng)醫(yī)院?jiǎn)?dòng)����。11月25日,中國(guó)醫(yī)學(xué)科學(xué)院血液病醫(yī)院互聯(lián)網(wǎng)醫(yī)院在中國(guó)血液病?����?平涣鞴ぷ鲿?huì)議上舉辦啟動(dòng)儀式����。血液病醫(yī)院互聯(lián)網(wǎng)醫(yī)院構(gòu)建起覆蓋診前����、診中��、診后的線上線下一體化醫(yī)療服務(wù)模式�����,為全國(guó)患者提供包括預(yù)約掛號(hào)、預(yù)約取號(hào)�����、門診繳費(fèi)����、檢查檢驗(yàn)報(bào)告查看��、辦理入院����、住院押金繳費(fèi)��、每日清單����、出院結(jié)算等服務(wù),還有在線問(wèn)診��、藥品郵寄��、專家咨詢��、隨訪管理等線上診療服務(wù)��?�;颊呖赏ㄟ^(guò)支付寶搜索【血液病醫(yī)院互聯(lián)網(wǎng)醫(yī)院】小程序�����,登錄后即可享受全病程的診療服務(wù)��。
3.柳葉刀子刊:中國(guó)癌癥死亡上升21.6%��。近日����,中國(guó)疾控中心殷鵬、齊金蕾����、首都醫(yī)科大學(xué)李夢(mèng)龍等研究人員在《柳葉刀》子刊" The Lancet Public Health "上發(fā)表的一篇最新研究論文顯示�����,2005-2020年����,中國(guó)癌癥相關(guān)總死亡人數(shù)增加21.6%��,在男性和女性中����,前三大致命癌癥依次是:氣管癌、支氣管癌和肺癌��;肝癌;胃癌�����。
4.廣東省全面推進(jìn)醫(yī)療設(shè)備租賃入院�����。近日����,廣東省政府發(fā)布《在我省教育科技��、衛(wèi)生健康等領(lǐng)域開(kāi)展設(shè)備租賃試點(diǎn)工作方案的通知》��,并且同步下發(fā)了《關(guān)于在我省教育領(lǐng)域開(kāi)展設(shè)備租賃試點(diǎn)的工作方案》。這份文件明確為加快先進(jìn)設(shè)備購(gòu)置�����、緩解財(cái)政一次性支出壓力��,提升相關(guān)醫(yī)療服務(wù)能力并補(bǔ)齊短板,開(kāi)展在醫(yī)療機(jī)構(gòu)相關(guān)醫(yī)療設(shè)備租賃試點(diǎn)��。
評(píng)審動(dòng)態(tài)
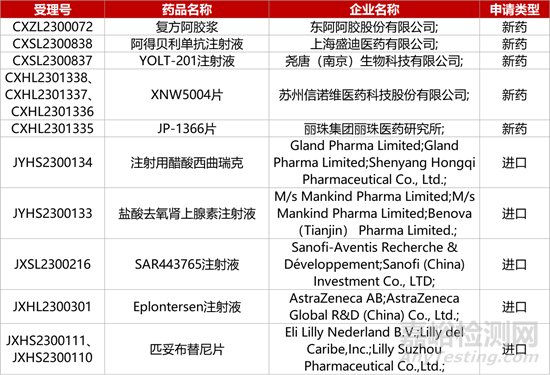
1. CDE新藥受理情況(12月05日)
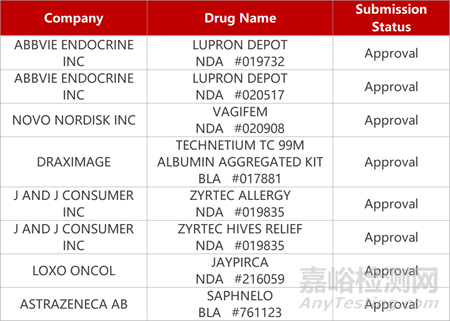
2. FDA新藥獲批情況(北美12月04日)