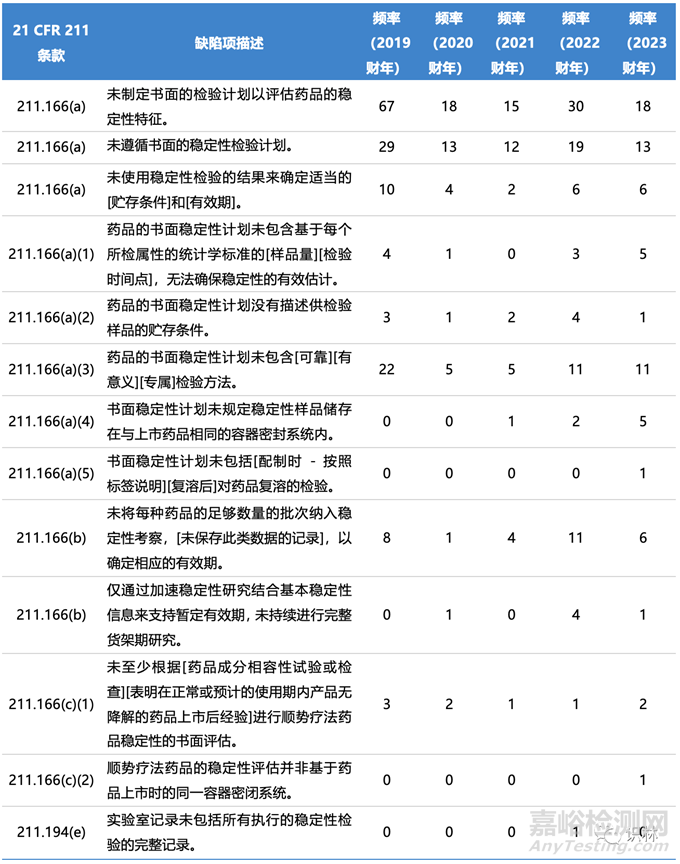
穩(wěn)定性相關(guān)缺陷和頻率
藥物穩(wěn)定性研究是一門成熟的學(xué)科�����,當(dāng)然也是一項(xiàng)重要的監(jiān)管要求��,近年來許多FDA 483中提到了穩(wěn)定性計(jì)劃的缺陷�����。表1概述了近年來與穩(wěn)定性相關(guān)的典型缺陷和出現(xiàn)頻率�����。
表1. FDA近年來483表涉及穩(wěn)定性的缺陷項(xiàng)和出現(xiàn)頻率
中美檢查文件中對(duì)穩(wěn)定性的關(guān)注點(diǎn)
除法規(guī)要求外�����,中美監(jiān)管機(jī)構(gòu)/組織也制定了相應(yīng)的檢查工作程序或合規(guī)手冊(cè)�����,明確了穩(wěn)定性的檢查范圍、要求及風(fēng)險(xiǎn)的判定原則���,并列舉了穩(wěn)定性相關(guān)的檢查缺陷��,見表2���。
表2. 中美現(xiàn)場(chǎng)檢查程序文件中穩(wěn)定性相關(guān)要求和缺陷
穩(wěn)定性相關(guān)FDA警告信案例
20210127 Allay Pharmaceuticals, LLC 美國 FDF
3. 企業(yè)未能建立并遵守旨在評(píng)估藥品穩(wěn)定性特征的充分的書面檢驗(yàn)程序,并使用穩(wěn)定性試驗(yàn)結(jié)果判定適當(dāng)?shù)馁A存條件和有效期(21 CFR 211.166(a))���。
企業(yè)的穩(wěn)定性計(jì)劃是不充分的��。企業(yè)使用新供應(yīng)商的API生產(chǎn)的商業(yè)規(guī)模驗(yàn)證批沒有充分的長期穩(wěn)定性數(shù)據(jù)支持�����。此外����,企業(yè)未能通過始終如一地執(zhí)行崩解檢驗(yàn)來遵守穩(wěn)定性檢驗(yàn)方案�����。使用新API供應(yīng)商的驗(yàn)證批次是在2019年5月16日至6月25日生產(chǎn)的,但直到2020年5月1日(差不多一年后)才被納入長期穩(wěn)定性研究���。
穩(wěn)定性數(shù)據(jù)對(duì)于確保產(chǎn)品在其貨架期內(nèi)保持鑒別、規(guī)格�����、質(zhì)量�����、純度和安全性至關(guān)重要�。
在回復(fù)中,企業(yè)表示已啟動(dòng)了針對(duì)穩(wěn)定性檢驗(yàn)缺失的偏差調(diào)查���,并且這些缺陷不會(huì)再次發(fā)生���。還將聘請(qǐng)穩(wěn)定性協(xié)調(diào)員來監(jiān)督穩(wěn)定性計(jì)劃。
企業(yè)的回復(fù)不充分����,因?yàn)闆]有提供臨時(shí)措施來解決在售產(chǎn)品缺乏長期穩(wěn)定性數(shù)據(jù)的問題。
在對(duì)此函的回復(fù)中,請(qǐng)?zhí)峁┮韵聝?nèi)容:
一份綜合獨(dú)立評(píng)估以及CAPA計(jì)劃����,以確保穩(wěn)定性計(jì)劃的充分性。整改后的計(jì)劃應(yīng)包括但不限于:
具有穩(wěn)定指示性的方法��;
每種藥品允許分銷前在其容器密封系統(tǒng)中的穩(wěn)定性研究��;
持續(xù)計(jì)劃�,每年增加每個(gè)產(chǎn)品的代表性批次以確定貨架期聲明是否仍然有效;
每個(gè)點(diǎn)(時(shí)間點(diǎn))要檢測(cè)的具體屬性的詳細(xì)定義�;
描述整改后的穩(wěn)定性計(jì)劃的以上要素和其他要素的所有規(guī)程。